PharmacoEconomics:等待 5 年才确诊,95% 无特效药!罕见病患者困境背后,孤儿药评估体系如何破局?
时间:2025-09-11 12:16:39 来源 网络 作者:网络
罕见疾病在全球范围内影响着超过四亿人口,这些疾病通常被定义为患病率极低的病症,例如在美国患者数量少于二十万,或在欧盟中患病率低于两千分之一。尽管患者总数庞大,但由于每种具体罕见病的患者数量极少,导致其诊断和治疗面临巨大挑战。据统计,罕见病患者平均需要等待五年才能获得明确诊断,而约百分之九十五的罕见病目前尚无批准的有效治疗方法,这使得罕见病患者在医疗资源获取和健康公平性方面处于严重劣势。许多罕见病属于危及生命的遗传性疾病,约半数患者为儿童,这不仅对患者个体造成沉重负担,也对其家庭和社会带来深远影响。罕见病的社会经济负担不仅包括直接的医疗支出,还涉及因生产力损失、家庭照护、交通住宿等非医疗成本,有研究显示,超过一半的罕见病经济负担来自于非直接医疗费用。

孤儿药是专门用于预防、诊断或治疗罕见病的药物,然而,由于其目标患者群体规模极小,药品销售收入往往难以覆盖研发成本,这使得制药企业缺乏投入孤儿药研发的经济动力。为激励这一领域的创新,多个国家和地区出台了相关政策法规,如美国的《孤儿药法案》和欧盟的《孤儿药法规》。尽管这些政策在鼓励研发方面取得了一定成效,孤儿药在上市后仍面临卫生技术评估过程中的特殊挑战。卫生技术评估通常旨在通过系统评价健康干预措施的效果、成本及其他相关结果,以指导资源分配决策,但其传统评估框架主要针对常见疾病设计,难以直接适用于证据基础薄弱的罕见病领域。
在罕见病药物研发和证据生成过程中,存在若干特殊难点。首先,自然病史数据的缺乏以及国际疾病分类编码的不完善,使得疾病进展规律难以准确把握,患者人群规模估计存在较大不确定性,进而影响预算影响分析和长期疗效推断。其次,临床试验的样本量通常非常有限,在罕见病中,一项纳入一百至一百五十名患者的试验已属大规模,这种小样本特性使得统计检验效能不足,难以检测出具有显著意义的治疗效果,同时也限制了亚组分析的可靠性。此外,由于伦理考量,许多罕见病试验难以采用随机安慰剂对照设计,而常使用外部历史对照或单臂试验设计,这类非传统研究设计在证据强度上常被认为低于随机对照试验。
另一个核心问题是终点指标的选择与验证。大多数罕见病缺乏经过充分验证的疾病特异性终点,因此临床试验往往借用常见疾病的评估工具,这些工具可能无法全面捕捉罕见病特有的症状变化或治疗获益。例如,在多发性硬化症中广泛使用的扩展残疾状态量表,在用于视神经脊髓炎谱系疾病时可能无法充分反映视力损害的程度。患者报告结局在罕见病中也常使用通用量表而非疾病特异性工具,这可能导致对治疗影响的低估或忽略。尽管开发新的终点指标是一种解决方案,但其验证过程耗时漫长,且在小样本人群中难以实现充分的心理测量学验证。
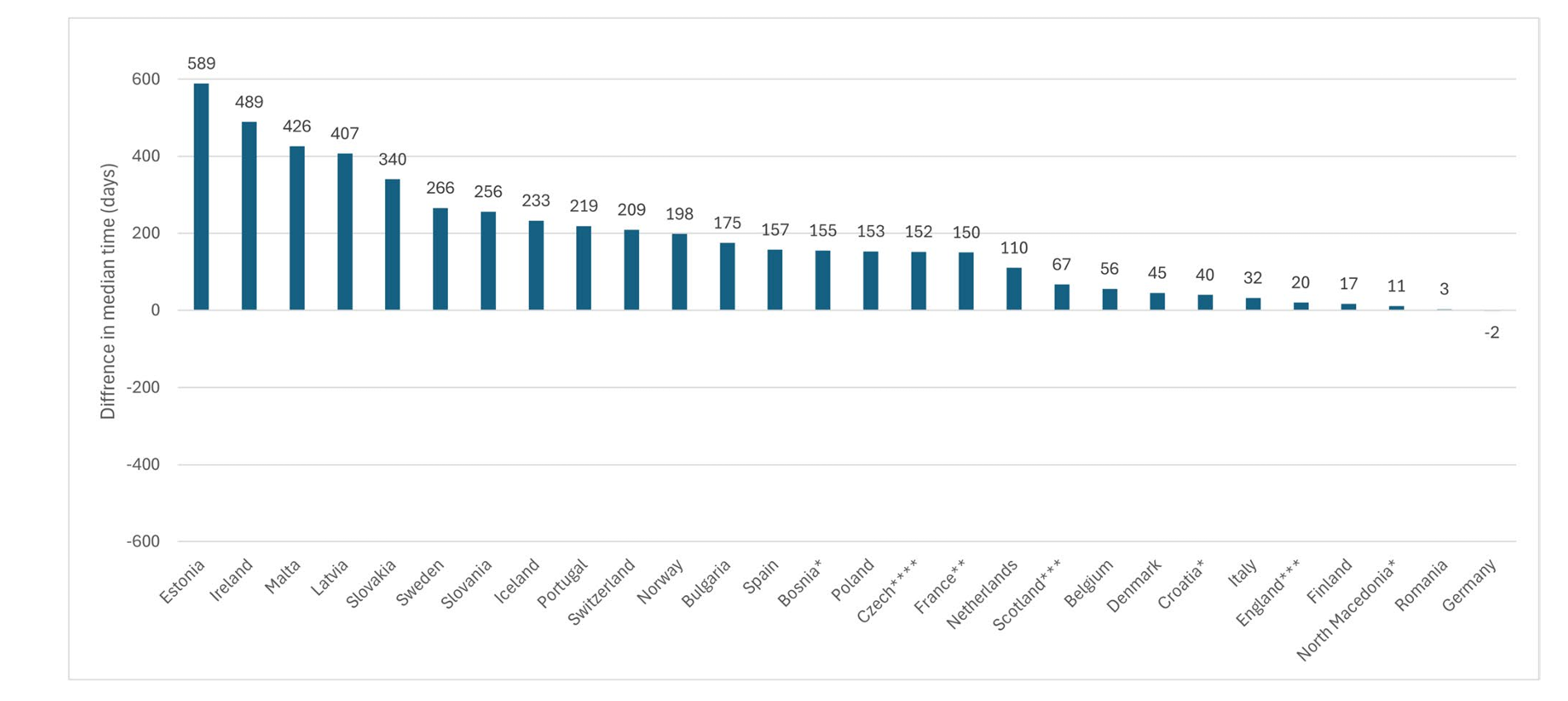
图: 欧洲药品管理局批准上市至各国上市的中位时间差异
针对这些挑战,部分国家的卫生技术评估机构已尝试调整评估流程和要求。例如,英国国家健康与护理卓越研究所设立了高度专项技术评估程序,专门针对那些患病率极低、病情严重且无替代疗法的罕见病药物。该程序允许在证据存在不确定性的情况下通过管理准入协议实现有条件报销,同时在后续数据收集中进行再评估。在德国,孤儿药在获得上市许可时自动被认定具有“附加效益”,但若年度销售额超过一定阈值,则需接受全面的效益评估,评估结果将作为价格谈判的依据。分析显示,在2011至2022年间完成的二十三项全面评估中,近八成孤儿药经历了价格下调,其中未能证明附加效益的药物降价幅度更大。
值得注意的是,当前基于成本效果阈值的评估方法可能无法充分反映孤儿药的社会价值。公众对于医疗资源分配的偏好研究表明,尽管疾病罕见性本身并不直接导致支付意愿增加,但社会更倾向于支持那些针对严重疾病、缺乏替代治疗方案、或能带来较大相对健康获益的药物。因此,仅从医疗卫生系统角度进行经济评估可能会低估孤儿药的真实价值,因其未能充分考虑患者家庭的生产力损失、照护负担以及情感成本等广泛的社会影响。此外,严格的成本效果要求和预算影响限制还可能影响制药公司的研发动力,进而损害动态效率,即资源分配与创新激励之间的长期平衡。
为解决上述问题,作者提出多项建议。首先,应扩大价值评估的视角,不仅包括直接医疗成本,还应纳入直接非医疗成本(如患者及家属的交通、住宿费用)和间接成本(如生产力损失),从而更全面地体现孤儿药的社会价值。其次,需建立针对罕见病的扩展评估框架,明确如何在证据不确定的情况下进行决策,并通过管理准入等机制实现患者早期可及。第三,建议采用多准则决策分析或成本结果分析等替代方法,超越传统的成本效果分析框架,以更灵活地整合多种证据类型和结果维度。第四,倡导多方合作,包括企业、患者组织、临床专家和评估机构之间的早期对话,共同推动终点开发、自然病史研究以及证据生成策略的优化。最后,应在定价和报销政策中引入动态效率的考量,通过专利买断、专项预算或调整成本效果阈值等方式,保障孤儿药研发的可持续创新。
欧洲在加速孤儿药评估方面也展现出积极的合作趋势,例如通过EUnetHTA、Beneluxa倡议和北欧联合HTA合作等机制开展跨国评估协作。自2028年起,欧盟联合临床评估将适用于所有孤儿药,有望减少重复评估,加快患者获取新药的速度。然而,尽管临床评估将趋于统一,成本效果和报销决策仍由各成员国自行决定。
综上所述,罕见病领域的卫生技术评估不仅面临证据稀缺的挑战,还需应对证据生成、终点选择、价值评估和多维决策等方面的特殊问题。通过调整评估框架、扩大价值视角、强化多方合作和引入灵活的决策方法,有望在科学评估和患者可及之间找到更合理的平衡,最终改善罕见病患者的健康结局并促进健康公平。
原始出处:
Basu A, Thomas SK, Chapman RH, Spangler J. HTA Evidence in Rare Diseases: Just Rare or Also Special? PharmacoEconomics. 2025. https://doi.org/10.1007/s40273-025-01538-4
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。


