代谢紊乱是肝脏疾病和多种心血管疾病的共同土壤。长期饮酒引发的酒精性肝病(ALD)和高胆固醇血症导致的动脉粥样硬化,均与关键代谢酶活性失衡密切相关。近期,重庆医科大学、中科大附属第一医院、医科院药物所等单位合作取得进展:首次阐明ACSS2-铁代谢轴对酒精性肝损伤的保护机制,明确了关键代谢通路的调控节点;首次阐明新型AMPK激动剂在对抗高胆固醇血症和动脉粥样硬化中的作用和机制,为代谢性心血管疾病提供了潜在药物的新选择。
研究一:ACSS2通过表观遗传调控铁稳态,阻遏酒精性肝病进展
长期大量饮酒可导致高血压、心肌病、心律失常等心血管问题,显著增加心血管疾病患者的死亡风险。酒精相关性肝病(ALD)是长期大量饮酒引发的一系列肝脏疾病,涵盖了酒精性脂肪肝、肝炎、肝硬化乃至肝细胞癌等多种病理状态。近年来,全球饮酒水平呈现上升趋势,随之而来的是ALD发病率的不断攀升。遗憾的是,目前对于晚期ALD尚缺乏有效的药物治疗手段,肝移植几乎是唯一的治愈途径。
乙醇主要在肝脏代谢,其代谢过程涉及多个酶的参与。乙醇首先在细胞色素P450家族2亚家族E成员1 (CYP2E1)和乙醇脱氢酶(ADH)的催化下转化为乙醛,随后乙醛在醛脱氢酶(ALDH)的作用下进一步转化为乙酸。酰基辅酶A合成酶短链家族成员2 (ACSS2)是一种关键的代谢酶,能够催化乙酸生成乙酰辅酶A,参与脂肪酸合成、三羧酸循环及表观遗传修饰等过程。尽管已有研究表明ACSS2在多种生理和病理过程中发挥重要作用,但其在ALD中的具体作用机制尚未完全明确。
2025年7月1日,重庆医科大学脂质研究中心胡文全教授团队与中国科学技术大学段亚君教授团队在国际知名学术期刊Nature Communications上发表了题为“ACSS2 protects against alcohol-induced hepatocyte ferroptosis through regulation of hepcidin expression”的研究论文,使用多组学联合分析,揭示了ACSS2通过代谢-表观遗传途径交叉调节全身铁代谢,从而抵抗酒精诱导的肝细胞铁死亡的新机制。
本研究首先通过结合临床样本和GEO数据库,发现ALD患者血清乙酸水平显著升高,且ACSS2主要富集于肝实质细胞中。酒精处理可剂量依赖性降低AML12、HepG2细胞和原代肝细胞中ACSS2表达,人类和小鼠ALD样本显示酒精摄入后ACSS2水平降低。利用基因编辑技术构建的ACSS2敲除小鼠模型显示,乙醇喂养后,ACSS2缺失加剧肝损伤、炎症反应。相反,ACSS2过表达减轻酒精诱导的不良反应。
在机制研究方面,本研究通过转录组学和氧化脂质组学分析发现,ACSS2缺失导致全身铁稳态紊乱,主要是HAMP1/2 (编码铁调素的基因)水平的下降,从而导致血清和肝脏中铁调素水平降低,铁水平升高,脾脏和十二指肠中铁水平降低。铁调素是一种由肝脏合成和分泌的肽类激素,通过与铁泵蛋白(FPN)结合,介导FPN的泛素化、内化及降解,从而阻断铁输出到循环中,对全身铁稳态起到负性调节作用。
肝脏铁蓄积与长期饮酒相关,且铁调素的缺乏会导致严重的铁超负荷。因此,本研究也发现ACSS2缺失加剧酒精诱导的肝细胞铁沉积,导致氧化应激标志物水平升高,GSH和SOD水平降低,脂质过氧化水平升高,线粒体超微结构受损,表明ACSS2缺乏通过影响铁代谢,进而加剧酒精诱导的肝细胞铁死亡。
此外,表观遗传学实验显示,ACSS2特异性结合CBP形成转录调控复合物,促进HAMP1/2启动子区域组蛋白乙酰化修饰。ACSS2缺失时,CBP和乙酰化组蛋白在HAMP1/2启动子区域的富集度降低,导致HAMP1/2表达下调,揭示了酒精介导的ACSS2水平下降引发铁代谢紊乱的分子机制。
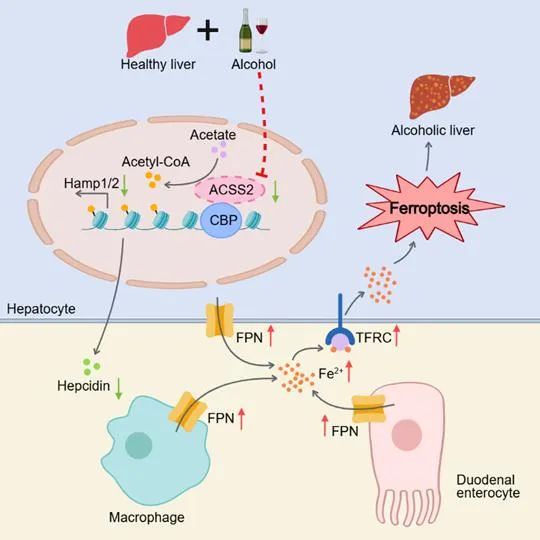
综上所述,本研究揭示了ACSS2在ALD发病机制中的关键作用,即ACSS2通过CBP介导的组蛋白乙酰化调控HAMP1/2表达,从而维持铁稳态并抑制肝细胞铁死亡。这一发现不仅阐明了ALD中铁超载的分子机制,而且提出了靶向ACSS2-HAMP轴的治疗新策略。
重庆医科大学脂质研究中心胡文全教授和中国科学技术大学第一附属医院(安徽省省立医院)心血管内科段亚君教授为该论文的通讯作者,王梦瑶博士和博士生文潇为本论文的第一作者。
研究二:新型AMPK激动剂IMM-H007有效拮抗高胆固醇血症和动脉粥样硬化
ACSS2通过调控乙酸代谢进而影响表观遗传修饰,揭示了代谢与基因表达调控之间的重要联系。而AMPK作为细胞能量代谢的核心传感器,也在维持脂质稳态中发挥关键作用。近期,课题组开展合作在新型AMPK激动剂的研究中亦取得突破,为高胆固醇血症和动脉粥样硬化的治疗带来新思路。虽然两项研究分别聚焦于不同的代谢通路,但有趣的是,ACSS2也被认为是AMPK信号通路的下游调控因子,其功能与能量感知机制存在潜在关联。
加强高胆固醇血症的防治是降低动脉粥样硬化性心血管疾病发生率的关键环节,然而,目前针对这一临床需求仍存在缺口。AMPK是由α、β、γ三个亚基组成的异源三聚体丝氨酸/苏氨酸蛋白激酶,AMPK的激活与促进脂质代谢密切相关。2′,3′,5′-三-O-乙酰基-N6-(3-羟基苯基)腺苷(IMM-H007)由中国医学科学院药物研究所朱海波教授团队研发,是具有中国自主知识产权的新型AMPK激动剂。在体内,IMM-H007代谢为H007-M1并通过核苷转运体进入细胞。IMM-H007已被证明通过激活AMPK发挥多种药理作用,包括抑制炎症、改善心脏功能和改善肝脏脂肪变性等。然而,IMM-H007对高胆固醇血症中胆固醇和甘油三酯代谢的影响和具体调控机制有待进一步研究。
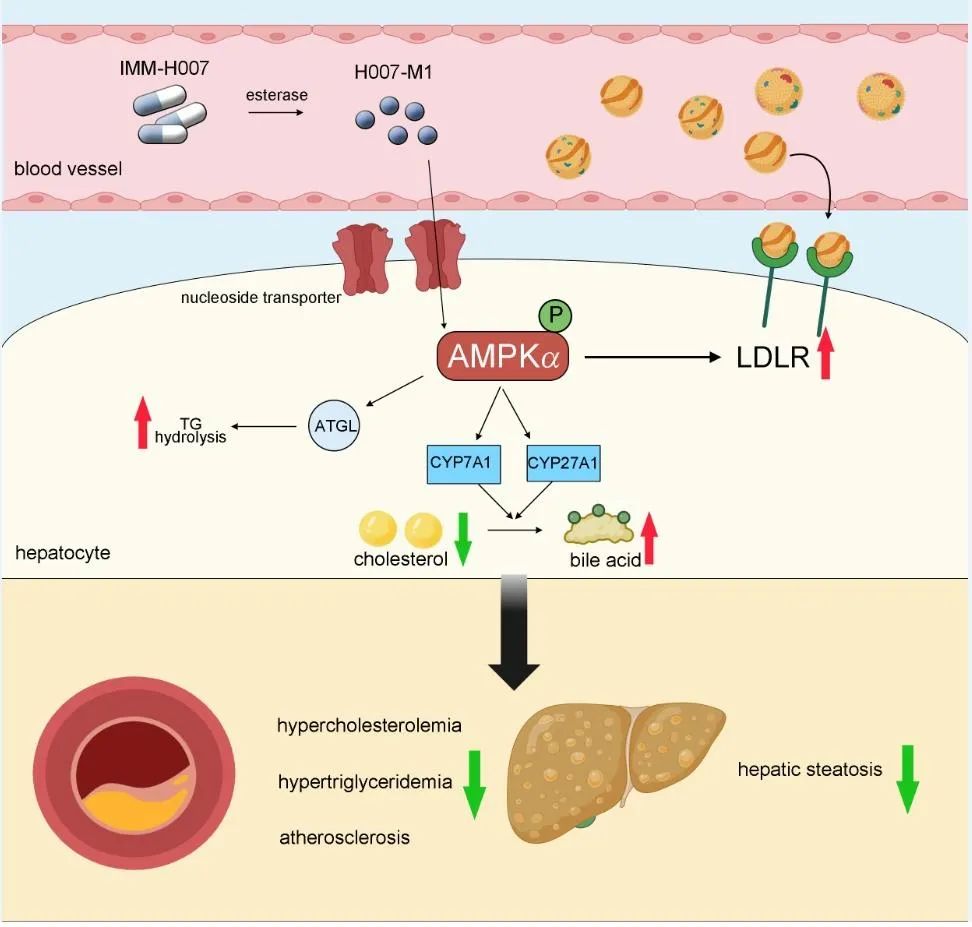
中国科学技术大学段亚君团队和中国医学科学院药物研究所教授团队使用Apoe-/-和Ldlr-/-小鼠建立高胆固醇血症/动脉粥样硬化模型,证明IMM-H007有效改善了脂质代谢和斑块形成。在分子机制上,本研究利用肝脏特异性基因敲除小鼠和体外细胞模型,结合转录组测序等多种技术手段,揭示了IMM-H007通过激活AMPKα,双重调控LDLR介导的肝脏胆固醇摄取和CYP7A1/CYP27A1驱动的胆汁酸代谢通路,同时促进甘油三酯水解,多维度改善脂质代谢。此外,在胆固醇水平变化不显著的条件下,IMM-H007仍然能够抑制动脉粥样硬化,预示IMM-H007存在非胆固醇依赖的途径抑制动脉粥样硬化。总之,本研究提示IMM-H007是一种有前景的治疗高胆固醇血症和动脉粥样硬化药物,为药物应用于代谢性心血管疾病治疗提供了转化依据。该文章发表在《药学学报》英文刊(Acta Pharmaceutica Sinica B)。
该研究工作得到了国家重点研发计划、国家自然科学基金、中国医学科学院医学科学创新基金、中央高校基本科研业务费专项资金和中国科学技术大学“双一流”项目的支持。中国科学技术大学段亚君教授和中国医学科学院药物研究所教授为该论文的共同通讯作者,中国科学技术大学附属第一医院李家琪博士后为该论文第一作者。
原文链接:
https://www.nature.com/articles/s41467-025-61067-8
https://www.sciencedirect.com/science/article/pii/S2211383525003193