临床中,胶囊广泛用于各种药物的口服给药,但实时追踪药物的释放行为并根据治疗效果调整剂量仍具有挑战性。
2024年12月11日,北京化工大学宋继彬、北京大学穆婧共同通讯在 ACS Nano 在线发表题为 “NIR-II Ratiometric Optical Theranostic Capsule for In Situ Diagnosis and Precise Therapy of Intestinal Inflammation ” 的研究论文。该研究开发了负载两种荧光纳米颗粒的治疗诊断胶囊,H2O2-响应型JanusAg/Ag2S纳米颗粒(Ag/Ag2SJNPs)和下转换纳米颗粒(DCNP),以及地塞米松(Dex)药物。
Ag/Ag2SJNPs在1250nm处表现出高灵敏荧光(FL)信号,而DCNP在1550nm处的FL信号在生理条件下保持稳定。这两个FL信号的比率形成比率FL信号,与H2O2浓度相关,检测极限为1.7μM。此外,胶囊可以精确地输送到肠道中,同时释放JNPs和DCNPs。H2O2触发的比率荧光信号和图像可以诊断炎症并指示其位置。同时,封装的Dex在疾病区域释放,比率成像实时跟踪治疗效果,并提供指导。治疗诊断胶囊系统提供了一种定量检测疾病生物标志物和局部释放治疗剂的方法,避免用药过量并减少副作用。

自身免疫性疾病和传染病等炎症性疾病是全球人类健康面临的主要威胁之一。炎症可通过常规血液检查、粪便检查或组织活检等体外或离体方法进行诊断,这些方法耗时且缺乏精确性。相反,原位诊断探针提供了一种更直接的炎症检测方法。近期研究使用基于MOF的荧光(FL)纳米探针诊断肺炎,使用基于金属的光声纳米探针来检测关节炎。然而,传统的成像方式主要是定性的,难以准确量化复杂的炎症微环境。因此,迫切需要开发能够原位量化炎症的先进技术和纳米探针。
一般来说,大多数炎症诊断探针是局部注射到炎症部位,如局部关节炎。然而,对于肠道炎症,口服给药简单、安全、成本效益高,且口服剂型易于大规模生产,是一种首选方法。传统的小分子探针通常缺乏稳定性,尤其是在pH敏感性方面,在口服后容易被胃酸和消化液降解,限制了其在口服给药中的应用。因此,需要开发适合口服给药的稳定探针。仅有少数口服探针能够将炎症部位的诊断成像与实时治疗指导相结合。为解决胃分解问题,可以将探针加载到pH敏感的缓释涂层中,该涂层可以抵抗恶劣的胃酸性环境,确保其在肠道pH值下逐渐降解。通过这种方式,口服探针不仅可以检测炎症,还可以监测炎症的治疗过程,从而实现诊疗一体化。无机纳米探针因其光学稳定性和易于表面适应性的特性,在口服诊疗探针的开发中显示出巨大的潜力。
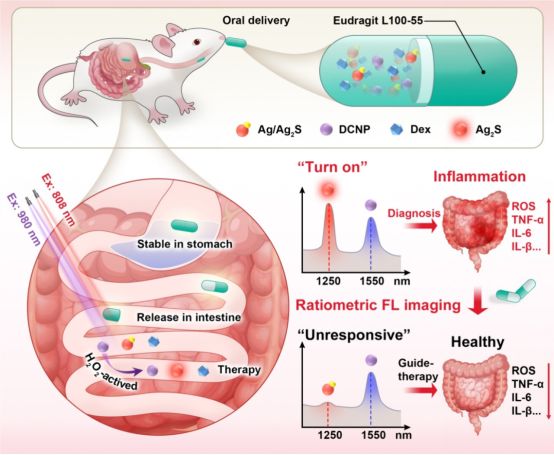
图1 制备比率式荧光纳米胶囊用于炎症原位诊断和精确治疗示意图(摘自ACS Nano)
炎症性肠病(IBD)通常由免疫系统攻击消化系统的组织引起,往往导致治疗后复发。在肠道炎症期间,巨噬细胞从M2表型极化为M1表型,促炎细胞因子的产生显著增加,如IL-6、TNF-α、IL-1β、IL-12等,同时抗炎细胞因子IL-10的表达减少。这些变化导致活性氧生成增加,加剧氧化应激,导致细胞凋亡并进一步激活炎症反应。过氧化氢(H2O2)是炎症中关键的活性氧,也是反映炎症严重程度的关键信号分子。与正常组织相比,炎症组织往往具有更高水平的H2O2。同时,内源性生物能源可以在炎症部位产生H2O2。因此,肠H2O2可用作诊断IBD的生物标志物。鉴于H2O2作为内部反应刺激的巨大潜力,开发H2O2响应纳米材料以原位定量H2O2不仅可以定位炎症区域,还可以提高炎症的治疗效率。然而,临床血液测试方法灵敏度较低,且不能识别炎症区域,难以测量原位H2O2水平。因此,迫切需要开发准确、灵敏和定量的技术来实时监测原位H2O2水平,同时实现炎症靶向治疗。
IBD通常用强效消炎药(如泼尼松)治疗,有助于减轻腹痛、呕吐、腹泻和便血等症状。虽然症状缓解表明炎症已经消退,但肠道中的残余炎症仍然存在,有可能导致IBD复发。这种复发甚至会引起严重的并发症,增加患癌风险。通常通过侵入性和不舒适的内窥镜对IBD进行诊断,需要高度的临床专业知识。相比之下,近红外(NIR)-II窗口(1000–1700nm)比NIR-I(650–900nm)优势更明显,如减少光散射和自发荧光,从而增强炎症部位的成像,具有更低的背景信号干扰、更高的灵敏度、更高的分辨率和更深的组织渗透。因此,开发灵敏可靠的NIR-II FL纳米探针对于基于体内FL的成像和原位生物活性分子的检测非常重要。在这方面,比率FL成像可减轻纳米探针浓度和激光强度等因素的背景信号干扰,与传统的绝对强度成像方法相比,可提供更准确、更灵敏的检测。
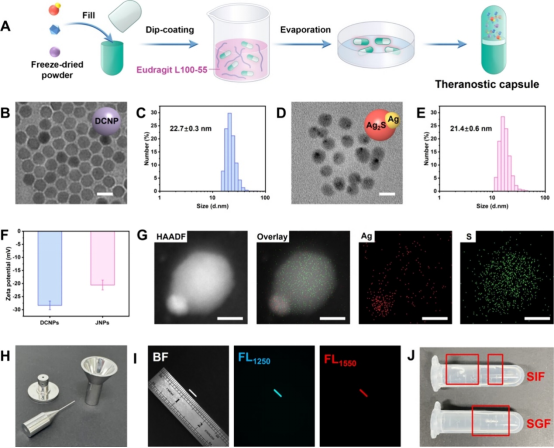
图2 肠溶胶囊的制备和表征(摘自ACS Nano)
该研究开发了一种比率式光学胶囊,用于IBD治疗的原位实时诊断和监测。将H2O2可激活的纳米探针和模型治疗剂封装在用于口服递送的肠聚合物包衣微囊中。具体来说,将Ag/Ag2S Janus纳米颗粒(JNP)、下转换纳米颗粒(DCNP)和地塞米松(Dex)封装在胶囊中,最外层包被EudragitL100-55(甲基丙烯酸-甲基丙烯酸甲酯共聚物)。EudragitL100-55是一种pH响应性聚合物,通常用于在肠道中持续释放药物(5.5-7.5)。开发的胶囊长度为8.4mm,直径为1.27mm,可用于小鼠口服给药。为增加生物相容性,用PEG对Ag/Ag2S Janus纳米颗粒和DCNPs进行修饰。随着胶囊在肠部位逐渐溶解,有效载荷逐渐释放,Dex发挥其治疗效果。相应释放的Ag/Ag2S和DCNPs纳米探针可以响应肠原位生物标记物H2O2检测IBD。Ag被肠道H2O2部分蚀刻,恢复Ag2S在1250nm的FL信号(FL1250)。相比之下,DCNPs对(FL1250)不敏感,在1550nm(FL1550)下提供标准参考信号,并使炎症部位的原位H2O2NIR-II比率FL成像成为可能。体内H2O2的定量检测不仅能够精确识别炎症区域,而且能够跟踪治疗过程并实时指导治疗,从而减少副作用并防止炎症复发。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.4c12894