AA的继发性MDS
再生障碍性贫血(AA)和阵发性睡眠性血红蛋白尿症(PNH)患者进展为骨髓增生异常综合征(MDS)和急性髓性白血病(AML)的风险较高,预后较差。然而,AA(特别是[非重度AA])后继发性MDS (sMDS)患者的临床和基因特征仍然知之甚少。此外,尽管异基因造血干细胞移植(allo-HCT)是主要的治愈方法,但移植后的结局并没有得到很好的研究。需要更多的研究来了解sMDS的移植后结局,特别是与未发生MDS进展的AA和de Novo MDS进行比较。
为解决上述问题,中国医学科学院血液病医院(中国医学科学院血液学研究所)冯四洲教授牵头回顾性研究,近日发表于《British Journal of Haematology》。

研究结果
该研究纳入677例患者,其中25例为AA后的sMDS,377例为de Novo MDS,285例为未发生MDS进展的AA。总的来说,80%的sMDS患者是从NSAA演化而来,MDS演化前的总缓解率为52%。
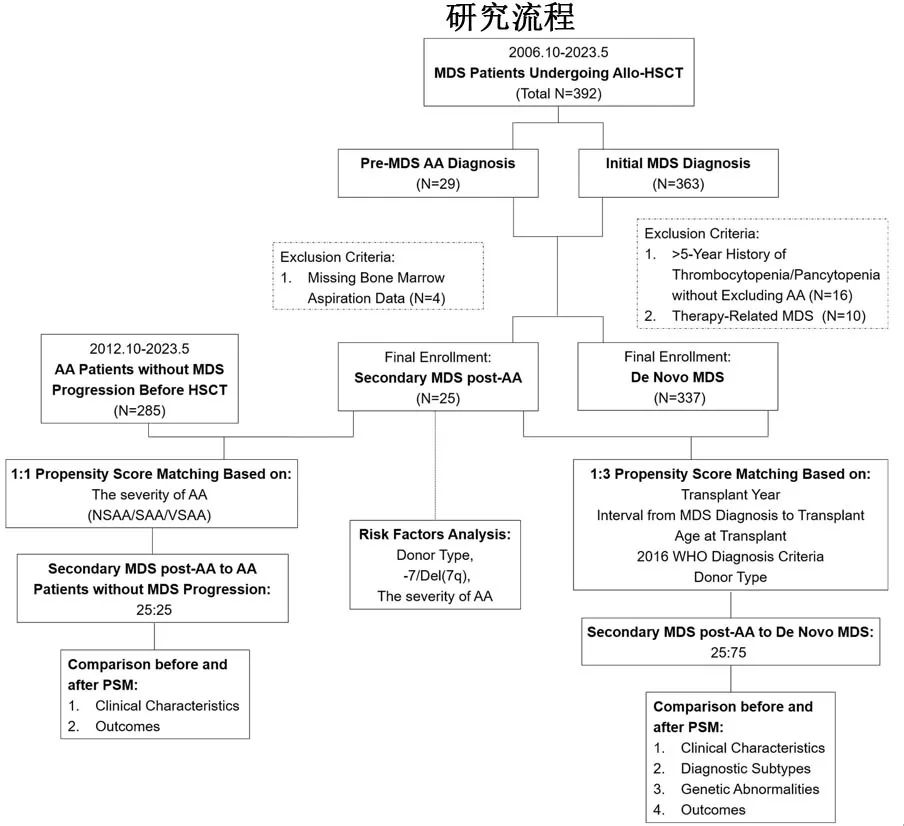
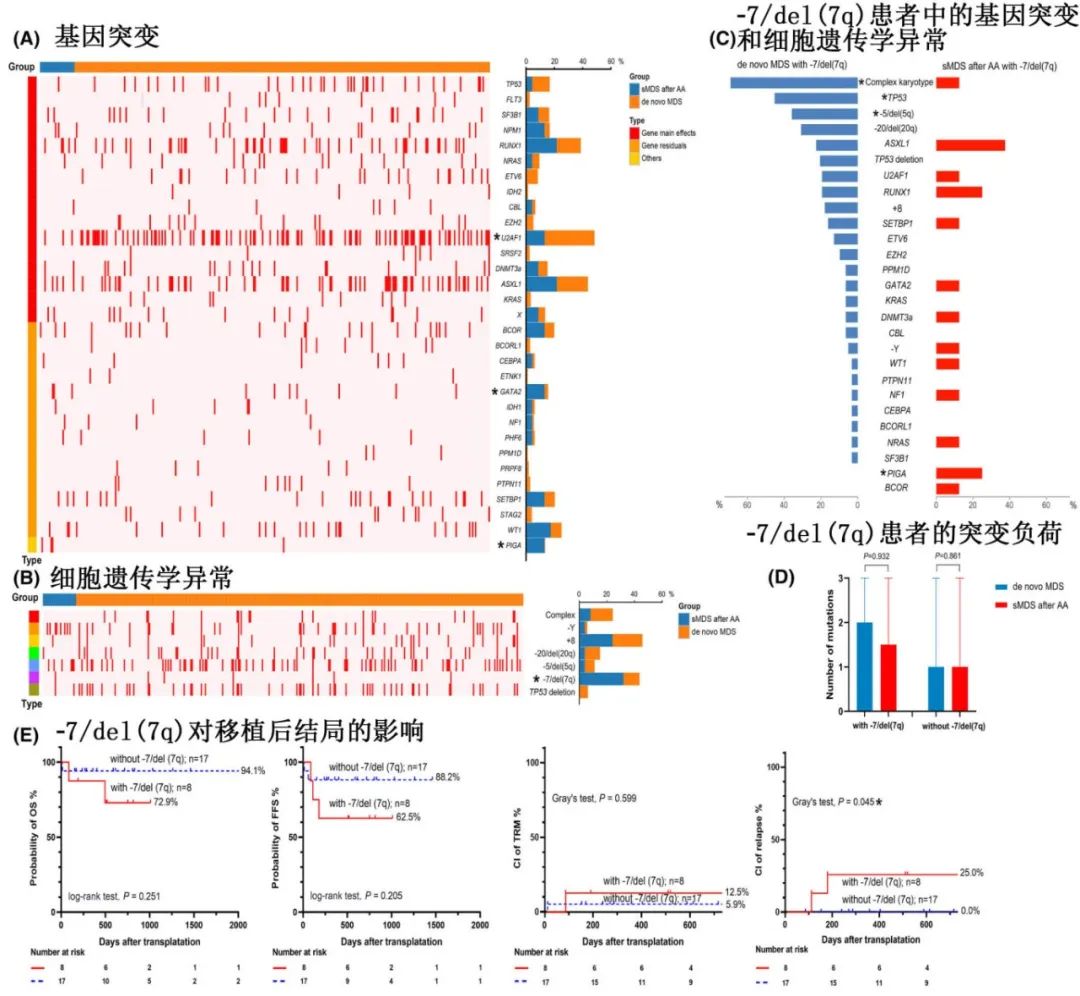
AA后的sMDS与de Novo MDS患者的诊断差异在于诊断时的原始细胞百分比例和骨髓纤维化发生率较低。基因组筛查发现,sMDS中GATA2和PIGA的频率较高,而de Novo MDS中U2AF1较高,此外sMDS中−7/del(7q)(多为孤立性)的频率高于de Novo MDS(32% vs 12%),影响移植后复发,但不影响总生存率。de Novo MDS通常与TP53突变、−5/del(5q)和复杂核型共同发生。伴−7/del(7q)的sMDS和de Novo MDS具有相似的突变负荷。相对于sMDS,7号染色体异常似乎更影响de Novo MDS的移植后结局。值得注意的是,除了疾病特异性特征之外,体能状态和移植相关因素(例如供者类型、GvHD预防、预处理方案)也是患者在allo-HCT后病程的重要决定因素。
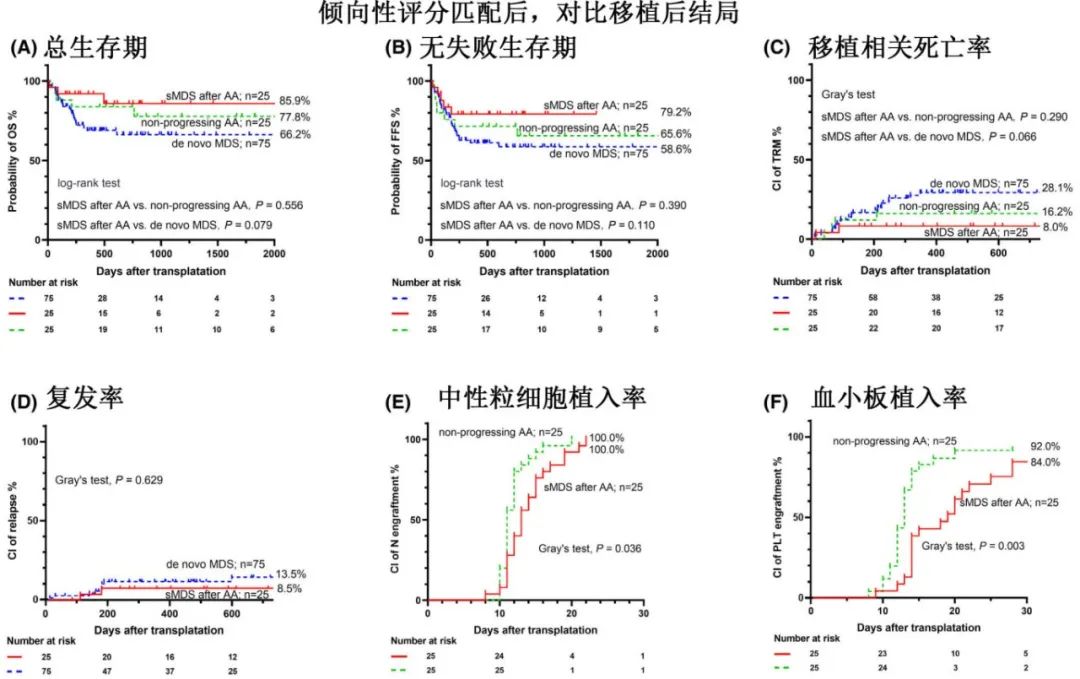
sMDS、de Novo MDS和AA具有相似的植入率、感染并发症和GvHD发生率。总体而言,AA后的sMDS是一个独特亚型,移植后生存率略高于de novo MDS,结局与未发生MDS进展的AA患者相当。鉴于该研究中更高数量的早期状态MDS和NSAA,以及排除治疗相关MDS,包括治疗技术的进步,该研究中sMDS的移植后状态比既往研究更好。
专家评论
杂志同期发表Carmelo Gurnari和Valeria Visconte教授的评论文章” Dissecting the genomic traits and clinical course of secondary myelodysplastic syndrome following aplastic anaemia: A milestone”,认为该研究具有里程碑的价值。
该研究强调MDS诊断时进行基因测序的重要性,其不会排除AA疾病表现时的低频基因突变,也可提供更多关于对免疫抑制治疗(IST)无反应或反应差的AA患者的分子状态信息,而这是与MDS/sAML进化相关的临床因素,还影响进展为髓系疾病的时间。该研究的一个有趣信息在于从AA到MDS进展的时间,以及对IST完全缓解(在allo-HCT之前)、无反应或部分缓解的变异性。显然,有许多混杂因素(包括诊断时的年龄和基线参数)可能会影响时间,但从发病开始研究这些病例的临床和分子轨迹是有意义的。鉴于克隆性造血(CH)几乎是AA的普遍特征,而可检测到的突变往往先于AA的髓系演化,在首次疾病表现时进行分子检测也将有助于了解部分CH突变是否可能是接受标准免疫抑制的AA患者晚期克隆并发症的先兆。在AA后的sMDS中检测到的异常DNMT3A (p.E733G)、 SF3B1 (p.L747W)、NPM1 (p.E245Q)突变是否为CH突变,特别是在仅检测到一种突变的情况下,也值得探索。这对于上述研究尤其重要,因为有相当数量的靶基因被检测出来(2020之前n=141;2020之后N=267),以及剖析数据的灵活性(尤其是通过分析变异等位基因频率)。
尽管该研究在一定程度上定义了sMDS和de Novo MDS之间的差异,但对于两组之间移植后生存差异的实际驱动因素,仍存在悬而未决的问题。关键的问题在于临床轨迹中哪些是决定因素或可纵向改变的因素。
可以肯定的是,骨髓衰竭性疾病的复杂性(特别是AA)还远未完全阐明,仍有许多悬而未决的问题。当涉及到统计和匹配评分系统时,患者的基因个体特征往往会丢失。与许多混杂因素的交叉对临床病程评估仍至关重要,这些因素包括疾病表现的遗传特征、造血干细胞的健康度、免疫编辑的强烈参与和治疗计划。
参考文献
1. Li J, et al.Clinical and genetic profiles and outcomes of allogeneic haematopoietic stem cell transplantation in secondary myelodysplastic syndrome following aplastic anaemia.Br J Haematol . 2024 Oct 21. doi: 10.1111/bjh.19855.
2.Gurnari C, Visconte V.Dissecting the genomic traits and clinical course of secondary myelodysplastic syndrome following aplastic anaemia: A milestone. Br J Haematol.2024;00:1–2. https://doi.org/10.1111/bjh.19898