碳酸酐酶2 (Car2 )基因编码负责房水(AH)产生的初级同工酶,并在眼内压(IOP)的调节中发挥重要作用。
2024年4月25日,中山大学张秀兰、李飞及剑桥大学Patrick Yu-Wai-Man共同通讯在Cell Reports Medicine 在线发表题为“CRISPR-Cas9-mediated deletion of carbonic anhydrase 2 in the ciliary body to treat glaucoma”的研究论文,该研究表明CRISPR-Cas9介导的睫状体碳酸酐酶2缺失能够治疗青光眼。
基于ShH10腺病毒相关病毒的CRISPR-Cas9系统可以有效地破坏纤毛体中的Car2基因。通过单次玻璃体内注射,Car2敲除可以通过抑制AH的产生,显著且持续地降低正常小鼠和青光眼模型的IOP。此外,在慢性高眼压模型中,它可以有效延缓甚至停止由长时间高IOP引起的青光眼损害,超过临床可用的碳酸酐酶抑制剂如brinzolamide的疗效。基于CRISPR-Cas9破坏Car2的临床应用是一种有吸引力的治疗策略,可以为青光眼患者带来额外的益处。

青光眼是一种多因素疾病,以视网膜神经节细胞(RGCs)的进行性凋亡变性和相应的视力丧失为特征,是世界范围内不可逆失明的主要原因。眼压升高(IOP)被认为是青光眼唯一可改变的危险因素,而降低IOP是唯一经临床证实的停止或减缓青光眼进展的方法。一般来说,IOP通过房水(AH)的产生和流动、流出阻力和膜外静脉压来维持动态平衡,因此,降低IOP的主要药理学机制包括抑制AH分泌和增加流出设施。
碳酸酐酶抑制剂(CAIs)是最古老的用于青光眼治疗的降眼压药物之一,它通过抑制二氧化碳和碳酸的相互转化来减少睫状体中AH的产生局部CAIs,如dorzolamide和brinzolamide,可以穿透角膜和眼环境,到达睫状体突,发挥降低眼压的作用。先前的研究表明,外用CAIs的降压作用主要是通过抑制碳酸酐酶2、4,其中碳酸酐酶2 (Car2 )是调节AH分泌的主要同工酶。然而,局部治疗可能由于不顺应性、低生物利用度和副作用而存在问题。目前没有迹象表明正在制定解决这些问题的新的CAIs。
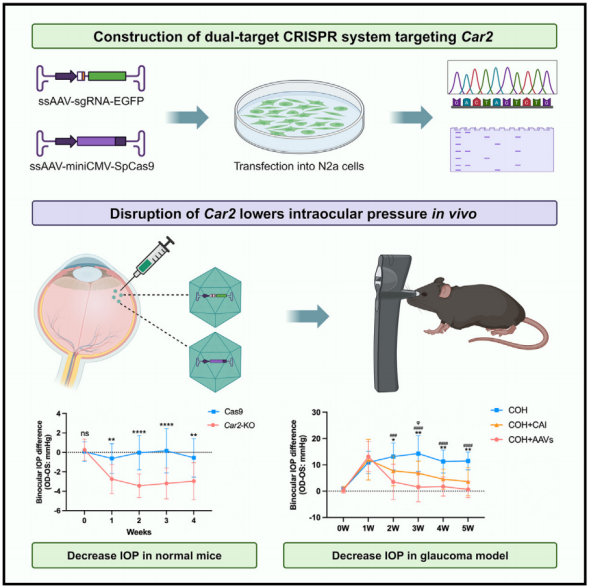
机理模式图(图源自Cell Reports Medicine )
CRISPR-Cas9系统已成为青光眼治疗中一种很有前途的基因组编辑工具,该系统已被用于破坏突变的心肌蛋白基因及其在小梁网细胞中的功能,这可能有助于防止心肌蛋白相关的原发性开角型青光眼的进一步青光眼损害。此外,当与腺病毒相关病毒(AAV)载体ShH10血清型结合时,CRISPR-Cas9可以特异性靶向并编辑睫状体中的水通道蛋白1基因,通过减少AH的产生,在实验性青光眼中显示出降低眼压的作用。迄今为止,尚无研究探索利用CRISPR-Cas9靶向Car2进行青光眼基因治疗的可能性。相反,专利文献方面的主要贡献集中在开发CAIs的药物配方上。
该研究基于ShH10血清型构建了一种靶向睫状体Car2基因的CRISPR-Cas9系统,并在正常小鼠和实验性青光眼模型中研究了其降低眼压的作用。由于靶特异性(脱靶效应)和基因编辑效率仍然是CRISPR-Cas9技术临床应用面临的主要挑战,研究人员在CRISPR-Cas9系统中引入了双单向导RNA (sgRNA)定向基因缺失,这被证明是一种更强大的基因破坏策略。该研究首次提出了一种针对Car2的基因治疗方法来治疗青光眼。CRISPR-Cas9介导的Car2缺失的临床翻译可能被证明是传统使用局部CAIs的重要一步,对各种类型的青光眼患者具有潜在的额外益处。
原文链接:
https://doi.org/10.1016/j.xcrm.2024.101524