靶向治疗在小细胞肺癌(SCLC)患者中一直无效。尽管一些研究报道了SCLC中的EGFR突变,但缺乏对EGFR突变SCLC的临床、免疫组织化学、分子特征和预后的系统研究。本研究中57例SCLC患者接受了二代测序技术(NGS)检测,其中EGFR突变组(A组)11例,无EGFR突变组(B组)46例。检测两组患者的免疫组织化学标志物,分析两组患者的临床特征和一线治疗效果。
A组以不吸烟者(63.6%)、女性(54.5%)和外周型肿瘤(54.5%)为主,B组以重度吸烟者(71.7%)、男性(84.8%)和中央型肿瘤(67.4%)为主。两组免疫组化结果相似,存在RB1和TP53突变。在酪氨酸激酶抑制剂(TKIs)联合化疗治疗中,A组的治疗缓解率较高,总缓解率和疾病控制率分别为80%和100%,而B组分别为57.1%和100%。A组的中位无进展生存期(8.20个月,95%CI 6.91-9.49个月)显著长于B组(2.97个月,95%CI 2.79-3.15个月),差异有统计学意义(P=0.043)。此外,A组中位总生存期(16.70个月,95%CI 1.20-32.21)显著长于B组(7.37个月,95%CI 3.85-10.89)(P=0.016)。EGFR突变的SCLCs在不吸烟的女性中更常见,并且与延长的生存期相关,这意味着积极的预后影响。这些SCLC与传统SCLC具有相似的免疫组织化学特征,且两种类型均存在普遍的RB1和TP53突变。
研究背景
小细胞肺癌(SCLC)是一种致死性神经内分泌恶性肿瘤,约占肺癌的10%-15%。SCLC具有早期易转移、细胞增殖快、预后差的特点。在过去的30年中,SCLC的标准一线治疗方案依托泊苷联合铂类(EP)没有改变。尽管对EP治疗有明显的反应,但SCLC患者在3个月或3个月后复发,并对初始治疗耐药,大多数患者最终因疾病而死亡。近十年来,以表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)为代表的靶向治疗在肺癌治疗中取得了巨大进展。EGFR突变常见于大多数不吸烟的亚洲肺腺癌,并且与EGFR-TKIs的显著疗效密切相关。综合分析报道,EGFR基因突变的非腺癌肺癌在所有肺癌中占比<5%。最近,对98例手术样本进行的基因检测发现了11个EGFR突变,但均出现在复合型小细胞肺癌中。到目前为止,台湾、日本、中国和意大利的很少研究报道了EGFR突变发生率为1.8%-9.1%。
目前SCLC尚无可靶向的癌基因,数十项未根据特定基因变异选择患者的临床试验因对SCLC患者的无进展生存期(PFS)或总生存期(OS)影响微小或无影响而失败或中途放弃。由于EGFR突变的发生率较低,目前SCLC的治疗方案尚未达成共识。此外,目前关于EGFR-TKI治疗EGFR突变型SCLC的有效性的文献数据存在争议。目前尚无研究探讨TKIs联合EP治疗EGFR突变的SCLC患者的疗效。
本研究回顾了57例在该中心接受NGS的SCLC患者。研究者首次系统分析了EGFR突变的SCLC患者的临床、免疫组织化学和分子特征,以及此类患者的预后。研究者还系统评估了TKIs联合EP一线治疗EGFR突变的SCLCs的疗效。
研究结果
患者:
研究者回顾性分析2016年9月至2021年9月在广州医科大学第一附属医院行NGS分子遗传学分析的57例符合条件的初治SCLC患者。所有患者均重新初诊为SCLC,排除组织学转化类型。其中11例SCLC检测到EGFR突变(A组),46例SCLC未检测到EGFR突变(B组)。A组和B组的基线特征相似(表1)。但在性别、吸烟史、疾病分期、肿瘤最大径方面差异有统计学意义。EGFR突变组患者中位年龄为62.0岁(范围:33-77岁),女性6例(54.5%),不吸烟7例(63.6%),广泛期10例(90.9%);对照组患者中位年龄为65.5岁(范围:50-80岁),男性39例(84.8%),吸烟33例(71.7%),局限期24例(52.2%)。此外,EGFR突变组的肿瘤最大径均值大于对照组。A组一线治疗方案为EP 4例,EP联合TKI 5例,EP联合PD-1抑制剂1例,TKI 1例。B组中,一线治疗方案为单纯EP治疗14例,同步放化疗10例,EP+PD-1抑制剂/PD-L1抑制剂15例,未治疗7例。
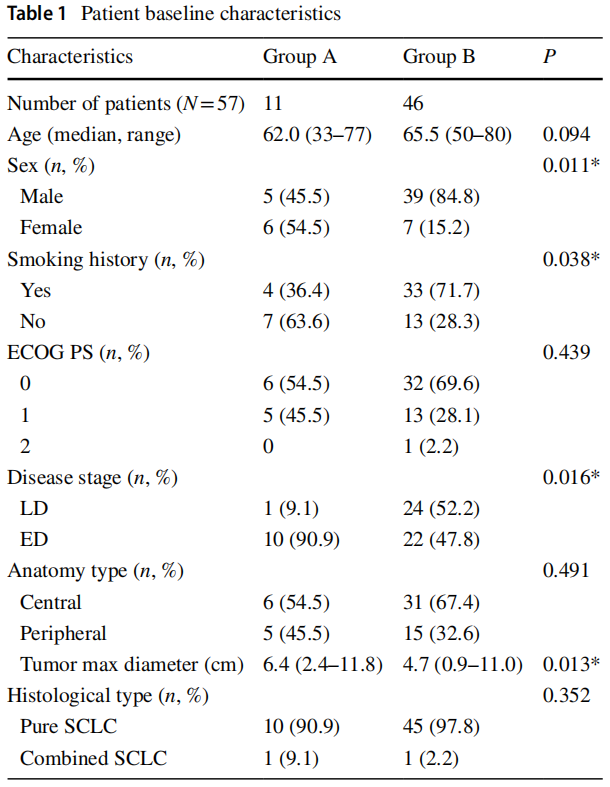
表1
免疫组织化学和分子分析:
SCLCs的异质性很大,它们不仅仅是多种亚型结合或不同突变分子存在的结果。因此,研究者使用IHC检测了EGFR突变的SCLC和传统SCLC之间是否存在明显的组织学倾向。IHC分析结果见表2。总共57份样本进行了CK、CgA、Syn、TTF1、CD56、Ki67免疫组织化学染色,这6种免疫组织化学标志物的代表性图像如图1所示。EGFR突变组CK、CgA、Syn、TTF-1、CD56表达分别为8例(72.7%)、7例(63.6%)、11例(100%)、9例(81.8%)和10例(90.9%)。对照组CK、CgA、Syn、TTF-1、CD56表达分别为43例(95.6%)、38例(84.4%)、42例(93.3%)、40例(88.9%)和44例(97.8%)。野生型SCLC与EGFR突变型SCLC无显著差异,说明EGFR突变型在IHC特征上与传统SCLC一致。
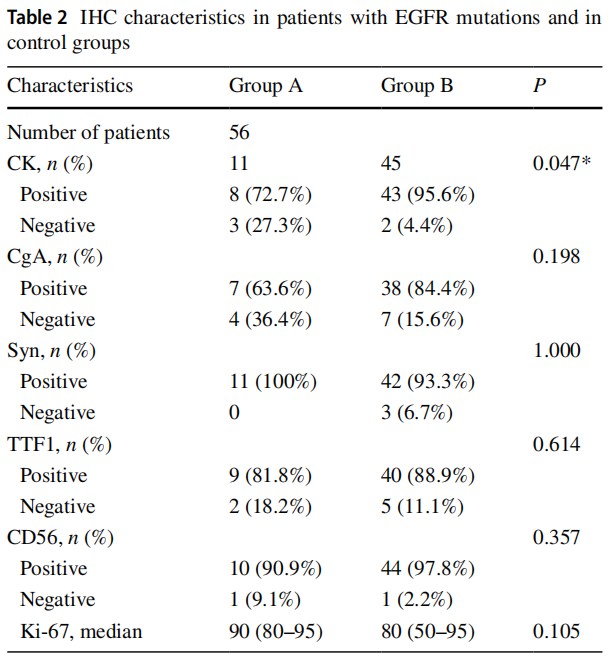
表2
图1
分子分析结果示于图2和3中。RB转录辅抑制因子1(RB1)和肿瘤蛋白P53(TP53)突变在两组中普遍存在,TP53和RB1同时突变的比例分别为73%和72%。LRP1B、FAT1、IL7R、PTEN、SDHA、SPTA1、TERT、NOTCH1、SMAD4、FAT3、RICTOR、KMT2D、PRKDC、EPHA5、FGFR1、KDR、KIT、KMT2C基因突变散在分布于对照组,而ALK、BRCA2、CDKN2A、CREBBP、FAT1、FAT2、JAK2、KDR、KMT2D、LRP1B、MYC、NFKBIA、NKX2-1、NOTCH1、PIK3CA、PTEN、SF3B1基因突变散在分布于A组。

图2
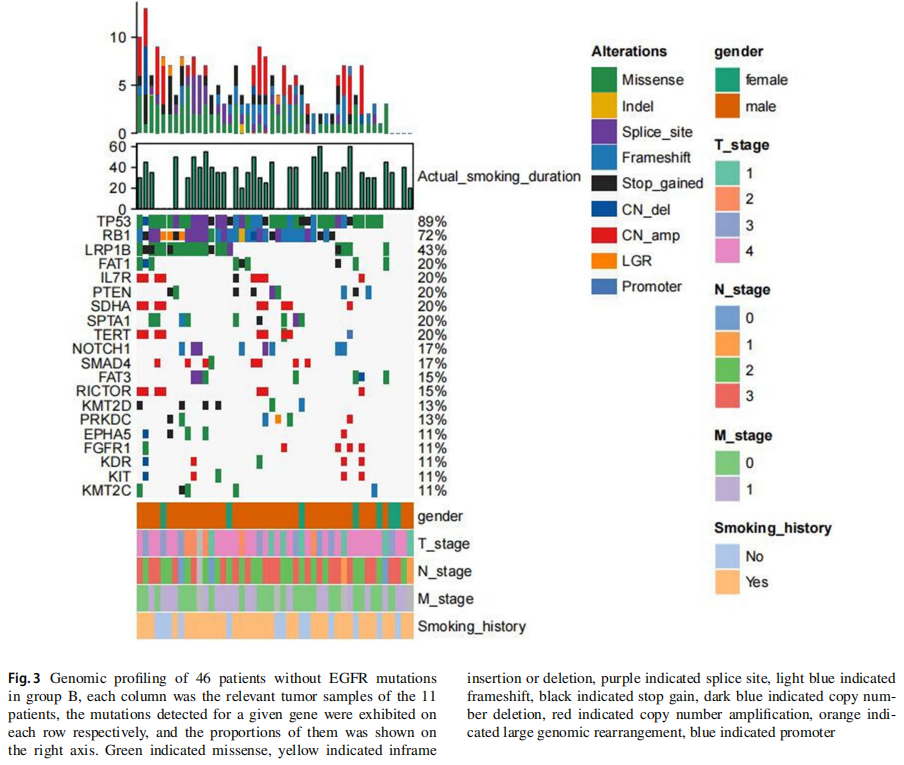
图3
患者一线治疗的疗效:
两组的疾病控制率(DCR)为100%,A组的总缓解率(ORR)为80%(95%CI 0.13,0.99),而B组的ORR为57.1%(95%CI 0.013, 0.987)(图4)。在生存分析时,A组(数据符合5例,只包括广泛期)接受TKIs +化疗一线治疗的中位无进展生存为8.20个月(95%CI 6.91-9.49个月),而B组(数据合格7例,仅包括EP作为一线治疗和广泛期)为2.98个月(95%CI 2.79-3.15),P= 0.043。A组中位总生存期为16.70个月(95%CI 1.19-32.21),B组为7.37个月(95%CI 3.85-10.89),P=0.016,图5、6。
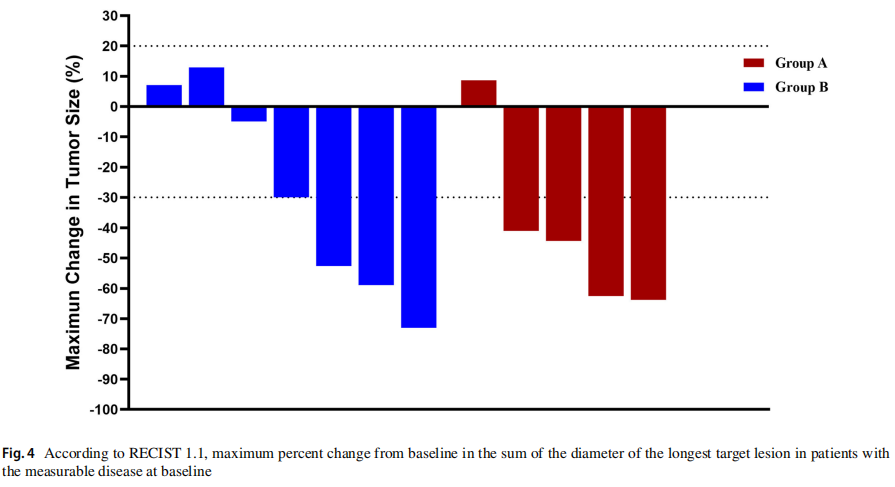
图4
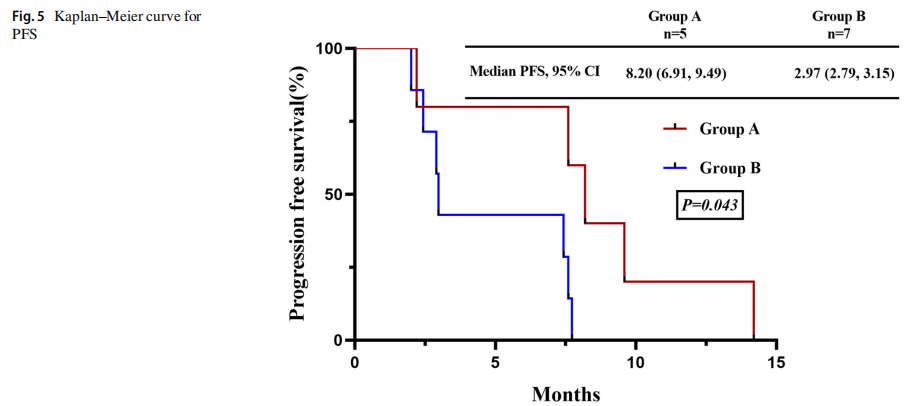
图5
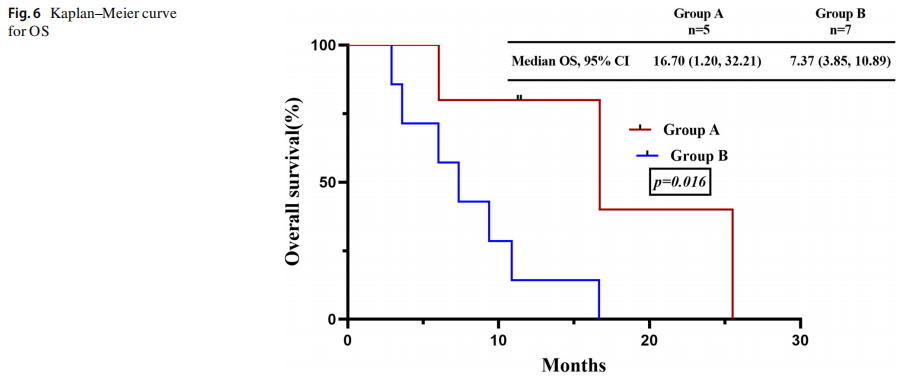
图6
讨 论
目前,关于EGFR突变阳性SCLC的报道仍存在争议,而非小细胞肺癌(NSCLC)向SCLC的组织学转化已被证实是EGFR TKIs耐药的机制之一,发生在3-14%的病例中,并且再次活检样本显示SCLC成分存在原始的EGFR缺失突变。此外,复合型小细胞肺癌,尤其是复合腺癌成分会使此类具有EGFR突变的病例复杂化。虽然受到活检标本数量和质量的限制,但既往研究提示在三个复合型小细胞肺癌中,腺癌和小细胞肺癌成分均检测到EGFR突变。Sutherland等人发现敲除II型肺泡上皮细胞中RB1和TP53基因会导致SCLC,II型肺泡上皮细胞也有向SCLC和肺腺癌转化的潜力。EGFR在高分化的肺泡II型细胞中高表达,这可能是携带EGFR基因突变的腺癌细胞的起源。Tatematsu等人提出,对于EGFR突变型SCLC,腺癌在SCLC发展之前就已经存在。综上所述,EGFR突变型SCLC可能是由EGFR突变的腺癌发展而来,这与提出分化多能肿瘤干细胞是SCLC的推定起源一致。在既往的研究中,EGFR突变的SCLC以复合腺癌成分的复合型小细胞肺癌为主,而本研究中EGFR突变在单纯SCLC中更常见。然而,值得注意的是,活检样本的局限性会导致诊断偏倚。
临床上,性别、吸烟史、疾病分期、肿瘤最大径的分布差异有统计学意义。目前的研究倾向于女性和非吸烟者多见,与以往的研究高度吻合。突变患者的免疫组织化学特征和分子分析显示与未突变患者相似的趋势。在本研究中,SCLC活检样本中EGFR突变的比例高于以往的研究。EGFR突变组中EGFR 21(L858R)突变4例,EGFR 19(del)突变4例,EGFR 18(G719S)突变1例,EGFR 13(E519D)突变1例,EGFR 25(D1009Y)突变1例。其中1例为EGFR双突变,2例同时存在EGFR突变和ALK突变(患者6和11)。6例患者检测了初次活检和血浆样本,1例检测了胸腔积液和血浆样本,2例检测了血浆样本,2例检测了初次活检样本,所有检测的样本均证实存在EGFR突变(表3)。

表3
关于分子分析,RB1和TP53在两组患者中均普遍存在突变,TP53和RB1同时突变的比例分别为73%和72%。LRP1B、FAT1、PTEN、NOTCH1、KMT2D和KDR基因突变在两组中散在分布不同。A组ALK、BRCA2、CDKN2A、CREBBP、FAT2、JAK2、MYC、NFKBIA、NKX2-1、PIK3CA和SF3B1基因突变呈散在分布,B组IL7R、SDHA、SPTA1、TERT、SMAD4、FAT3、RICTOR、PRKDC、EPHA5、FGFR1、KIT和KMT2C基因突变呈散在分布。
目前,EGFR突变型SCLC的治疗尚无统一标准,EGFR-TKIs治疗EGFR突变型SCLC的疗效尚不明确,仅有个别病例报道吉非替尼对此类患者有效。研究者总结了A组中5例一线应用EP联合TKI治疗的病例。因此,在疗效评价中,仅分析A组中一线EP联合TKI的患者, B组中EP作为一线治疗、广泛分期和不放疗的患者。与EGFR野生组相比,EGFR突变组患者的PFS和OS均更好,是否与EGFR突变有关尚不清楚。据研究者所知,这是第一个全面评估EGFR突变型SCLC治疗效果的研究。
在本研究中,EGFR突变型患者即使未接受EGFR-TKIs治疗,也比EGFR野生型患者有更长的OS,提示EGFR突变在SCLC中具有潜在的良好预后作用。难治性SCLC的治疗策略几十年来没有改变。免疫检查点抑制剂作为近年来肿瘤学领域的巨大突破,已成为多种实体肿瘤患者最具潜力的治疗方法之一。基于IMPower133研究,美国食品药品监督管理局(FDA)于2019年3月批准阿替利珠单抗联合标准化疗作为广泛期SCLC的一线治疗方案,免疫治疗在SCLC的预后中显示出良好的前景。此外,患者1、3、6和8接受了免疫检查点抑制剂治疗,无论治疗线数如何,其OS均较好(中位OS为16.77个月),这引发了研究者对探索这类肿瘤样本中的免疫微环境和基因表达的兴趣。然而,在本研究中,由于样本有限,研究者未能从活检样本中提取RNA,无法进行下一步的RNA-seq分析。
综上所述,EGFR突变的SCLC患者多为女性和非吸烟患者,具有与传统SCLC相似的病理和分子特征,具有较长的OS,提示其可能具有积极的预后作用。需要进一步的研究来探索此类SCLC的肿瘤微环境与EGFR突变的潜在关联,并探索合适的治疗策略。
参考文献:
Xie, Xiaohong et al. “Characteristics and prognosis of EGFR mutations in small cell lung cancer patients in the NGS era.” Clinical & translational oncology : official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico vol. 26,2 (2024): 434-445. doi:10.1007/s12094-023-03263-w
