G-CSF对CAR-T的影响
CAR-T细胞疗法是复发/难治性(R/R)B细胞急性淋巴细胞白血病(B-ALL)的有效疗法,但也存在相关毒性,包括细胞因子释放综合征(CRS)、神经毒性事件(NE)和严重血细胞减少,应评估易感风险因素和制定风险降低策略。G-CSF可用于促进中性粒细胞减少症的恢复,降低感染风险。CAR-T细胞治疗后中性粒细胞减少的发生率较高,但G-CSF给药与CAR-T细胞治疗R/R B-ALL的毒性和疗效之间的关系尚不清楚。
因此徐州医科大学附属医院和天津市第一中心医院开展一项回顾性研究中,系统地分析了G-CSF给药与CAR-T细胞治疗R/R B-ALL患者的CRS、神经毒性事件(NE)、感染和疗效之间的关系。研究结果近日发表于《Cancer Immunology Immunotherapy》,共同通讯作者为徐开林教授、赵明峰教授和李振宇教授。

研究结果
该研究回顾性纳入两家中心接受CD19 CAR-T治疗的B-ALL患者。G-CSF治疗指征是根据医生的判断单独确定,根据药物说明书,G-CSF的剂量为1.25-5 μg/kg/d;中性粒细胞计数<1.0× 109/L时开始给药,直至中性粒细胞计数≥1.0× 109/L,持续给药2d。
基线特征
研究共纳入67例患者,41例(61.2%)接受G-CSF治疗(G-CSF组),26例(38.8%)未接受G-CSF治疗(非G-CSF组)。G-CSF组BM原始细胞的中位数百分比显著高于非G-CSF组(25% vs 0.5%,P=0.001),但G-CSF组男性患者比例和D0时中性粒细胞中位数均低于非G-CSF组(P=0.038和P<0.001)(表1)。
G-CSF对中性粒细胞减少症的影响
70.1%(47/67)的患者发生3-4级中性粒细胞减少症,其中非G-CSF组3-4级中性粒细胞减少发生率为23.1%(6/26)。G-CSF组3-4级中性粒细胞减少症的中位发作时间早于非G-CSF组(第0天vs第5天,P=0.014),中位持续时间分别为10.0天和5.0天,无统计学差异;两组中位最小值分别为0.16× 109/L和0.295× 109/L。
G-CSF与重度CRS和NE的关系
G-CSF组和非G-CSF组CRS发生率分别为87.8%(36/41)和65.4%(17/26),其中≥3级发生率分别为19.5%(8/41)和7.7%(2/26)。G-CSF组有17.1%(7/41)的患者发生NE, 9.8%(4/41)的患者为≥3级;非G-CSF组无NE发生。G-CSF组所有级别CRS和NE的发生率高于对照组(P分别为0.028和0.037)(表2);但重度(≥3级上) CRS和NE的发生率没有差异(表2)。

尽管CRP、IL-6和铁蛋白的基线浓度没有差异(P分别为0.186、0.457和0.630),但G-CSF组这三种标志物的峰值浓度更高(P分别为0.007、0.004和0.001)。两组之间BM肿瘤负荷存在差异,它是CRS的独立危险因素(OR=6.765,P=0.023)。进一步根据BM肿瘤负荷将患者分为两组(BM原始细胞百分比中位数,13%为截止值)。分层分析显示,在低BM肿瘤负荷组,使用G-CSF的患者与未使用G-CSF的患者在所有级别和重度CRS的发生率上没有差异;无发生NE。但在BM高肿瘤负荷组,使用G-CSF的患者的CRS发生率显著高于未使用G-CSF的患者( P=0.037),但重度CRS的发生率及所有级别和重度NE的发生率无显著差异(表2)。
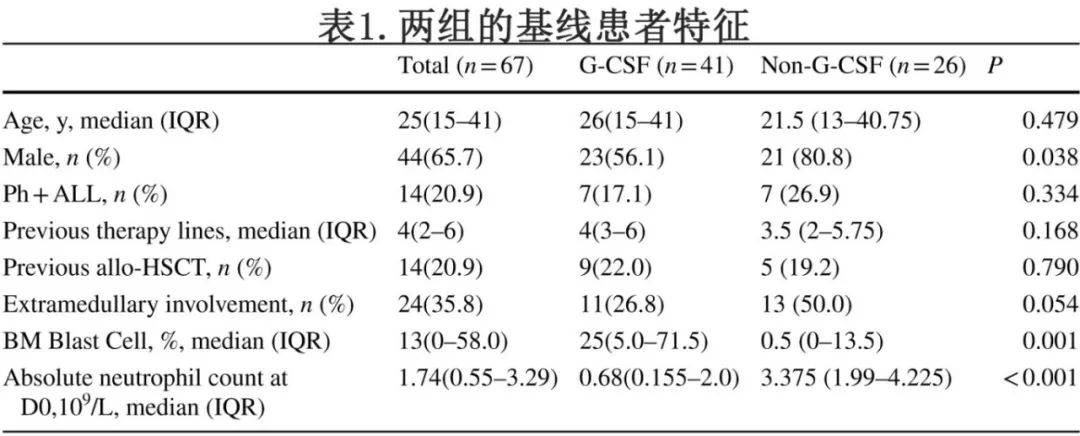
G-CSF与CRS发作与持续时间的关系
G-CSF组和非G-CSF组的中位CRS发作时间分别为CAR-T细胞输注后第2.5天和第3天 (P=0.84),中位病程分别为5.5天和3天 (P=0.001)(图1)。
G-CSF与重度感染的关系
G-CSF组和非G-CSF组分别有25例(61.0%)和7例(26.9%)在CAR-T细胞输注后30天内发生重度感染,其中根据感染部位不同,包括上呼吸道感染14例、肺炎13例、菌血症5例、肠道感染1例、皮肤软组织感染1例。此外,根据感染的病因,包括细菌感染18例、病毒感染11例、真菌感染2例、未知感染4例。G-CSF组重度感染的发生率更高(P=0.007)(表2)。基于BM肿瘤负荷(13%为临界值)的分层分析显示,在低和高BM肿瘤负荷组中,G-CSF组和非G-CSF组的重度感染发生率没有差异(P分别为0.695和0.157)(表2)。研究中没有感染相关死亡。
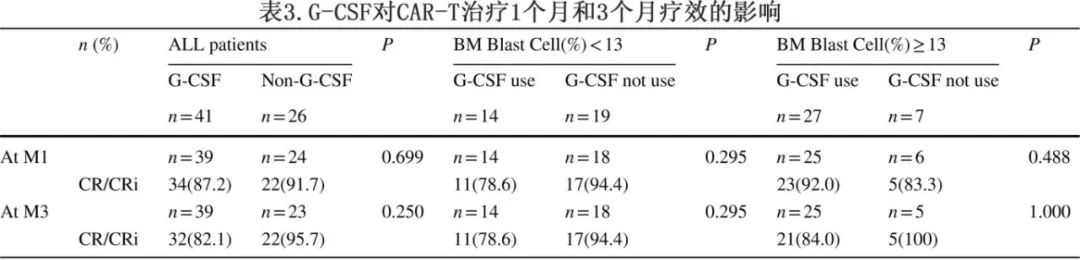
G-CSF与CAR-T疗效的关系
在G-CSF组和非G-CSF组,CAR-T细胞输注后1个月分别有87.2%和91.7%的患者达到CR/CRi,3个月时分别为82.1%和95.7%。在CAR-T细胞治疗后1个月和3个月,两组之间的CR/CRi率无显著差异(表3)。基于BM肿瘤负荷的分层分析(以13%为截断值)中,在低和高BM肿瘤负荷组中,使用G-CSF的患者和未使用G-CSF的患者之间的CR/CRi率无显著差异(表3)。
G-CSF组中位EFS为8.17个月,非G-CSF组中位EFS未达到,差异有统计学意义(P=0.009);但两组之间的OS无差异(11.70个月vs 未达到)。基于BM肿瘤负荷的分层分析(13%为截止值)显示,在低和高BM肿瘤负荷组中,使用G-CSF的患者和未使用G-CSF的患者的OS无差异,此外高BM肿瘤负荷患者的EFS没有显著差异,但低BM肿瘤负荷组未接受G-CSF治疗的患者的EFS较高(P=0.041)。
为校正潜在混杂因素,构建多因素Cox模型来检验低BM肿瘤负荷患者的比例风险假设以及与协变量的相互作用项。多因素分析表明,BM原始细胞≥0.17%(低BM肿瘤负荷患者中原始细胞百分比中位数)是低BM肿瘤负荷患者发生EFS的独立负面预后因素(P=0.04)。
总结
作者回顾性分析了67例接受抗CD19 CAR-T细胞治疗的R/R B-ALL患者,其中41例(61.2%)患者接受了G-CSF (G-CSF组),26例(38.8%)患者未接受G-CSF(非G-CSF组)。两组患者3-4级中性粒细胞减少症的持续时间相似。G-CSF组CRS和NE发生率较高,但重度CRS和NE发生率无差异。进一步的分层分析显示,低BM肿瘤负荷患者中所有级别和重度CRS的发生率与G-CSF给药无关;低BM肿瘤负荷患者均未发生NE。但在高BM肿瘤负荷患者中,G-CSF给药后CRS的发生率显著增加。此外使用G-CSF的患者CRS持续时间更长。两组在CAR-T细胞输注后1个月和3个月的缓解率及OS没有显著差异,G-CSF不影响CAR-T的疗效。
参考文献
Ma, S., Wang, Y., Qi, K. et al. Associations of granulocyte colony-stimulating factor with toxicities and efficacy of chimeric antigen receptor T-cell therapy in relapsed or refractory B-cell acute lymphoblastic leukemia. Cancer Immunol Immunother 73, 104 (2024). https://doi.org/10.1007/s00262-024-03661-1