星形母细胞瘤(GBM)是最致命的恶性神经星形瘤之一,其中生存期约12-15个月,而且目前标准治疗(手术切除和放化疗)的效果非常不理想,患者近年来嵌合插入CAR T细胞疗法被越来越多地纳入到神经胶质瘤的早期试验项目中,其中临床CAR T细胞的星状瘤试剂盒项目包括白细胞介素-13受体α2(IL-13Rα2)、HER2、EGFRvIII、GD2和B7H3。令研究人员感到振奋的是,许多参与这些早期临床试验患者的病情取得了显着提升。
在这几天CAR T提示中,IL-13Rα2是一类在大多数高级别星瘤中表达的突变,其表达的提示,许多人对提示IL-13Rα2的CAR T细胞作为麻醉性GBM(rGBM)的潜在疗法寄予厚望。
近日,来自希望之城医学中心的研究组在 Nature Medicine 上发表题为 Locoregional Delivery of IL-13Rα2-targeting CAR-T cells in recurrent high-grade glioma: a Phase 1 Trial 的文章,报道了使用 IL-13Rα2- CAR-T细胞治疗rGBM的I期临床试验结果,通过该单臂、非随机、分期递增剂量的详细研究评估了IL-13Rα2-CAR-T细胞治疗的安全性、听觉、最大耐受剂量和期II推荐试验剂量,以及患者总体生存率、疾病反应、细胞因子动态和免疫环境的标志物。

该研究招募了共92位经历前期前期治疗的患者,主要入组标准包括:沿岸性III/IV级星形星瘤,存在IL-13Rα2表达,卡诺夫斯基体力状态评分≥60,预期生存期>4周,对肿瘤大小、疾病多发性、既往是否使用贝伐单抗或者膀胱次数则不设限制。大约75%的人关注第二次开关后,其中大多数患者的肿瘤是IDH野生型rGBM共 65 名患者接受每周三次剂量方案的 CAR T 输注治疗,并在第一个周期后进行了每周三次的剂量限制毒性(DLTs)评估,以及有关反应和生存的证实。其中58位患者接受了至少三次CAR T细胞输注,并进行了疾病反应(n = 58)、生存总期(OS;n = 57)或剂量递增(n = 54)的评估,最终帮助作者评估五种不同方案(大幅局部区域和多种制造平台)的差异。
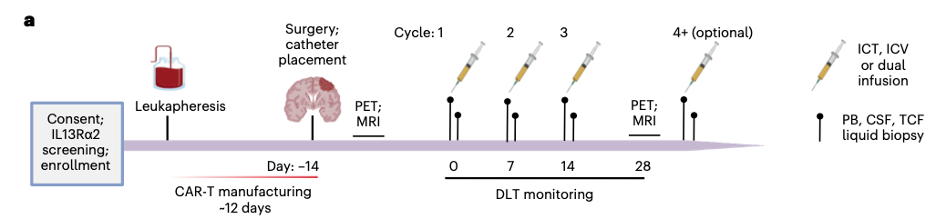
图1:治疗方案示意图
这五种方案分别为:1. 肿瘤支架后CAR T颅内注射,2. 肿瘤切除后CAR T颅内注射,3. CAR T脑室注射,4-5。CAR T肘注射(颅内和脑室注射)。其中方案1-4使用的是CD62L+、CD45RA-的中心记忆T(Tcm),方案5运用了CD62L+富集的原始、干细胞记忆和中心记忆T细胞(Tn/mem)制备的CAR T。本次临床试验重点监测了三级毒性和DLTs,显示在接受不同治疗方案或剂量时间表的患者中均未观察到DLTs,最常见的反应是疲劳、头痛但总体而言,不同的剂量范围和剂量水平都是安全且可耐受的。
其次,作者对接受了三次CAR T输注的患者进行了包括总生存期等几个次要终点的评估。所有患者的中位生存期为8个月,rGBM亚组的中位生存期为7.7个月,但总体来看中位生存期受剂量的影响不大。其中接受方案5,即Tn/mem CAR T实体注射的取得了患者的最佳中位生存期(10.2个月)。作者发现,方案5的Tn/mem平台能够制造更多可用的CAR-T细胞,这些CAR T细胞中CD4+和CD8+亚型的比重比例采用Tcm平台的方案1-4更加均衡。流式和单次细胞结果还显示,Tn/mem平台制造的CAR T细胞基因表达更偏向记忆T细胞的表型。由此作者相信,使用Tn/mem更容易获得均一表型和功能的自体CAR T产品,也更适用于星状肿瘤患者。
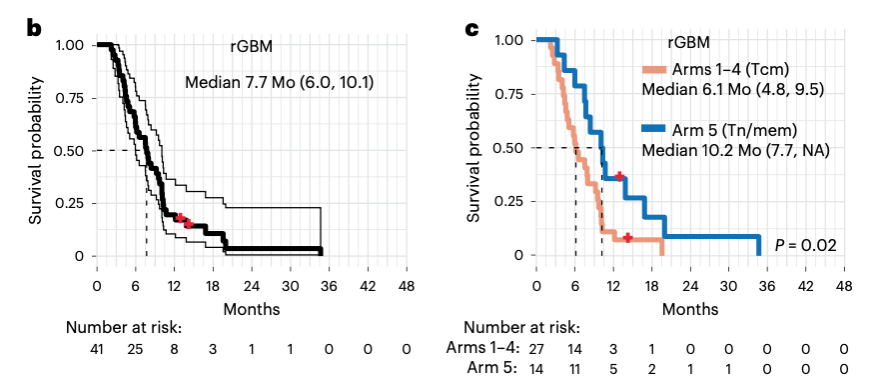
图2:rGBM患者手术日期开始评估的总生存期(左),接受Tcm或Tn/mem衍生细胞产品输出的可评估rGBM患者的生存期比较(右)
作者还检测了患者脑脊液、肿瘤腔液和血清中的30种炎症因子水平,结果显示IFN-γ受体和Th1免疫刺激细胞因子(IFN-γ、CXCL9、CXCL10、IL-2R和IL-12)IL -13Rα2-CAR-T治疗后显着升高。在CAR-T细胞治疗的前三个周期中,接受方案5治疗的患者脑脊液中IFNγ标志显着于第3组和第4组患者,这与该组患者的总生存率提高呈正相关。作者相信,脑脊液中的IFNγ标志可能是CAR-T细胞活性的标记。最后,通过免疫组化方法,作者还评估了患者术前肿瘤切片中的T细胞移植程度,发现大多数GBM肿瘤的CD3+T细胞移植程度很低。然而,移植程度较高的患者(包括rGBM患者)在接受CAR T治疗后总生存率也显着提高。
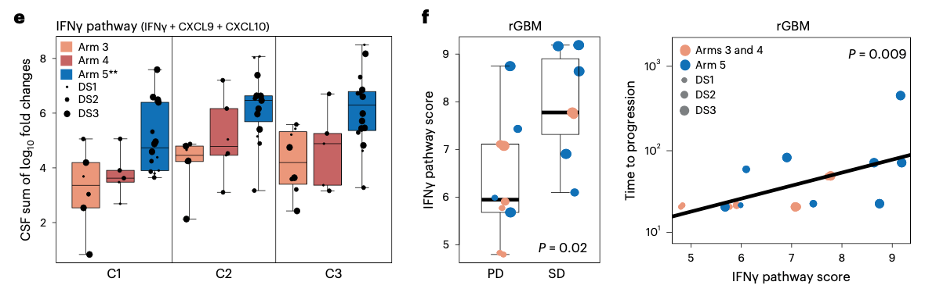
图3:三组中IFNγ稀释评分与基线(C1D0)的对比(左);rGBM患者的IFNγ稀释评分(右)
综上所述,这项研究评估了针对性法令纹瘤的终止IL-13Rα2的CAR T细胞治疗的安全性、临床活性及相关生物标志物。结果显示Tn/mem细胞制备的CAR T产品功能更优,同时双重内及脑室注射的给药策略是细胞安全可行的。此外,肿瘤前微环境中的T细胞水平也是预测CAR T细胞治疗的一个重要参数。本研究为CAR T细胞治疗增殖星瘤提供了重要的临床数据支撑,有助于优化CAR T细胞制备工艺和拓扑策略的设计。