恶性胸腔积液(MPE)是肺癌常见的并发症之一。MPE患者的生活质量和预后受到严重影响。控制MPE的产生可以缓解患者的症状,提高患者的生活质量,延长患者的生存期。本文介绍了一例伴有MPE、驱动基因阴性的晚期非小细胞肺癌(NSCLC)病例。该患者接受了恩沃利单抗联合恩度治疗,MPE完全减少并取得了持久的临床获益。探索性使用这种治疗方法改善了该患者的生活质量,并有可能延长该患者的生存期。
背 景
肺癌是全球第二常见的癌症,也是癌症死亡的主要原因。在所有恶性肿瘤中,恶性胸腔积液(MPE)是一种常见的并发症,其中以肺癌患者的发病率最高。MPE患者的生活质量和预后显著降低。控制MPE的产生可以缓解患者的症状,提高患者的生活质量,并延长生存期。然而,对于伴有MPE的肺癌患者,目前尚无推荐的治疗策略,迫切需要一种高效、标准化的治疗策略。
MPE富含细胞因子和趋化因子,如白细胞介素、转化生长因子和血管内皮生长因子(VEGF)。MPE的多种治疗策略都侧重于靶向VEGF。此外,MPE所处的胸膜腔被认为是一个肿瘤耐受环境。但免疫疗法可能会刺激胸膜腔中的肿瘤特异性免疫反应,进而逆转肿瘤耐受环境。因此,免疫疗法一直是MPE治疗中受到关注的领域。
近年来,免疫检查点抑制剂(ICIs)主要针对程序性死亡1(PD-1)和程序性死亡配体1(PD-L1),改变了晚期非小细胞肺癌(NSCLC)和其它肿瘤的治疗,现已成为NSCLC治疗的重要组成部分。由于抗血管生成治疗与ICIs联合治疗可提高疗效并减少不良反应,这种联合治疗方法也已成为主要研究方向之一。然而,关于ICI联合抗血管生成治疗对合并MPE的NSCLC的影响,III期试验数据很少。
恩度是中国开发的一种抗血管生成药物,已被推荐作为非小细胞肺癌的一线治疗选择。对于伴有MPE的NSCLC患者,恩度可显著提高MPE的控制率并降低其复发率。恩沃利单抗是一种新型抗PD-L1抗体,已在中国获批用于治疗高度微卫星不稳定(MSI-H)或DNA错配修复缺陷(dMMR)实体瘤。研究人员发现有关恩度和恩沃利单抗治疗伴有MPE的NSCLC的研究很少。本文介绍一例晚期肺腺癌伴MPE的患者,接受恩沃利单抗联合恩度一线治疗后疗效优异。
病 例
患者女,72 岁,因胸部和背部疼痛就诊于连云港市第一人民医院。入院前,患者生命体征稳定,东部肿瘤合作组(ECOG)体力状态(PS)评分为 1。CT显示右肺肿块侵犯邻近胸膜,右肺门淋巴结肿大,右侧胸腔有少量积液,颅部未见异常(图1A-C)。肿瘤标志物检测结果显示,细胞角蛋白19片段(CYFRA21-1)水平为 11.061 ng/mL,癌胚抗原(CEA)水平为 35.08 ng/mL,肿瘤标志物呈上升趋势。肺部活检结果显示为腺癌。最终诊断为右肺腺癌IV期(T2N1M1)。对组织样本进行驱动基因和PD-L1检测,结果显示表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)或C-ROS癌基因1(ROS1)没有突变,PD-L1肿瘤细胞阳性评分(TPS)为 70% 。
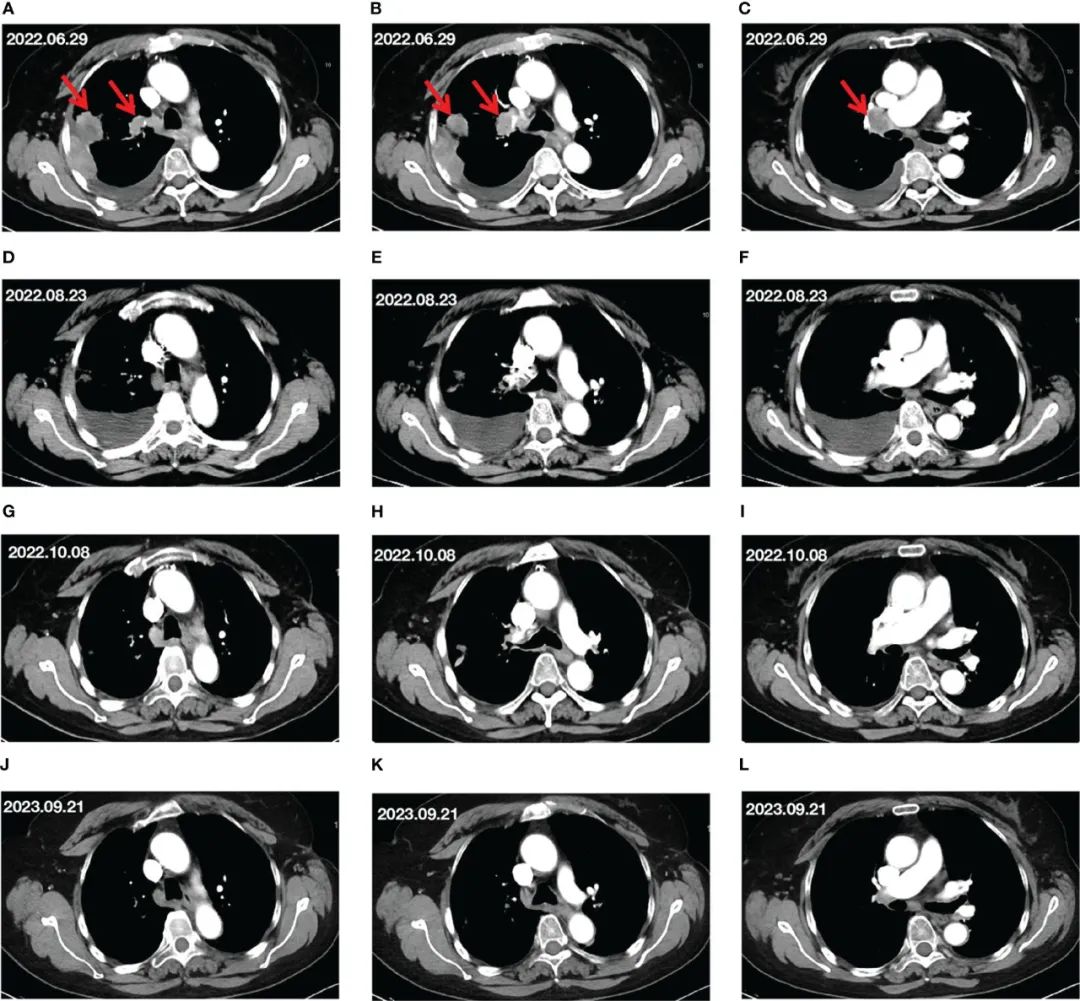
▲图1 治疗过程中病灶变化
患者拒绝化疗,最终接受了免疫联合抗血管生成治疗。2022 年 7 月 11 日和 8 月 1 日,患者每 3 周接受恩沃利单抗(300 mg,d1)联合恩度(210 mg,d1-3)治疗,共两个周期。经过两个周期的治疗,患者的胸背疼痛有所减轻。2022 年 8 月 23 日的CT检查显示,与治疗前的CT结果相比,右肺病灶缩小,但右侧胸腔积液增多(图1D-F)。此外,肿瘤标志物包括以下结果:CEA为 10.88 ng/mL,CA-199为 94.32 U/mL,CYFRA21-1为 3.62 ng/mL。虽然肺部病灶和肿瘤标志物水平有所下降,但患者右侧胸腔积液增多,并出现胸闷症状。因此,按照预定计划,进行胸腔穿刺和胸腔积液引流。患者于 2022 年 8 月 23 日至 9 月 14 日接受了第三和第四个周期的恩沃利单抗联合恩度治疗。
治疗三个周期后,患者胸闷、胸背疼痛缓解。完成四个周期治疗后,10 月 8 日的CT扫描显示,与 2022 年 8 月 23 日相比,右肺病灶和右肺门淋巴结略有缩小,胸腔积液也有所减少(图1G-I)。此时的肿瘤标志物结果如下:CEA 2.11 ng/mL,CYFRA21-1 3.77 ng/mL。根据RECIST标准,影像学疗效评估为部分缓解(PR),ECOG体力状态评分为 0。
2022 年 10 月 8 日至 2023 年 11 月 11 日,患者接受了第 5 个至第 22 个周期的恩沃利单抗联合恩度治疗。2023 年 9 月 23 日CT评估显示肺部病灶稳定,MPE消失(图1J-L)。疗效评估为PR,肿瘤标志物基本在正常范围(CEA,1.75 ng/mL;CYFRA21-1,2.13 ng/mL)。患者的ECOG体力评分为 0。
值得注意的是,治疗期间的主要不良事件是甲状腺功能减退。根据美国国家癌症研究所通用毒性标准(NCI-CTC AE,v5.0),该不良事件评定为 2 级。口服左旋甲状腺素片后,患者甲状腺功能恢复至正常范围(TSH,2.95 mIU/ L;FT3,5.26 pmol/L;FT4,10.01 pmol/L;T3,2.07nmol/L;T4,122.33 nmol/L)。该患者接受了恩沃利单抗联合恩度的一线治疗,尚未出现疾病进展。截止成文时,该患者的无进展生存期(PFS)已达到 15.9 个月。
讨 论
在本文案例中,患者被诊断为晚期肺腺癌并伴有MPE。值得注意的是,驱动基因检测结果为阴性,且PD-L1表达量较高(TPS=70%)。经过 22 个周期的恩沃利单抗联合恩度治疗后,患者的右肺病灶和肺门淋巴结明显缩小,MPE完全消失,且没有复发。总体而言,患者取得了持久的临床获益。治疗过程中的主要不良事件为甲状腺功能减退,评价为 2 级,表明该方案安全性良好。
目前,对伴有MPE的NSCLC患者尚无推荐的标准治疗。考虑到患者的年龄且拒绝化疗,最终决定应用免疫治疗联合抗血管生成治疗,即恩沃利单抗联合恩度。两个周期治疗后出现的MPE增加可能是由多种因素造成的。首先,接受抗肿瘤治疗后,胸膜病变明显缩小,可能导致肿瘤血管内液体渗漏,使得MPE产生增加。其次,免疫细胞在清除肿瘤细胞的过程中可能会加剧淋巴阻塞,导致淋巴回流受阻。最后,免疫细胞在杀伤肿瘤细胞的过程中可能引发局部炎症反应并增强毛细血管通透性,这些都可能促进MPE的增加。
抗血管生成治疗与ICIs的联合应用存在理论基础。VEGF是肿瘤血管生成的重要诱导因子,可调节免疫反应。它通过下调黏附分子并增强PD-1表达从而减少T细胞浸润和活性。VEGF还会抑制树突状细胞的成熟和激活,限制抗原呈递。VEGF促进前列腺素E2的分泌,促进抑制细胞浸润和调节性T细胞分化。VEGF还会诱导肿瘤内皮细胞上的Fas配体表达,介导效应T细胞凋亡。因此,抗血管生成可以改善肿瘤的免疫抑制微环境。
目前,许多临床试验已经研究了抗血管生成和ICIs联合治疗NSCLC的疗效。Seto等人评估了贝伐珠单抗联合阿替利珠单抗一线治疗驱动基因阴性且PD-L1高表达的晚期非鳞状NSCLC的疗效。客观缓解率(ORR)达 42.9%,中位PFS为 15.9 个月,且未发生 4 级或 5 级治疗相关不良反应。之前的Impower-110研究评估了阿替利珠单抗单药一线治疗驱动基因阴性且PD-L1高表达的晚期NSCLC的疗效。结果显示,接受阿替利珠单抗单药治疗的晚期NSCLC患者的ORR和中位PFS分别为 38.3% 和 8.1 个月。这两项研究的受试群体相似,均由既往未经治疗的晚期NSCLC患者组成,他们的驱动基因呈阴性,且PD-L1表达较高。Seto等人的研究提示贝伐珠单抗联合阿替利珠单抗具有令人满意的疗效。然而,还需要进一步的大型随机对照研究来验证该组合的有效性和安全性。
MPE被认为是恶性胸膜转移的免疫学和血管相关表现。阻断VEGF活性的抑制剂被认为可以有效控制MPE。随着ICI在肺癌和其它恶性肿瘤中的应用,人们重新对ICI在MPE患者中的疗效产生了兴趣。但目前不推荐使用ICI单药疗法用于MPE的治疗,可能会导致MPE相关死亡率增加。2019 年,一项回顾性研究评估了接受ICI治疗的晚期NSCLC患者的疗效,以验证ICI单药治疗是否存在适合MPE的情况,发现ICI单药治疗并不能改善MPE患者的生存结局。2022 年,一项多中心回顾性研究评估了患有MPE的NSCLC患者接受帕博利珠单抗单药治疗或ICI联合化疗的疗效。与ICI单药治疗相比,ICI联合化疗的PFS显著增加(11.1 vs. 3.9 个月,p=0.04)。因此,ICI单药疗法可能不适合伴有MPE的NSCLC患者。
然而,目前缺少有关伴有MPE的NSCLC患者对ICI联合抗血管生成治疗反应的数据。
本文病例的成功治疗为恩沃利单抗联合恩度在晚期肺腺癌合并MPE患者中的应用提供了有力的证据支持。期待未来通过更多的临床研究进一步验证该治疗方案对晚期NSCLC的有效性和安全性。
参考文献:
Dong C, Hu C, Jiang Y, Hui K and Jiang X (2024) Case report: Envafolimab combined with Endostar in the treatment of advanced non-small cell lung cancer with malignant pleural effusion. Front. Oncol. 14:1368059. doi: 10.3389/fonc.2024.1368059
