线粒体功能障碍是人类和啮齿类动物肥胖、胰岛素抵抗和脂肪肝疾病的特征。
2024年1月29日,加州大学圣地亚哥分校Alan R. Saltiel 团队在Nature Metabolism 在线发表题为“Obesity causes mitochondrial fragmentation and dysfunction in white adipocytes due to RalA activation”的研究论文,该研究证明,高脂肪饮食(HFD)喂养导致雄性小鼠腹股沟白色脂肪细胞线粒体断裂,导致氧化能力降低,这一过程依赖于小GTPase RalA。白色脂肪细胞中RalA的表达和活性增加。靶向删除白色脂肪细胞中的RalA可防止线粒体断裂,并通过增加脂肪酸氧化来减少HFD诱导的体重增加。
机制上,RalA通过逆转裂变蛋白Drp1的抑制性Ser637磷酸化,从而增加脂肪细胞的裂变,导致更多的线粒体断裂。Drp1的人类同源基因DNM1L在脂肪组织中的表达与肥胖和胰岛素抵抗呈正相关。因此,RalA的慢性激活在抑制肥胖脂肪组织的能量消耗中起着关键作用,通过将线粒体动力学平衡转向过度裂变,导致体重增加和代谢功能障碍。

肥胖已成为一种世界性的流行病,它极大地增加了2型糖尿病、非酒精性脂肪性肝炎和其他心脏代谢异常的发病率。在肥胖的发展过程中,白色脂肪组织(WAT)长期扩张并经历以激素不敏感、炎症、纤维化和细胞凋亡为特征的代谢变化。虽然线粒体在健康脂肪细胞中发挥着重要的代谢作用,在产热过程中氧化燃料产生ATP并产生热量,但肥胖个体的线粒体功能受损;然而,是什么导致了线粒体损伤,以及它是如何导致肥胖及其许多并发症的,仍然不得而知。
肥胖与高胰岛素血症和糖尿病有关,研究表明线粒体功能障碍、能量消耗减少和胰岛素抵抗之间存在联系。与健康体重的人相比,肥胖的人的肌肉和脂肪组织中线粒体氧化功能发生了改变,肥胖的人的脂肪细胞中线粒体的含量也比苗条的人少。此外,肥胖个体肌肉中的线粒体是断裂的。线粒体大小和数量的变化受融合和分裂的动态平衡控制。融合对于线粒体数量和完整性的最佳控制至关重要,特别是在应对能量需求的变化时。由动力蛋白相关蛋白Drp1催化的裂变在细胞分裂过程中介导线粒体分裂和质量控制;然而,在许多非分裂细胞中观察到线粒体融合和裂变,这表明这些过程的正确平衡对于适应能量需求和确保体内平衡至关重要。
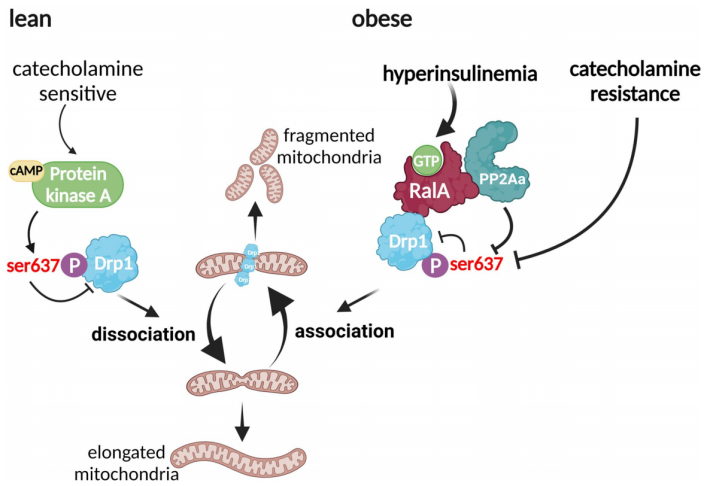
RalA调节肥胖脂肪细胞线粒体功能的机制模型(图源自Nature Metabolism )
Ral GTPase是Ras超家族的成员,参与多种细胞过程。之前证明,脂肪细胞中的RalA被胰岛素激活,并反过来与外囊复合体的成员相互作用,将GLUT4囊泡靶向质膜,进行对接和随后的融合,导致葡萄糖摄取增加。胰岛素通过抑制Ral GAP复合物的磷酸化以及RGL2的定位激活RalA,RGL2是RalA的鸟嘌呤核苷酸交换因子(GEF)。在体内通过靶向删除RalGAP蛋白激活RalA, Ralgapb促进葡萄糖摄取到棕色脂肪组织(BAT),并显著改善HFD小鼠的葡萄糖稳态。同样,在小鼠中靶向删除Ralgapa1可以改善餐后葡萄糖和脂质进入肌肉的处理。
该研究表明肥胖小鼠的脂肪细胞中RalA基因和蛋白的表达和活性增加,并且在白色脂肪细胞中靶向删除Rala,而不是棕色脂肪细胞,由于能量消耗和线粒体氧化磷酸化显著增加,特别是在腹股沟WAT (iWAT)中,减轻了HFD诱导的肥胖。RalA缺失的这些有益作用是由喂食小鼠HFD诱导的白色脂肪细胞线粒体裂变增加的逆转所驱动的。体外研究表明,RalA与蛋白磷酸酶PP2Aa相互作用,促进Drp1上抑制丝氨酸637的去磷酸化,使Drp1具有活性,导致过度裂变和线粒体断裂。综上所述,这些数据表明,肥胖患者RalA持续升高会导致白色脂肪细胞线粒体功能障碍,对全身代谢产生深远影响。
原文链接:
https://www.nature.com/articles/s42255-024-00978-0