摘要:识别脑小血管病早期病变并进行动态量化评估对于脑小血管病的防治具有重要意义。视网膜微血管与脑小血管具有相似的胚胎学、解剖学和生理学特征,可作为脑小血管病的观察窗口。光学相干断层扫描血管成像技术是一种新型的视网膜血管成像技术,可观察和定量分析视网膜微血管结构及其血流灌注变化。作者就该技术在脑小血管病中的应用研究进行综述,以期为脑小血管病的早期识别和动态评估提供依据。
脑小血管病(cerebral small vessel disease, CSVD)是指由于各种病因影响脑内小动脉、微动脉、毛细血管、微静脉和小静脉所导致的一系列临床、影像、病理综合征。CSVD 常隐匿起病,可导致约25%的卒中和约45%的痴呆,严重影响患者的健康和生活质量,因此,早期识别和动态监测对CSVD的防治具有重要意义。然而,由于脑小血管直径较小,无法直接进行观察,而神经影像学作为CSVD的主要诊断依据,无法反映脑小血管的早期病变,因此寻找可替代的CSVD临床影像标志物至关重要。视网膜微血管和脑小血管有着相似的胚胎学、解剖学和生理学特征,可作为CSVD较理想的观察窗口。光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA)是一种新型的视网膜血管成像技术,可观察和定量分析视网膜微血管结构和血流灌注变化,具有非侵入性、分辨率高、成像速度快等优点,近年来在CSVD研究领域得到广泛关注。本文就OCTA在CSVD中的应用进行综述,以期为CSVD的早期识别和动态评估提供帮助。
1 视网膜微血管与CSVD的关系
在胚胎起源上,视网膜为间脑的延伸,同大脑具有相似的血管发育模式;在解剖上,视网膜微血管为起源于颈内动脉的眼动脉分支的终末血管,脑小血管为颅内大血管的终末血管,两者均为相对低流量和高耗氧系统;在组织学上,视网膜微血管与脑小血管均为连续型毛细血管,分别参与了血-视网膜屏障和血-脑屏障的构成;在生理学上,与脑小血管类似,筛板后的视网膜微血管无自主神经支配,通过肌源性和代谢性机制实现血流的自我调节。此外,视网膜微血管改变如视网膜动静脉比值下降、视网膜血管弯曲度降低等与CSVD具有相同的危险因素,包括高龄、高血压病、糖尿病等,而与CSVD相关的发病机制,如屏障功能破坏、内皮细胞功能障碍、炎性反应等,也可能参与了包括糖尿病视网膜病变、视网膜缺血再灌注损伤等所致的视网膜微血管病变的发生。因此,视网膜微血管的病变可以反映CSVD的早期病变,视网膜微血管成像技术可作为CSVD早期识别和动态评估的重要方法。
2 OCTA的成像特点
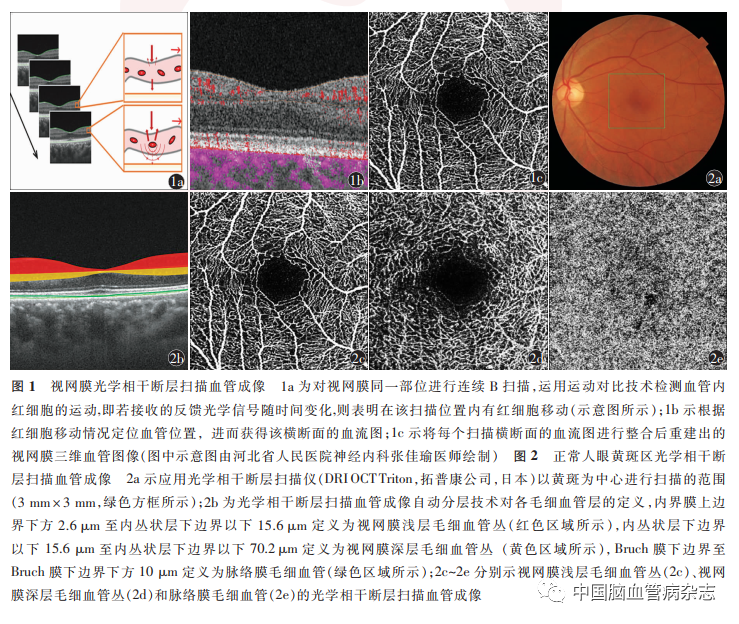
OCTA通过在视网膜同一位置重复快速扫描,运用运动对比技术检测血管内红细胞的运动,进而获取视网膜血管图像,之后在此基础上进行血管结构的三维重建,从而实现黄斑区及视盘周围血管的可视化。视网膜OCTA 见图1。OCTA 对视网膜微血管的血流分析主要集中在黄斑区和视盘周围区。黄斑区扫描范围一般为3 mm × 3 mm或6 mm ×6 mm,黄斑区可进一步划分为中心凹区、中心凹旁区、中心凹周围区;应用自动分层技术,OCTA 可将视网膜微血管自动划分为视网膜浅层毛细血管丛(superficial retinal capillary plexus,SRCP)、视网膜深层毛细血管丛(deep retinal capillary plexus,DRCP)和脉络膜毛细血管(choriocapillaries,CC),其中SRCP和DRCP共同组成了视网膜内层毛细血管。正常人眼黄斑区OCTA见图2。视盘周围区扫描范围一般为4.5 mm × 4. 5 mm,目前研究者多关注放射状盘周毛细血管(radial peripapillary capillaries,RPC)。RPC为毛细血管网最浅表的一层,多定义为内界膜上界至神经纤维层下界。正常人眼视盘周围区OCTA见图3。

通过内置软件,OCTA 可实现对视网膜微血管血流灌注的定量分析。测量指标主要包括血管密度和黄斑中心凹无血管区(foveal avascular zone,FAZ)面积。血管密度是指灌注总面积占观测区域面积的百分比或单位面积内微血管灌注的总长度。FAZ为黄斑中央区一圆形、无毛细血管的区域,FAZ的扩大是视网膜缺血的重要表现。
将OCTA与深度学习算法结合,可对视网膜微血管形态改变进行进一步分析,相关参数包括:血管定向分布、血管分形维数和微血管弯曲度。血管定向分布通过计算每个血管像素的方向来反映血液流动的趋势,血管定向分布越大,血流方向越趋于一致;血管分形维数用于描述血管分支形态的复杂程度或血管密度,血管分形维数降低,表示视网膜微血管稀薄或缺失;微血管弯曲度则用于衡量血管的弯曲程度,弯曲度增加可反映微血管壁功能障碍、血流紊乱、组织缺氧等。
3 OCTA与CSVD危险因素
目前,OCTA参数与CSVD危险因素关系的研究主要集中在视网膜微血管密度,少数研究对黄斑FAZ面积与CSVD危险因素的关系进行了评估,其中年龄、高血压病、糖尿病及吸烟与OCTA参数的关系较为明确。Munsell等对375 名(482 只眼)健康成人[中位年龄:55(38,63)岁]OCTA图像进行分析,结果显示,在校正种族、性别后,SRCP 和DRCP的血管密度随着年龄的增加而降低(SRCP:β =-0. 00,P <0. 01;DRCP:β = -0. 00,P < 0. 01);一项Meta分析纳入了9项在高血压病患者中应用OCTA的研究,结果显示,高血压病患者(543例)与健康人群(427例)的中心凹区SRCP的血管密度平均数的比值为0.93(95% CI:0. 87 ~ 0. 99,P = 0. 023),二者比值< 1,提示高血压病患者较健康人群SRCP的血管密度降低;另一项Meta分析共纳入44 项在糖尿病患者中应用OCTA的研究,结果表明,与无糖尿病者(1 861 例)相比,糖尿病患者(2 241 例)的SRCP和DRCP的血管密度均显著降低(SRCP:加权均数差为- 1. 99%,95% CI:- 2. 76% ~ -1.22%,P < 0. 01;DRCP:加权均数差为- 1. 70%,95% CI:- 2. 67%~- 0. 74%,P = 0. 0005);此外,有研究显示,与不吸烟者(50 例)相比,吸烟者(44 例)DRCP的血管密度显著降低[(31. 76 ± 6. 33)%比(53.09 ± 5. 88)%, P = 0. 006],FAZ 面积显著增大[(0.424±0.100) mm2比(0.333± 0.093)mm2,P =0. 002]。
性别与视网膜微血管的关系目前尚有争议。一项研究对104名健康土耳其人的OCTA数据进行分析,结果显示,与男性(50 例)相比,女性(54 例)的黄斑旁区SRCP的血管密度更大[(55. 41± 3. 02)%比(54. 33 ± 3.93)%,P = 0. 027][24]。而另一项研究对375例健康人群(女性201例)的OCTA数据进行分析,结果显示,在校正了年龄、种族后,黄斑旁区SRCP的血管密度与性别无关(女性:β = - 0.16,P = 0. 37)[20]。我们推测两项研究结果不同可能与研究纳入人群的年龄不同有关,前者平均年龄为(40.35 ±12.64)岁,而后者年龄中位数为55(38,63)岁。
此外,心房颤动与血脂异常也可能影响OCTA参数。一项横断面研究表明,与健康人群(35例)相比,心房颤动患者(34例)SRCP和RPC的血管密度均降低[SRCP:48.77 (45.19,52.12)%比53.01(50.00,54. 25)%, P< 0.01;RPC:51 . 82 (48 . 41,54 . 03)% 比56. 00(54. 35,57. 70)%,P < 0.01);另有研究显示,与健康人群(23 例)相比,血脂异常患者(20 例)的SRCP 和DRCP 的血管密度差异无统计学意义[SRCP:(42. 13 ±1.52)%比(41.50± 1. 42)%,P =0.062;DRCP:(43. 13 ± 2. 10)%比(42. 69 ± 1.78)%,P = 0. 329],但其CC 的血管密度显著降低[(52. 94 ±1. 29)% 比(53.69 ± 0. 94)%,P = 0. 005]。然而,以上两项研究样本量均较小,其结论有待进一步验证。
4 OCTA与CSVD相关影像学表现
CSVD 相关影像学表现主要包括脑白质高信号(white matter hyperintensities, WMHs)、近期皮质下小梗死(recent small subcortical infarct,RSSI)、假定血管源性的腔隙(以下简称“腔隙”)、脑微出血(cerebral microbleeds,CMBs)、扩大的血管周围间隙(enlarged perivascular space,EPVS)和脑萎缩。近年来,OCTA 与上述影像学表现的相关性研究逐渐受到关注。
4. 1 OCTA 与WMHs
OCTA 对WMHs 的评估和监测可能具有重要价值。在血流灌注方面,一项纳入了74 例WMHs 患者的横断面研究结果显示,患者RPC(ρ = - 0. 248,P = 0. 035)及DRCP(ρ = - 0. 283,P = 0. 015)的血管密度与其Fazekas 评分呈负相关;在微血管形态方面,一项纳入了64 例WMHs 患者的研究结果显示,与轻度WMHs(Fazekas 评分≤ 2 分)的患者(32 例)相比,中重度WMHs(Fazekas 评分≥3 分)患者(32 例)DRCP 的血管分形维数更低[(1. 49 ±0.05)比(1. 52 ± 0. 03),P = 0. 009]。WMHs周围的正常表观白质通常存在微损伤,在弥散张量成像上可表现为各向异性分数降低和平均弥散率升高,并具有较高的风险演变成WMHs。一项研究纳入行OCTA 检查的123 例轻型卒中(改良Rankin 量表评分≤ 2 分)患者进行分析,结果表明,SRCP 的血管密度与正常表观白质的平均弥散率呈负相关(β = - 0. 16,95% CI:- 0. 32 ~- 0. 01),SRCP 的血管分形维数与正常表观白质的各向异性分数呈正相关(β = 0. 17,95% CI:0. 01 ~0. 33),提示OCTA 可能在检测WMHs 超早期损伤中发挥重要作用。
不同部位WMHs 的OCTA 参数变化是否存在差异也受到了研究者关注。一项关于115 例CSVD 患者的研究显示,在校正了年龄、高血压病等血管危险因素后,RPC 的血管密度与患者深部WMHs 有关(OR = 0.909,95% CI:0. 828 ~ 0. 998,P = 0. 046),而与脑室旁WMHs 无关(OR = 0. 999,95% CI:0.914 ~ 1. 091,P = 0.975);然而,另一项对47 例CSVD 患者的OCTA 参数进行研究的结果显示,SRCP 的血管分形维数不仅与深部WMHs 有关(β =- 1. 772,95% CI:- 3. 048 ~ - 0497,P = 0. 007),还与脑室旁WMHs 有关(β = - 1. 427,95% CI:-2. 679 ~ - 0. 175,P = 0. 026);此外,Lahme 等在阿尔兹海默病患者(36 例)中也发现,SRCP 的血管密度与脑室旁WMHs 有关(r = - 0. 520,P =0.003)。与前一项研究相比,后2 项研究的样本量较少,有关OCTA 参数与脑室旁WMHs 的关系仍存在争议。由于不同部位WMHs 的发病机制存在差异,脑室旁的脑白质由来自软脑膜表面的长穿支动脉或起源于脉络膜动脉的室管膜下动脉的离室血管供血,主要受血流动力学紊乱的影响,而深部脑白质主要由起源于大脑中动脉的皮质支的髓动脉供血,主要受小血管损伤的危险因素的影响,且视网膜微血管与脑小血管具有诸多相同的危险因素,因此,我们推测OCTA 相关参数可能与深部WMHs的关系更为密切。
4. 2 OCTA 与RSSI
OCTA 可能对RSSI 的早期识别及患者神经功能缺损和潜在认知障碍的评估具有临床意义。研究表明,与健康对照组(39 例)相比,RSSI 患者(46 例)视网膜内层毛细血管的血管密度更低[(2. 32 ±0.13)mm2 比(2.37 ± 0. 10)mm2,P = 0. 003],并且视网膜内层毛细血管的血管密度与RSSI 患者的美国国立卫生研究院卒中量表评分(β = - 0.020,95% CI:- 0. 037 ~ - 0. 003,P = 0. 020)和蒙特利尔认知评估量表评分(β = - 0. 013,95% CI:- 0. 024 ~0. 003,P = 0. 016)存在相关性。
RSSI 在影像上显示为穿支动脉供血区的新发腔隙性梗死(lacunar infarction,LI),OCTA 的应用有助于对LI 的发病机制进行探究。一项横断面研究将14 例非LI(主要为脑皮质梗死)患者和19 例LI 患者的OCTA 参数进行了比较,结果显示,在校正了年龄和最佳矫正视力后,SRCP 的血管定向分布降低与LI 的发生独立相关(OR = 0. 41,95% CI:0. 20 ~0. 85,P = 0.017),但其潜在原因尚不清楚,推测与LI患者脑血流方向变化的复杂性较非LI患者更低有关。
4. 3 OCTA与腔隙
OCTA可能在腔隙的评估方面具有应用价值。一项关于49例CSVD患者的研究显示,与无腔隙患者相比,腔隙患者DRCP的血管密度存在下降趋势,但差异无统计学意义[(52. 00 ±5. 98)% 比(55. 15 ±5. 034)%,P = 0.060];另一项关于CSVD患者更大样本量(115例)的研究显示,与无腔隙者(50例)相比,存在腔隙的患者(65 例)SRCP的血管密度更低[(41. 4 ± 7. 0)%比(46. 7 ± 6.0)%,P < 0. 01],进一步行多元Logistic回归分析显示,在校正高血压病后,SRCP的血管密度与腔隙的存在独立相关(OR =0.889,95% CI:0. 817 ~ 0. 967,P = 0.006)。一项对139名50岁以上无记忆减退主诉且经临床痴呆评定量表评估为正常的健康老年人[平均年龄(59. 43 ± 7.31)岁]进行OCTA 检查的研究显示,DRCP的血管分形维数与存在腔隙具有显著相关性(β = 0.58,95% CI:0. 15 ~ 0. 93,P = 0. 007)。综上所述,OCTA 参数可能成为评估腔隙的重要标志物。
4. 4 OCTA与CMBs
目前研究尚未发现OCTA参数与CMBs的相关性。在血流灌注方面,有研究显示,无CMBs 者(40例)和有CMBs患者(75 例)的SRCP[(44.2 ±6. 3)% 比(44. 7 ± 8.0)%,P = 0. 678]、DRCP[(48.6 ± 6.9)%比(48. 0 ± 7. 3)%,P = 0. 643]和RPC[(47. 4 ± 4.8)%比(47. 2 ± 5. 7)%,P = 0.812]的血管密度差异均无统计学意义;另一项纳入49 例CSVD患者的横断面研究显示,患者左眼中央凹旁区和中央凹周围区DRCP的血管密度与CSVD患者CMBs 的数目无相关性(中央凹旁区:r =0.072,P = 0. 626;中央凹周围区:r = 0. 001,P =0.994)。在微血管形态方面,对139 名无记忆减退主诉且经临床痴呆评定量表评估为正常的健康老年人行OCTA检查后发现,在调整了年龄、性别、高血压病等混杂因素后,SRCP 和DRCP 的血管密度(SRCP: β = 0.20, 95%CI: -0.21~0.61,P=0.343; DRCP:β = -0.21,95% CI: - 0.82~ 0.40,P= 0.496)及血管分形维数(SRCP: β=-0.11,95%CI:-0.58~0.36,P=0.647;DRCP:β =- 0. 11,95% CI:- 0. 50 ~ 0.28,P = 0. 581)均与受试者CMBs的数目无关。上述研究均未发现OCTA参数与CMBs的相关性,我们推测这可能与以下两种原因有关:(1)根据病变位置,CMBs可分为脑叶CMBs和深部CMBs,脑叶CMBs主要与脑淀粉样血管病变有关,深部CMBs则与高血压性血管病变关系更加密切,发病机制的不同可能使得两者与OCTA参数的关联性不同,然而上述研究均未对CMBs 的位置进行进一步区分,可能对研究结果产生影响;(2)CMBs 为脑出血性疾病,而视网膜微血管灌注和形态学参数变化主要反映视网膜及脑缺血改变,因此CMBs 与OCTA参数可能本身并无相关性。
4. 5 OCTA与EPVS
OCTA参数与EPVS的相关性目前结论尚不一致。有研究根据患者基底节区和半卵圆中心区的EPVS总数目将115例CSVD患者分为轻度EPVS组(EPVS≤20 个)和中重度EPVS 组(EPVS > 20 个)并进行OCTA参数的比较,结果显示,与轻度EPVS组(71例)相比,中重度EPVS 组(44 例)患者RPC的血管密度显著降低[(45. 4 ± 5. 9)%比(48. 5 ±4.2)%,
P = 0. 001],而两组间SRCP和DRCP的血管密度差异无统计学意义[SRCP:(43. 9 ± 7. 7)%比(44. 7 ± 6. 4)%,P = 0.545;DRCP:(47. 7 ± 6. 6)%比(48. 9 ± 7. 2)%,P = 0.261];另有研究根据患者基底节区EPVS的数目将49例CSVD患者EPVS的严重程度分为0 ~ 4级,其简单线性回归分析结果显示,左眼中央凹旁区和中央凹周围区DRCP的血管密度与基底节区EPVS的严重程度有关(中央凹旁区:r = -0.445,P =0. 001;中央凹周围区:r = -0.396,P = 0. 005);Wiseman等则对123 例轻型卒中患者[改良Rankin量表评分≤2分,平均年龄(68. 1 ±9. 9)岁]的半卵圆中心区和基底节区EPVS的体积进行了定量分析,结果表明,在调整了年龄、糖尿病、高血压病等混杂因素后,SRCP的血管密度与半卵圆中心区和基底节区EPVS 的体积均无关(均P >0. 05)。上述3项研究在研究人群、样本量、EPVS的评估方法等方面均存在差异,这可能是导致研究结论不同的原因,未来需要更多的研究来探究OCTA参数和EPVS的相关性。
4. 6 OCTA与脑萎缩
脑萎缩与认知功能下降和运动功能障碍密切相关,需要定期随访与监测。一项横断面研究应用OCTA检测了139名50岁以上无记忆减退主诉且经临床痴呆评定量表评估为正常的健康老年人的视网膜微血管结构,并对受试者的总脑容量、脑白质容量、脑灰质容量进行了测定,结果显示,在调整了年龄、性别、高血压病等混杂因素后,SRCP和DRCP的微血管弯曲度和血管分形维数与受试者的总脑容量、脑白质容量和脑灰质容量均无相关性(均P >0.05)。然而该研究为横断面研究,未对各脑结构容量的纵向变化进行评估,且该研究人群年龄较轻,平均年龄为(59. 43 ± 7. 31)岁,此外该人群均无脑部疾病,这些均可能为未发现SRCP 和DRCP 的微血管弯曲度和血管分形维数与脑萎缩关系的原因。
4. 7 OCTA与CSVD影像学总负荷
OCTA参数与CSVD影像学总负荷存在相关性。应用OCTA对由28例阿尔茨海默病相关认知障碍、18例血管性认知障碍和14例认知正常受试者组成的人群进行研究,结果显示,在调整了年龄、性别、高血压病等混杂因素后,上象限和颞侧象限RPC的血管密度与该人群CSVD 总负荷(包括腔隙、WMHs、CMBs)独立相关(上象限:β = - 0.059,95% CI:-0. 097 ~ - 0. 021,P = 0.003;颞侧象限:β = - 0. 048,95% CI:- 0. 080 ~ - 0.017,P = 0. 003);Kwapong等对46例RSSI患者进行了研究,在调整了高血压病、糖尿病、血脂异常等混杂因素后,视网膜内层毛细血管的血管密度与CSVD总负荷(包括腔隙、WMHs、CMBs、EPVS)显著相关(β = 0. 067,95% CI:0. 013 ~ 0. 121,P = 0. 014);另一项关于49 例CSVD 患者的研究显示,在调整了年龄、高血压病、糖尿病、吸烟等混杂因素后,CSVD 患者左眼黄斑中心凹旁区(β = - 0. 185,95% CI:- 0.351 ~- 0. 018,P = 0. 030)和中心凹周围区DRCP(β =- 0. 113,95% CI:- 0. 208 ~ - 0. 018,P = 0. 021)的血管密度与CSVD总负荷(包括腔隙、WMHs、CMBs、EPVS)显著相关。然而上述研究均未对OCTA对CSVD总负荷的预测价值进行评估,未来需进一步研究。
5 OCTA在遗传性CSVD中的应用
目前已有研究对OCTA参数与遗传性CSVD的关系进行研究,包括伴有皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL)、法布里病 和 伴有脑白质营养不良 和 全身表现的视网膜血管病变 (retinal vasculopathy with cerebral leukoencephalopathyand systemic manifestations,RVCL-S)。Nelis 等对11例CADASIL患者的21 只眼进行了OCTA检查,与年龄匹配的健康对照组(21 例,21 只眼)相比,CADASIL患者黄斑区DRCP 的血管密度明显降低[(57. 62 ± 2. 46)%比(61.33 ± 1. 93)%,P < 0. 01;Cennamo 等应用OCTA 观察了法布里病患者(54 例)的黄斑区微血管变化,与健康对照组(70 例)相比,法布里病患者SRCP的血管密度显著降低[(49. 95 ± 5. 17)%比(51. 99 ± 2.52)%,P <0.01],DRCP血管密度显著升高[(54.82 ± 8. 07)%比(50. 93 ± 5.46)%,P = 0. 005];Al-Nofal 等对6 例RVCL-S患者(11只眼)的SRCP的血管密度进行了评估,与年龄匹配的健康对照组(6 例,10 只眼)相比,RVCL-S患者SRCP的血管密度明显降低[18.2 (15.8, 18.6)%比24.4 (21.5, 26.8)%, P<0.01]。综上,OCTA可能在遗传性CSVD的诊断和监测中发挥作用。
6 总结与展望
OCTA作为一种新型的血流测量技术,可以无创性地获取不同深度的眼底血管图像,探究和识别CSVD相关的OCTA标志物,对于CSVD的早期识别以及动态评估至关重要。然而,目前关于OCTA与CSVD的临床研究相对较少,且相关研究结论仍存在争议,今后尚需在以下方面进行更为深入的研究:(1)需要更多的动物实验及临床研究来进一步阐明视网膜微血管与脑小血管和各神经结构之间的联系,为OCTA在CSVD的应用提供更多的理论依据;(2)进一步研究和制定关于OCTA在CSVD中应用的技术标准,以保证各研究结果的可靠性和可比性;(3)目前关于微血管病变OCTA与单一的CSVD影像学标志物的相关性尚不明确,需要进一步探究;(4)目前关于OCTA在CSVD中的研究均为横断面研究,且样本量较小,需要更多的大型前瞻性研究来评估OCTA在监测CSVD中的应用价值。