治疗相关CMML
治疗相关性髓系肿瘤 (t-MN) 是细胞毒性化疗和/或放疗的晚期并发症,包括急性髓系白血病 (AML)、骨髓增生异常综合征 (MDS) 和骨髓增生异常/骨髓增殖性肿瘤,占所有髓系肿瘤的10%-20%,且占比可能进一步上升。t-MN多存在高危遗传学特征(例如复杂核型、TP53突变),且结局不佳。
慢性粒-单核细胞白血病(CMML)是一种以持续性单核细胞增多伴骨髓增生异常和骨髓增生为特征的造血干细胞肿瘤。与AML和MDS相比,CMML的细胞遗传学异常发生率较低(约30%)。此外,CMML具有独特的遗传学特征,TET2、SRSF2和ASXL1是最常见的突变基因。CMML的有效治疗方法有限,并且患者有转化为AML的风险,而AML与不良生存期相关。尽管既往研究提示治疗相关性CMML (tCMML)占所有CMML的9 ~ 11%,但由于其罕见性和缺乏特异性报道,相关数据仍然很少。此外,尽管有研究表明tCMML病例中高危遗传学特征的发生率增加,但数据仍相互矛盾,且很少有研究进行详细的突变谱分析。因此,有必要在大样本人群中评估tCMML的临床和遗传学特征
为进一步研究tCMML的自然史和特征,学者评估了目前最大样本的tCMML患者队列,并将其基线细胞遗传学和分子特征与原发性CMML (dnCMML)进行比较;还描述了tCMML与dnCMML和其他t-MN患者相比的综合生存分析结果。研究结果近日发表于《Blood Advances》。

关键点
1、与tMDS/tAML相比,tCMML中高危特征(如TP53突变或复杂核型)的发生率较低。
2、tCMML并不表现出治疗相关髓系肿瘤的不良结局。
研究结果
该研究回顾性纳入MD安德森癌症中心2005-2022年期间诊断的CMML患者(根据2016 WHO标准),其中tCMML患者定义为有细胞毒性治疗(化疗和放疗)暴露史的患者。使用28和81二代测序(NGS)基因panel进行突变分析。此外,利用MD安德森数据库中2017-2022年998例MDS患者与tCMML患者进行比较。
基线特征
研究共纳入532例CMML患者,包括71例(13%)为tCMML,基线特征见表1。
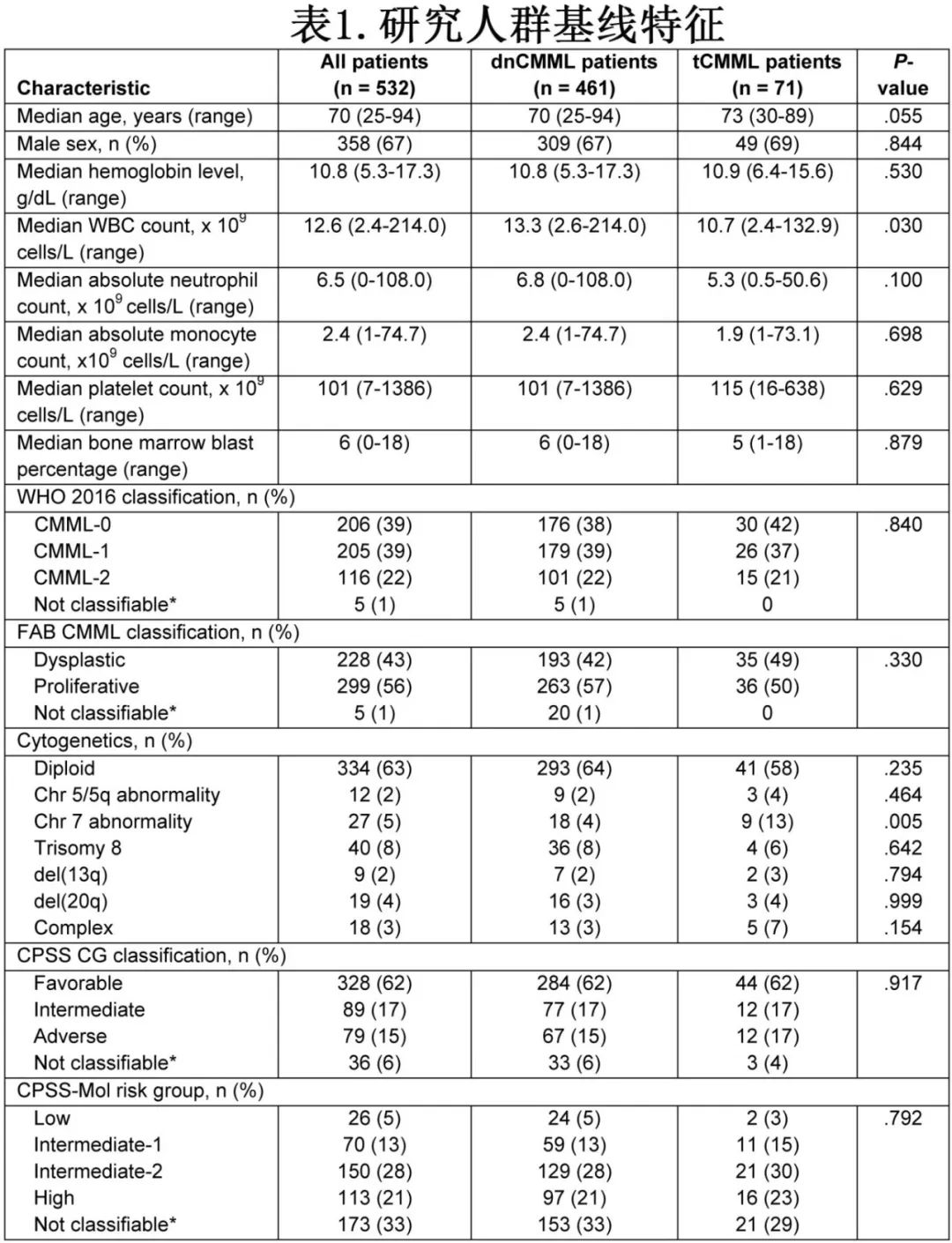
整组患者中位年龄70岁,其中dnCMML患者70岁,tCMML患者73岁 (P=0.054)。358例(67%)为男性。中位白细胞计数为12.6×109/L,其中dnCMML患者为13.3×109/L, tCMML患者为10.7×109/L (P=0.03)。根据FAB分类,发育异常型有228例(43%),dnCMML和tCMML中分别有193例(43%)和35例(49%);增殖型有299例(56%),dnCMML和tCMML中分别有263例(57%)和36例(41%);P=0.33)。根据WHO 2016分类,206例(39%)患者为CMML-0 (dnCMML和tCMML中分别有176例[38%]和30例[42%]),205例(39%)为CMML-1 (179例[39%]和26例[36%]),116例(22%)为CMML-2 (101例[22%]和15例[21%];P=0.839);根据WHO 2022分类,401例患者(76%)为CMML-1 (346[75%]和55[77%]), CMML-2亚组的患者比例与WHO 2016相同.
从细胞毒治疗到诊断tCMML的中位时间为6.5年。在比较不同治疗类型时,从癌症治疗到tCMML诊断的中位时间没有差异。tCMML确诊时,11例(15.5%)患者存在活动性肿瘤。
细胞遗传学和分子学结果
诊断时,334例(63%)患者染色体核型正常(dnCMML和tCMML患者分别有293例(64%)和41例(58%);P=0.23])。27例患者(5%)携带7号染色体异常,且tCMML患者(n=9[13%])高于dnCMML患者(n=18 [4%];P=0.005)。复杂核型(定义为≥3个染色体异常)在tCMML患者(n=5[7%])中比在dnCMML患者(n=13[3%])中更常见,但差异无显著性(P=0.15)。根据CMML预后评分系统(CPSS)细胞遗传学风险分类,328例患者(62%)为低危(dnCMML和tCMML中分别有284例[62%]和44例[62%]),89例患者(17%)为中危(77例[17%]和12例[17%]),79例患者(15%)为高危组(67例[15%]和12例[17%];P=0.98)。
374例(70%)患者有NGS数据(dnCMML和tCMML中分别有51例[72%]和323例[70%]),其中28基因panel为109例(29%)、81基因panel为265例(71%)。最常见的突变包括TET2 (n=210[56%])、ASXL1 (n=170[45%])、SRSF2 (n=109[29%])和RUNX1 (n=77[21%]),且其发生率在dnCMML和tCMML之间无显著差异。突变频率和变异等位基因频率见图1。
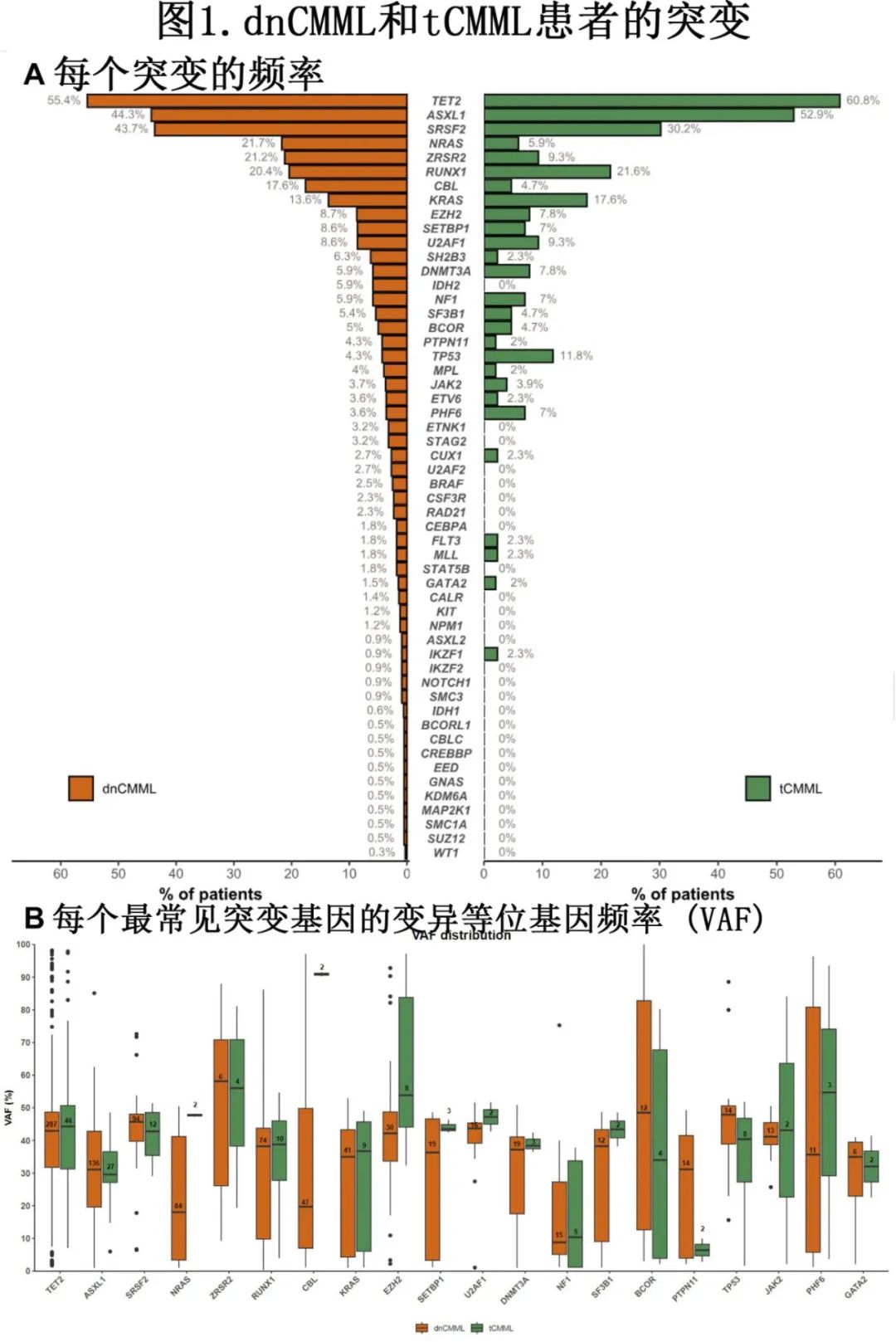
与dnCMML患者相比,tCMML患者NRAS突变(n=70 [22%] vs. n=3 [6%];P=0.007)和CBL突变(n=39[12%] vs. n=2[4%];P=0.04) 发生率较低,但tCMML患者TP53突变发生率较高(n=14[4%] vs. n=6 [12%];P=0.04)。TP53多打击包括7例 dnCMML 患者(TP53 突变dnCMML 患者中50%)和4例 tCMML 患者(TP53 突变tCMML 患者中67%;P=0.84)。当比较 dnCMML 和 tCMML 患者的变异等位基因频率差异时,tCMML患者CBL(91% vs. 19%;P=0.01)和NRAS(48% vs. 18%;P=0.04)突变的中位变异等位基因频率较高。
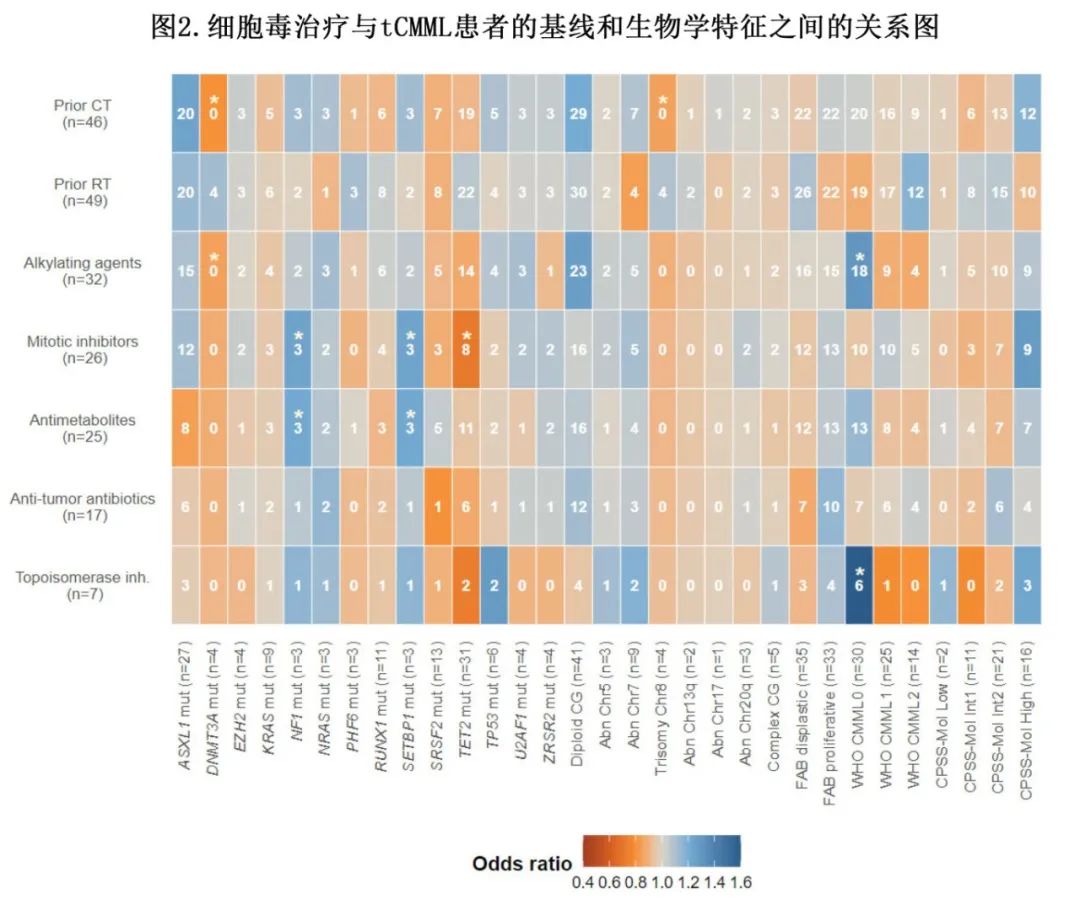
对因先前恶性肿瘤接受的治疗类型与tCMML诊断时的生物学变量之间的关联进行探索性分析(图2)。8号染色体三体(比值比 [OR]=0.85;P=0.006)或DNMT3A突变(OR=0.80;P=0.004)患者既往均未接受过化疗。接受烷化剂或II型拓扑异构酶抑制剂治疗的患者与CMML-0 tCMML相关(烷化剂OR=1.30,P=0.03;II型拓扑异构酶抑制剂OR=1.60,P=0.02)。所有NF1或SETBP1突变患者均接受过抗代谢药和有丝分裂抑制剂治疗(抗代谢药OR=1.22,P=0.01;有丝分裂抑制剂OR=1.24,P=0.009)。此外,接受有丝分裂抑制剂治疗的患者与较低的TET2突变频率相关(OR=0.71,P=0.01)。
在359例可评估CPSS-Mol评分的患者中,26例(5%)为低危(dnCMML和tCMML患者分别有24例[5%]和2例[3%]),70例(13%)为中危-1 (59例[13%]和11例[15%]),150例(28%)为中危-2 (129例[28%]和21例[30%]),13例(21%)为高危(97例[21%]和16例[23%])(P=0.79)。
治疗反应和生存分析
所有患者中共351例(66%)接受CMML治疗,最常使用的药物为去甲基化药物(328例[93%]),其次为强化化疗(10例[3%])和小剂量化疗(5例[1%])。在接受去甲基化药物治疗的患者中,总缓解率(完全缓解或骨髓完全缓解)为59% (195/328),且dnCMML患者(167/281[59%])和tCMML患者(28/47 [60%])无差异(P=1);6例(7.4%)tCMML患者和72例(15.6%)患者接受了异基因造血干细胞移植(P=0.12)。
中位随访58.3个月,中位OS (mOS)和中位LFS (mLFS)时间分别为35.9个月和28.6个月 (图3),2年OS率和LFS率分别为64.8%和56.1%;dnCMML患者的mOS和mLFS时间分别为35.9个月和28.9个月,tCMML患者的mOS和mLFS时间分别为34.7个月和28.2个月(OS和LFS分别为P=0.26和P=0.8)。对于因先前恶性肿瘤仅接受过放疗与接受过化疗的tCMML患者,OS无差异(mOS,37.9个月 vs 30.9个月;P=0.811)。CPSS-Mol低危组、中危-1组、中危-2组和高危组患者的mOS分别为75.0、82.6、44.1和22.9个月(P<0.001);对于dnCMML 和tCMML,相应的mOS分别为75.0个月 vs 未达到(P=0.605)、88.0个月 vs 37.9个月(P=0.016),、44.1个月 vs 36.3个月(P=0.515)、23.1个月 vs 21.4个月(P=0.399)。
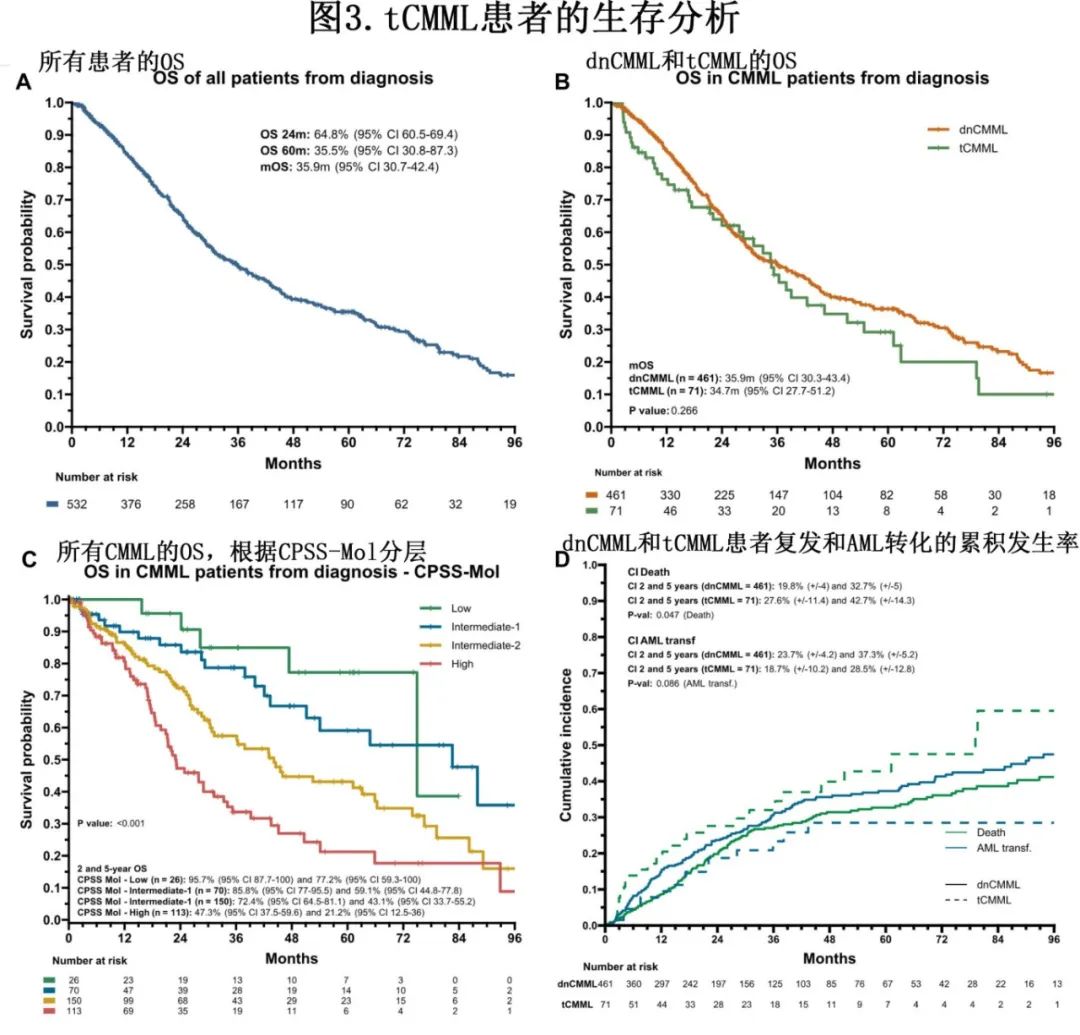
所有CMML患者OS的单因素和多因素分析结果见图4,年龄大于70岁(风险比[HR]=1.52,P=0.013)、既往接受过tCMML化疗(HR=1.76,P=0.026)、CPSS-Mol中危组(HR=2.94,P=0.021)和CPSS-Mol高危组(HR=5.24,P<0.001)是OS的独立危险因素。
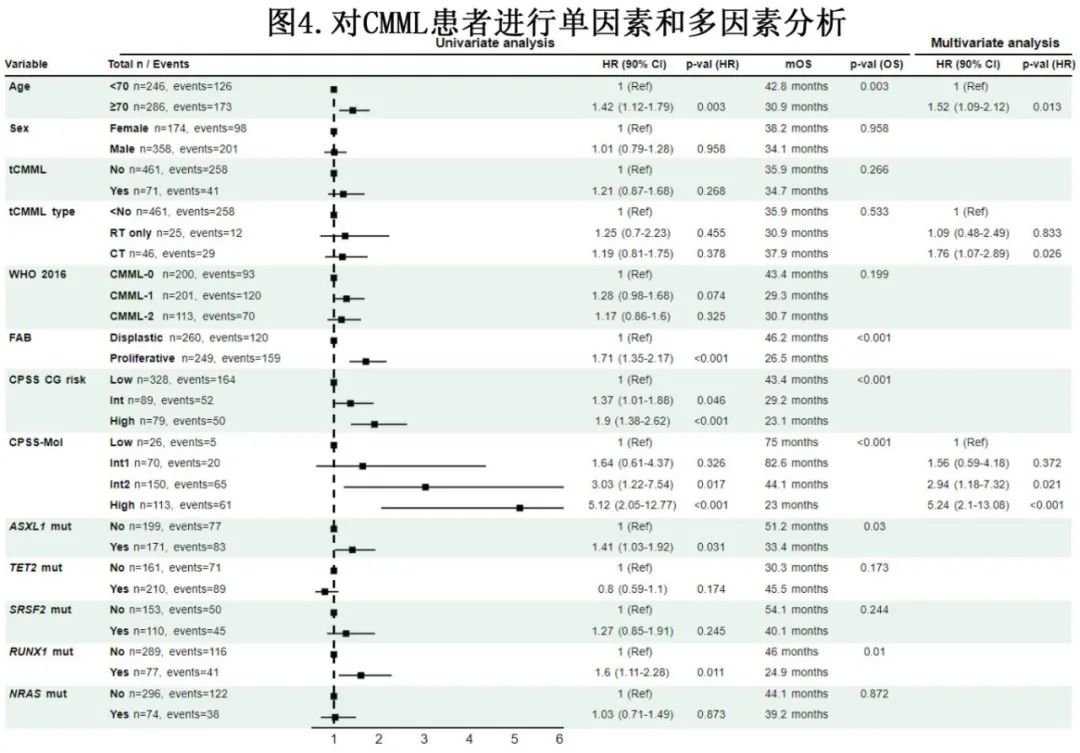
AML转化的2年和5年累积发生率分别为23.0%和36.1%。无AML转化的2年和5年累积死亡率分别为20.8%和33.9%。dnCMML和tCMML患者的2年AML转化累积发生率分别为23.7%和18.7% (P=0.086), 2年无转化死亡累积发生率分别为19.8%和27.6% (P=0.047)。在中危-1组中,dnCMML患者(6.9%)和tCMML患者(39.4%)之间无转化死亡的2年累积发生率有显著差异(P=0.002)。
治疗相关MDS对比tCMML
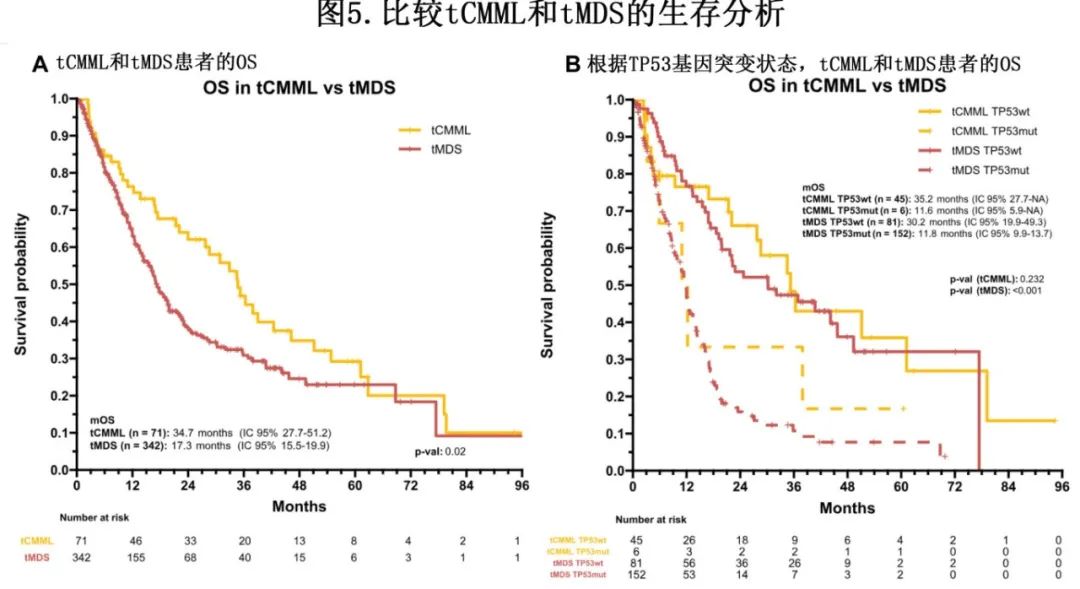
为确定治疗相关髓系肿瘤的临床结局是否由潜在的表型和基因组特征所驱动,作者比较了tCMML与治疗相关MDS (tMDS)队列的特征。共纳入998例MDS患者,中位随访时间23.9个月,其中tMDS组342例(34%),原发性MDS组656例(66%)。tMDS患者的7号染色体异常 (30.1% vs 9.1%;P<0.001)、复杂核型(39.8% vs 19.4%;P<0.001)和TP53突变(44.4% vs 20.1%;P<0.001) 发生率高于原发性MDS。在TP53突变的tMDS和原发性MDS患者中,分别有64%和59%存在TP53多打击(P=0.49)。tMDS中复杂核型(39.8% vs 7%,P<0.001)和TP53突变(44.4% vs 12%,P<0.001)发生率高于tCMML。正常核型在tMDS患者中的比例低于原发性MDS患者(17.3% vs 42.8%;P<0.001)。
tMDS的mOS为17.3个月(tCMML组34.7个月;P=0.02)。根据疾病和TP53状态进行分层,伴TP53突变tCMML和tMDS患者的mOS(分别为11.6个月和11.8个月)短于无TP53突变的tCMML和tMDS患者(分别为35.2个月和30.2个月;P=0.2 [tCMML]和P<0.001 [tMDS])(图5)。
总结
该研究对迄今为止发表的最大的tCMML患者队列进行了全面分析,分析纳入治疗相关慢性粒单核细胞白血病(tCMML;n=71,占所有CMML的13%),并与原发性CMML (dnCMML;n=461)进行对比。从细胞毒治疗到诊断tCMML的中位时间为6.5年。与dnCMML相比,7号染色体异常在tCMML中更常见(4% vs 13%;P=0.005),而复杂核型无差异(3% vs 7%;P=0.15)。tCMML具有较高的TP53突变频率(4% vs 12%;P =0.04)和较低的NRAS(6% vs 22%,P=0.007)和CBL(4% vs 12%,P=0.04)突变频率。既往抗代谢药物治疗(OR=1.22,P=0.01)和有丝分裂抑制剂(OR=1.24,P=0.009)与NF1和SETBP1突变相关,而既往有丝分裂抑制治疗与较低的TET2突变频率相关(OR=0.71,P=0.01)。虽然tCMML和dnCMML的中位总生存期无差异(34.7个月 vs 35.9个月,P=0.26),但OS的多因素分析显示,既往tCMML化疗与死亡风险增加相关(HR=1.76 ,P=0.026)。与治疗相关骨髓增生异常综合征的队列相比,tCMML有较低的TP53突变频率(44.4% vs 12%,P<0.001)和较少的不良结局。
总的来说,tCMML在生物学上与其他t-MN不同,具有较少的高危特征,如复杂核型和TP53突变。与tMDS或治疗相关AML相比,这些变异可能源于tCMML独特的白血病发生机制,因此tCMML的预后并不像其他t-MN那样糟糕。鉴于tCMML与dnCMML的临床和生物学相似性,该研究结果支持tCMML患者有资格成为临床试验的潜在候选者。与此相关, t-MN基于临床和遗传特征进行定义也有价值,包括既往暴露于细胞毒药物以及与其致白血病机制有关的特定遗传学异常,如 TP53 突变或染色体异常。
参考文献
Bataller A, et al.Therapy-related chronic myelomonocytic leukemia does not have the high-risk features of a therapy-related neoplasm.Blood Adv . 2024 Mar 21:bloodadvances.2024012565. doi: 10.1182/bloodadvances.2024012565.