肺移植术后原发性移植物失功预警和规范化治疗路径中国专家共识
时间:2025-08-27 12:10:27 来源 网络 作者:网络
摘 要
原发性移植物失功(primary graft dysfunction,PGD)是肺移植术后最常见且影响远期生存率的重要并发症。PGD的发生与供受体风险因素、手术操作及围术期管理密切相关,早期识别与规范化干预对于改善预后至关重要。本共识由国内肺移植领域多学科专家小组制定,基于系统文献回顾、循证医学证据与临床实践经验,系统梳理了PGD的定义与分级、主要病理机制、供受体及围术期风险因素,并建立了动态预警机制和分级治疗标准流程。本共识强调通过术前全面评估、术中多参数监测、术后流程化干预以及出院后随访管理,构建完整的闭环管理体系,旨在规范临床操作、降低PGD发生率、促进移植物功能恢复、提高患者长期生存率。共识采用GRADE(Grading of Recommendations,Assessment,Development and Evaluation)分级体系进行推荐强度与证据等级评价,为肺移植中心提供科学、系统、可操作的临床指导框架。
正 文
肺移植作为终末期肺病的有效治疗方式,其术后并发症显著影响患者生存与生活质量。原发性移植物失功(primary graft dysfunction,PGD)是肺移植术后最常见的早期并发症之一。PGD的发生与早期死亡和长期慢性肺移植物功能障碍(chronic lung allograft dysfunction,CLAD)密切相关。目前认为PGD 的主要病理基础是缺血-再灌注损伤,在器官冷缺血与热缺血过程中,氧自由基大量生成,激活补体系统和凝血通路,导致内皮细胞和肺泡上皮细胞损伤。这一过程还引发炎症级联反应,大量炎性细胞(如中性粒细胞、单核细胞)聚集,释放白细胞介素(interleukin,IL)-6、IL-8、TNF-α等促炎因子,造成肺泡-毛细血管屏障破坏,引起浆液渗出、肺泡水肿、透明膜形成,导致肺泡塌陷和气体交换障碍,类似急性肺损伤和急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)表现。
PGD主要表现为急性肺水肿和严重低氧血症,PGD 3级患者的死亡率将大幅增加,30 d死亡率约为27%[1],并与CLAD显著相关,术后1年生存率下降至60%~70%[2]。因此,PGD的预防、早期识别与干预对于改善肺移植预后具有关键意义。但由于其发病机制复杂、临床异质性强,尚无统一的早期预警和治疗规范。本共识结合国内外研究进展及专家临床经验,旨在为肺移植中心提供系统的PGD预警及规范化治疗路径。
1 共识制订过程
1.1 工作组组建
本共识由国内肺移植领域临床专家牵头组织制定,成立了4个专题制定小组。① 供受体风险因素评估小组:主要负责供体选择标准、受体评估与匹配策略;② 术中、术后动态监测与预警机制小组:制定术中肺顺应性、氧合指标、影像学监测规范;③ 标准化治疗路径小组:负责制定PGD不同分级的治疗管理策略,包括机械通气、液体管理、静脉-静脉体外膜肺氧合(veno-venous extracorporeal membrane oxygenation,VV-ECMO)应用等;④ 出院后管理与预后监测小组:制定术后随访、肺功能监测、长期管理标准。各小组由移植外科、重症医学科、呼吸科、麻醉科、影像医学科等多学科专家组成,具有临床一线工作经验及研究背景。
1.2 目标用户
本共识的主要适用对象为肺移植相关领域的临床医师,包括胸外科、重症医学科、呼吸科、麻醉科、移植协调团队成员、重症监护与康复治疗人员、医学科研人员与相关管理者。
1.3 目标人群
所有肺移植手术后的成人患者,包括术后发生或高风险发生PGD的患者群体。
1.4 利益冲突声明与管理
共识制定专家组成员均独立参与制定工作,遵循临床客观、公正、中立原则。无直接的商业利益冲突,相关制定过程接受独立学术审阅、监督。
1.5 共识范围及优先临床问题的确定
本共识按照术前评估、术中监测、术后治疗及出院随访的完整流程进行章节设计;每部分均以临床实际操作为导向,结合多学科管理模式。
1.6 证据来源与评价
本共识依据循证医学原则,综合国内外权威文献、指南及临床实践经验制定。证据来源主要包括:国际权威机构发布的指南,如国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)PGD共识、多伦多肺移植管理协议等,近5年内发表的肺移植与PGD相关高质量研究文献,以及我国肺移植中心真实世界临床数据总结。在制定过程中,参考国际公认的GRADE(Grading of Recommendations,Assessment,Development and Evaluation)分级体系[3]对所有推荐意见的推荐强度与证据质量进行了统一分级。推荐意见根据临床获益与风险评估分为两类:强推荐表示明确获益远大于风险,必须实施,适用于绝大多数患者人群;弱推荐表示获益可能大于风险,应结合具体临床情境和患者个体情况综合判断后实施。证据质量分为4级:A级证据指基于高质量随机对照试验、系统评价或Meta分析的研究结果,具有高度可信性;B级证据指基于单个随机对照研究或较大规模观察性研究,虽存在一定局限性但整体可靠;C级证据则指基于小规模研究、病例系列报告、专家经验或观察性描述,证据可靠性较低,解释时需谨慎;D级证据指基于有限证据和专家意见提出,获益效果不确定,需谨慎使用(表1)。每一条推荐意见均经制定小组成员多轮讨论,依据可用证据的可靠性、适用性和临床可行性进行综合评估,并通过专家投票一致同意后纳入最终文本。力求在保证科学严谨性的同时,兼顾实际临床操作的可行性和推广性。

1.7 推荐意见确定
在共识制定过程中,各专题制定小组首先基于系统文献检索、国际权威指南、真实世界临床数据以及现行标准操作程序(SOP)进行证据收集与整理。随后,结合临床实际应用场景,对每一条推荐意见进行多轮讨论与评估。在证据支持基础上,小组成员就推荐意见的必要性、可行性和适用性进行了充分讨论,采用小组内部匿名投票方式进行确认。对于存在分歧的部分,采取反复讨论与再投票机制,直至超过80%以上专家成员同意,方可纳入正式共识文本。
2 PGD定义与分级标准
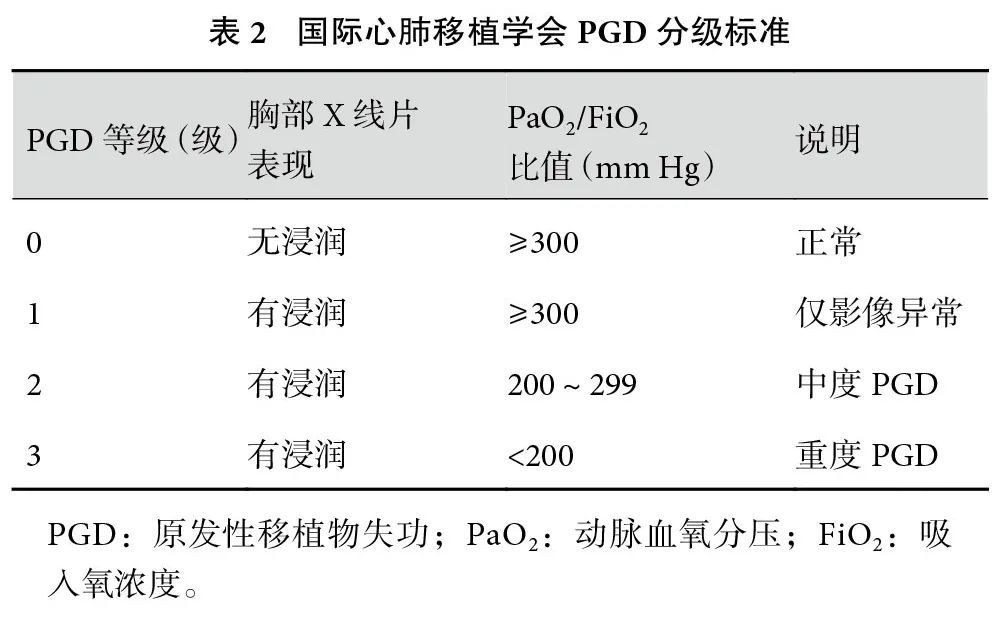
ISHLT于2005年发布了 PGD的诊断标准[4],将PGD定义为肺移植术后72 h内发生的非心源性肺水肿,需排除其他原因如感染、肺栓塞、急性排斥反应等。其诊断主要依赖胸部X线片和动脉血气分析,分为0~3级(表2)。最终诊断以术后0、24、48、72 h最重等级为准。这一标准为全球各地肺移植中心提供了统一评估依据,使术后病情评估、研究比较、临床路径制定更具可操作性和一致性。通过标准化分级体系,可以早期识别高风险患者,及时启动干预措施,显著改善患者短期与长期预后。
3 PGD风险预警
PGD的发病机制复杂,影响因素众多,目前已知的PGD发生风险因素包括:供肺保存时间过长、供受体大小不匹配、供体吸烟史、酗酒、机械通气时间延长、供肺感染、氧合差、误吸等,以及受体体重指数过高、术中容量负荷过大、单肺移植、术中肺动脉高压、体外循环使用等。近年研究[5]还发现,受体炎症状态、术前合并感染或免疫激活也会增加PGD风险。与PGD相关的风险因素主要分为供体相关、受体相关、手术与围术期相关因素。术前需评估供受体的高危因素,术中监测肺顺应性和氧合情况,术后动态评估动脉血氧分压(partial pressure of arterial oxygen,PaO₂)/吸入氧浓度(fraction of inspired oxygen,FiO₂)、影像、肺超声评分等,必要时评估IL-6、可溶性晚期糖基化终末产物受体(soluble receptor for advanced glycation end products,sRAGE)等炎症与损伤生物标志物[6]。我们将从这几个方面进行总结,方便对高危患者进行早期预警和识别。识别高危个体和建立有效预警机制是防治关键。
3.1 供体相关风险因素
共识1:供体质量及边缘供体使用与PGD直接相关(弱推荐,B级证据)。
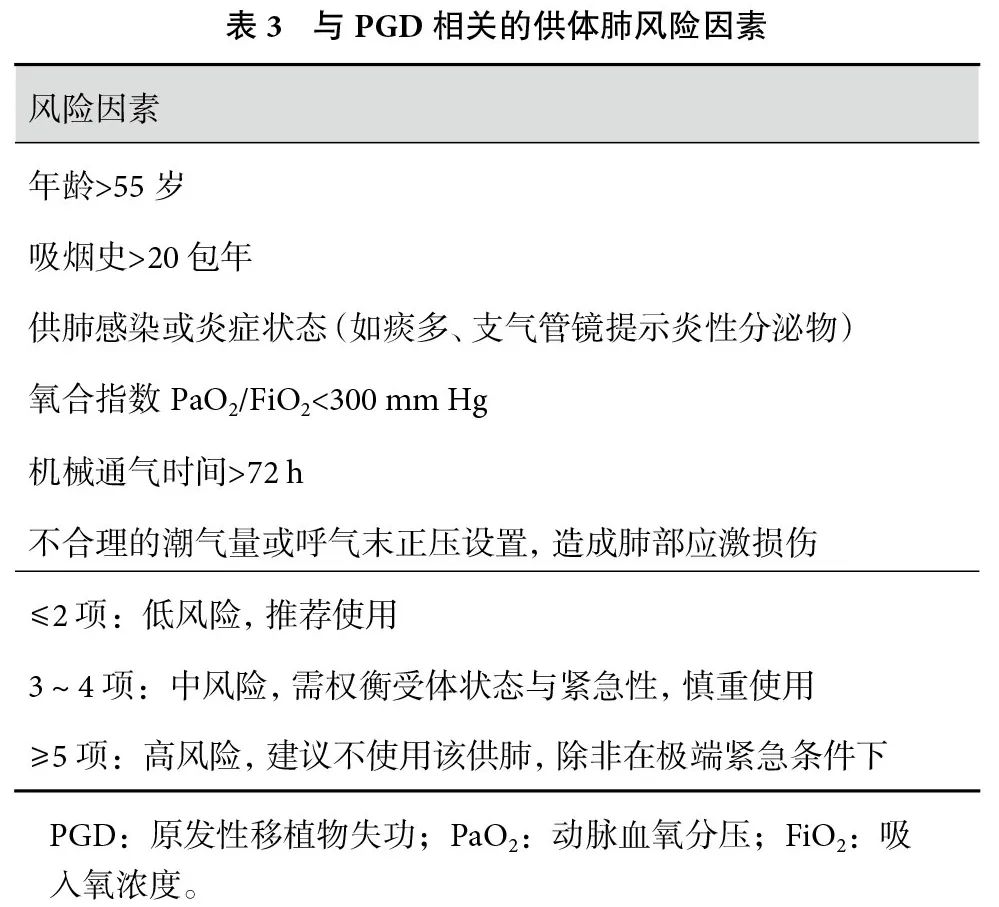
边缘供体(如氧合功能下降、轻度感染、年长供体等)使用增加PGD发生风险[1],使用前需综合评估供肺氧合、影像及支气管镜表现,严格筛选高风险特征供肺,术前制定个体化管理策略。为加强供体风险识别与使用安全性,本共识建议建立供体肺PGD风险评估评分系统(表3)。
共识2:供肺与受体体积不匹配增加PGD风险(弱推荐,B级证据)。
在肺移植中,供受体大小匹配(体积匹配)是决定术后肺顺应性与氧合功能恢复的关键因素之一。研究[7]显示,供体肺总肺容量(total lung capacity,TLC)与受体TLC比例若<0.8或>1.2时,供肺与受体胸腔容积明显不匹配,容易引发供肺受压或过度牵张,导致氧合障碍、肺水肿、通气-灌注失配等,显著提高PGD发生风险。术前应通过预测总肺容量(predicted total lung capacity,pTLC)或胸部CT测量肺容量(computed tomography-derived total lung capacity,ctTLC)进行精准评估,推荐供受体TLC比例控制在0.8~1.2范围内。必要时可在术中采取肺叶切除等手段进行体积调整,优化供受体匹配,降低PGD风险。
充分证据表明,合理的通气参数设置与定期肺复张操作对于减少肺不张、提高氧合能力和保护供肺结构完整性具有重要作用[8]。通过维持肺泡持续开放,可有效避免塌陷肺泡的反复开放-关闭所产生的剪切应力、减少机械通气相关的炎症激活与肺损伤,同时改善肺顺应性与移植后氧合功能,从而降低PGD发生率,是供肺维护过程中不可或缺的环节。
共识3:合理设置供肺呼吸机参数是术中和术后预防PGD发生的重要基础(弱推荐,B级证据)。
推荐采用肺保护性通气策略,具体参数如下:① 潮气量(tidal volume,Vt):6~8 mL/kg理想体重,避免肺泡过度扩张;② 呼气末正压(positive end-expiratory pressure,PEEP):维持在5~8 cm H₂O(1 cm H₂O=0.098 kPa),防止肺泡塌陷与反复膨胀损伤;③ 吸气平台压:控制在<30 cm H₂O;④ 呼气末二氧化碳(end-tidal carbon dioxide,ETCO₂)与肺顺应性动态监测,指导通气调整。
共识4:在供肺通气期间,建议每2~4 h进行1次定期肺复张操作,以维持肺泡开放状态、改善肺顺应性并减少微小肺不张灶,特别是在观察到顺应性下降、气道分泌物增多或氧合波动时(弱推荐,B级证据)。
肺复张频率可根据供肺状态动态调整,需结合影像、血气和肺顺应性指标综合判断,个体化执行。肺复张可采用渐增PEEP法或短时持续气道正压通气操作,并在心肺功能稳定情况下进行。
3.2 受体相关因素
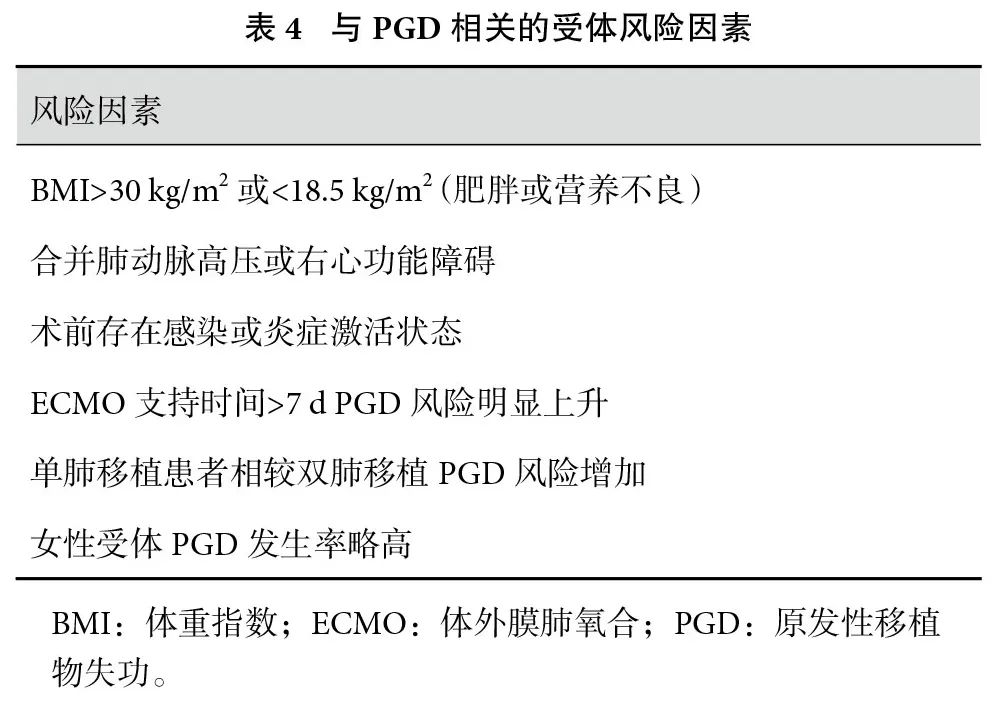
受体因素在PGD发生机制中占据重要地位,涉及术前全身状态、肺血流动力学条件及免疫激活水平等多个方面[1](表4)。
为降低PGD发生风险,临床在受体管理方面可采取以下关键措施预防PGD的发生。
共识5:优化术前营养状态:对于营养不良患者,术前通过营养支持改善免疫功能;对于肥胖患者,应控制体重、优化呼吸力学(强推荐,B级证据)。
共识6:积极控制感染与炎症状态:术前应彻底评估感染病灶并规范治疗,必要时联合抗生素、抗真菌药物;对于慢性炎症激活状态可联合使用糖皮质激素、抗炎营养等措施降低系统炎症水平(强推荐,B级证据)。
共识7:优化ECMO策略:若患者术前接受ECMO支持,应尽量避免支持时间过长(弱推荐,B级证据)。
研究[9]表明,ECMO支持超过7 d,PGD风险显著增加;特别是超过14 d,患者因持续氧化应激和肺部微循环损伤,移植后PGD发生风险将进一步升高。因此,术前应尽量缩短支持时间,并在肺功能恢复窗口期内择机行移植并关注ECMO期间血流动力学与肺氧合状态,评估肺恢复情况。
共识8:控制右心压力与肺血流动力学:术前加强右心功能评估,合理应用肺血管扩张剂,控制肺动脉压,以减轻术后再灌注压力负荷(弱推荐,C级证据)。
共识9:术前全身状态评估与康复干预:包括功能锻炼、戒烟戒酒、慢性疾病控制等,提升术后器官耐受能力;而营养不良则导致免疫功能低下、术后修复能力差(弱推荐,C级证据)。
3.3 围术期相关因素
围术期管理直接影响肺移植术后PGD的发生风险,主要涉及供肺保存、术中操作与术后初期管理等关键环节。现有研究[10]表明,围术期因素(表5)与PGD风险密切相关。

围术期应采取精准的供肺保护措施、严格的容量控制策略、肺保护性通气策略,并建立标准化的灌注与再灌注流程,以最大程度减少移植物损伤、降低PGD风险、改善术后短期与远期生存率。围术期管理应围绕以下关键环节进行精准干预。
共识10:优化低温保存时间,控制冷缺血时间,在条件允许时,考虑应用体外肺灌注(EVLP)优化边缘供体[11](强推荐,B级证据)。
共识11:采用肺保护性通气(Vt 6~8 mL/kg理想体重,平台压<30 cm H2O);PEEP维持5~8 cm H2O,防止肺不张;再灌注期间避免持续高FiO₂(推荐控制FiO₂<50%),降低氧化应激(弱推荐,C级证据)。
共识12:精确液体管理,维持适度负液体平衡;术中应用超声/血流动力学监测指导输液量,避免液体过载导致肺水肿(强推荐,B级证据)。
共识13:再灌注初期控制血流速度,逐渐增加至目标流量,避免肺毛细血管压力骤升;确保吻合部位无张力,预防血流障碍和吻合口狭窄(弱推荐,C级证据)。
共识14:在移植过程中进行支气管镜检查,必要时清除分泌物,防止肺不张及局灶感染(弱推荐,C级证据)。
3.4 术中PGD的早期诊断
PGD在肺移植术后早期的动态演变过程中,往往在术中已经有微小变化出现。
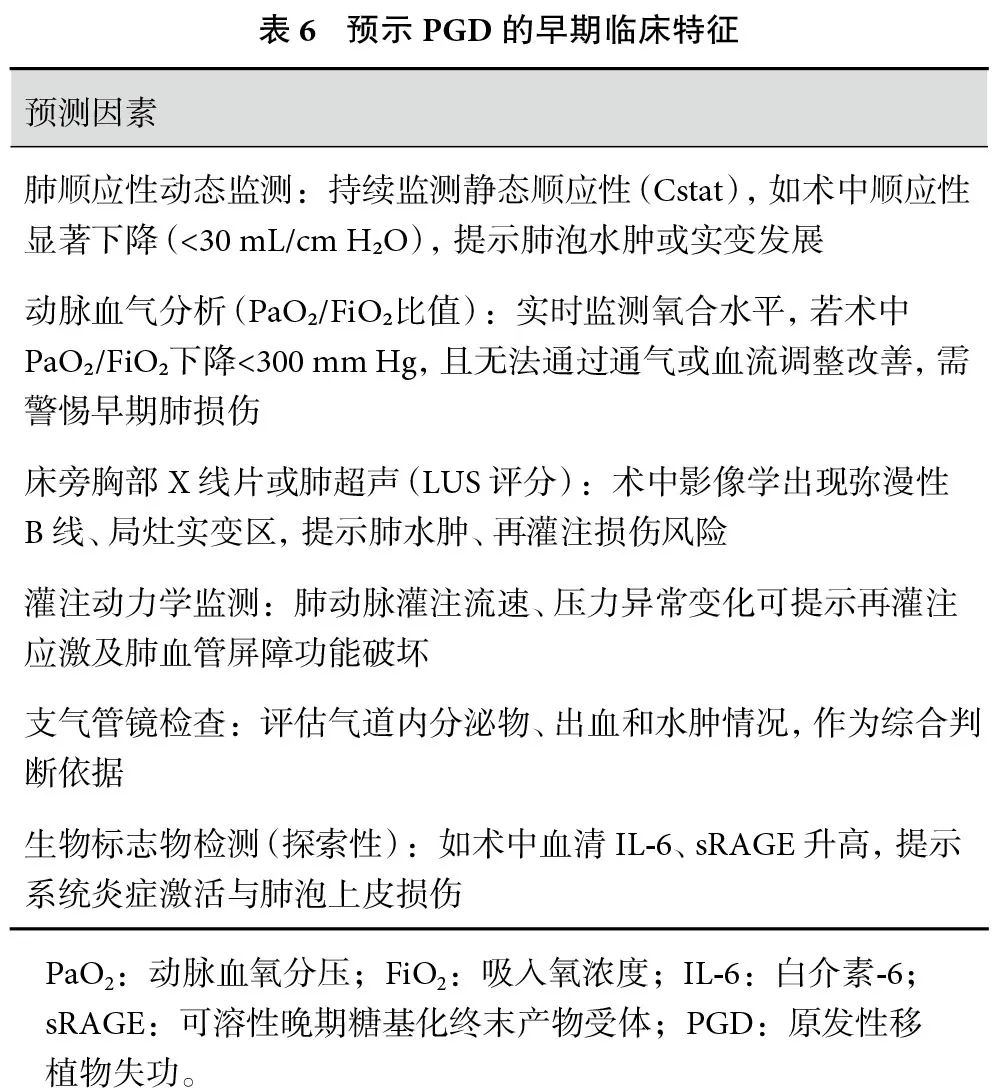
共识15:术中及时识别PGD的早期表现(表6),对于优化术中管理、降低术后重度PGD发生率具有重要意义(强推荐,B级证据)。
4 PGD治疗路径
共识16:经过术前对供体和受体风险因素的系统评估,以及肺顺应性、氧合功能、肺影像学和生物标志物等多维度动态监测,若符合PGD诊断标准,应迅速启动标准化、流程化的治疗管理体系(强推荐,B级证据)。
主要遵循如下原则:(1)早期识别、早期干预:尽量在病理、生理改变尚可逆阶段采取治疗措施。(2)分级治疗路径化:根据PGD严重程度(PGD 1~3级)制定对应的干预策略,避免过度或不足治疗。(3)多学科团队协作:包括外科、重症、麻醉、影像、康复等团队共同决策,实施路径化管理。(4)动态评估与调整:在治疗过程中,持续动态监测肺功能、氧合状态和影像学演变,及时调整治疗方案。
4.1 PGD的可逆性病因排查
在确诊PGD或出现PGD样表现前,必须排除可逆性病因(表7),包括肺动脉或静脉吻合口狭窄、容量负荷过重、左心或右心功能障碍及严重感染等[12]。对于以上可逆病因,应优先采取针对性治疗措施,避免病情进展至不可逆的重度PGD。
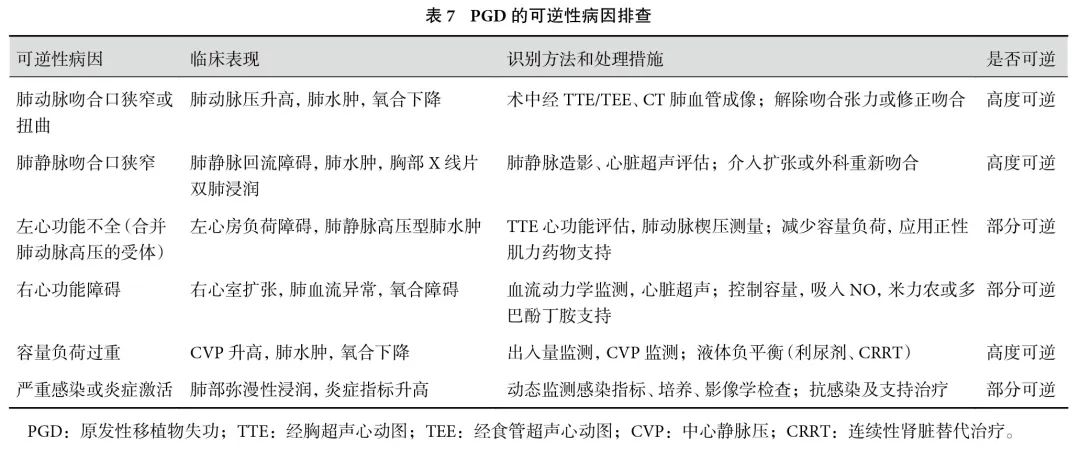
共识17:早期识别并去除病因,是优化PGD患者预后的重要策略(强推荐,B级证据)。
4.2 PGD的分级治疗
共识18:确诊PGD后应迅速分级评估,启动相应的标准化治疗流程(强推荐,B级证据)。
PGD的治疗策略应根据其严重程度(分级)进行分层管理。轻度PGD(PGD 1~2级)通常通过肺保护性通气、液体管理和氧合优化可以稳定控制,预后较好;而重度PGD(PGD 3级)则需要积极的综合干预,包括俯卧位通气、早期VV-ECMO支持及必要时的糖皮质激素冲击治疗。分级治疗路径化不仅有助于及时控制病情进展、减少肺损伤,还能提高移植物功能恢复率,改善患者长期生存率。以下分别是轻度和重度PGD的治疗方案。
4.2.1 初始干预(PGD 1~2级):
(1)启动肺保护性通气(Vt 6 mL/kg,PEEP 8~12 cm H₂O);(2)维持平台压<30 cm H₂O,驱动压<15 cm H₂O;(3)负液体平衡管理:精准监测入出量,联合使用利尿剂或CRRT;(4)经验性抗生素覆盖并动态调整;(5)每8 h重新评估氧合、影像、炎症指标。
4.2.2 强化干预(PGD 3级或氧合急剧恶化):
(1)立即启动俯卧位通气(每日12~16 h);(2)启动VV-ECMO支持,指征包括PaO₂/FiO₂<80 mm Hg(1 mm Hg=0.133 kPa),FiO₂=1.0维持>6 h无改善;(3)个体化考虑激素冲击治疗(如甲泼尼龙500 mg/d×3 d),特别是合并ARDS表现或炎症风暴时;(4)评估是否存在感染并行气道分泌物清除(气管镜吸痰、雾化吸入、生理盐水冲洗等)。
4.3 多学科定期评估、动态调整治疗
共识19:建议每天由外科、重症、呼吸、心脏、麻醉等多学科团队共同评估1次,包括氧合、肺顺应性、血流动力学、感染状态、器官功能、影像学进展,统一调整策略(强推荐,B级证据)。
动态调整的主要原则包括:以最小化肺损伤为核心:在允许范围内,尽量避免大Vt、高平台压等造成进一步机械损伤。灵活调整呼吸机参数:根据肺顺应性和氧合趋势,实时优化PEEP和Vt。液体管理动态调整:根据血流动力学、尿量、血乳酸水平,适时调整负液体平衡目标。ECMO参数灵活管理:ECMO期间动态调整血流量、气流量,根据氧合和二氧化碳清除需要实时优化。炎症风暴控制需要个体化:激素应用时机和剂量根据炎症指标、感染风险动态决策,避免盲目加大。
在PGD患者的治疗过程中,同样必须警惕因过度治疗导致的新并发症。每一次治疗调整(如呼吸机参数、液体管理、ECMO流量、激素剂量)必须依据连续动态指标变化,应始终坚持“精准调控、最小有效干预”的原则,避免以下常见问题:过度使用利尿剂或CRRT导致低血容量,引发低血压、肾功能急剧恶化、低灌注性器官损伤。过高的PEEP(>15 cm H₂O)可能导致心排量下降、右心功能受损、气压伤加剧,反而恶化氧合。过度依赖VV-ECMO高血流,增加溶血风险,血管剪切应力升高,可导致血小板减少、出血倾向、微血管栓塞。无明确指征时过早或过大剂量糖皮质激素冲击,增加重症感染、血糖失控及肌无力发生风险。
5 出院后管理与预后监测
患者即使在住院期间病情稳定后,出院后仍存在较高的CLAD发生风险[13]。因此,出院后的随访管理至关重要,应强调定期肺功能检测、影像学复查与生物标志物监测,动态评估移植物功能变化。对于有重度PGD病史或早期肺功能恢复缓慢者,应在出院后早期加强随访频率,并综合评估是否存在慢性排斥趋势或肺纤维化倾向,必要时提前介入抗纤维化治疗与免疫调控。
共识20:规范的长期监测与干预不仅有助于早期发现潜在问题、延缓CLAD进展,更能显著提升患者的生活质量,延长移植物存活时间(强推荐,B级证据)。
每1~3个月肺功能[第一秒用力呼气容积 (FEV1)、一氧化碳弥散量(DLCO)]检查1次,动态监测是否有CLAD趋势;每3~6个月胸部高分辨率计算机断层扫描(HRCT)评估纤维化、支气管狭窄等结构性改变;重点关注生物标志物波动及气体交换能力变化。
6 总结
PGD是影响肺移植术后早期及远期预后的关键并发症之一。本共识以循证医学证据为基础,结合国内外临床实践经验,系统梳理了PGD的风险因素识别、早期动态预警机制、标准化治疗路径及出院后随访管理策略。通过术前风险评估、术中多维度监测、术后流程化治疗及动态干预(图1),能够有效降低PGD的发生率和重度进展风险、改善移植物功能恢复、提高患者长期生存率。本共识旨在为临床实践提供科学、系统、可操作的指导框架,希望通过标准化管理,促进肺移植患者术后康复与长期健康生存。
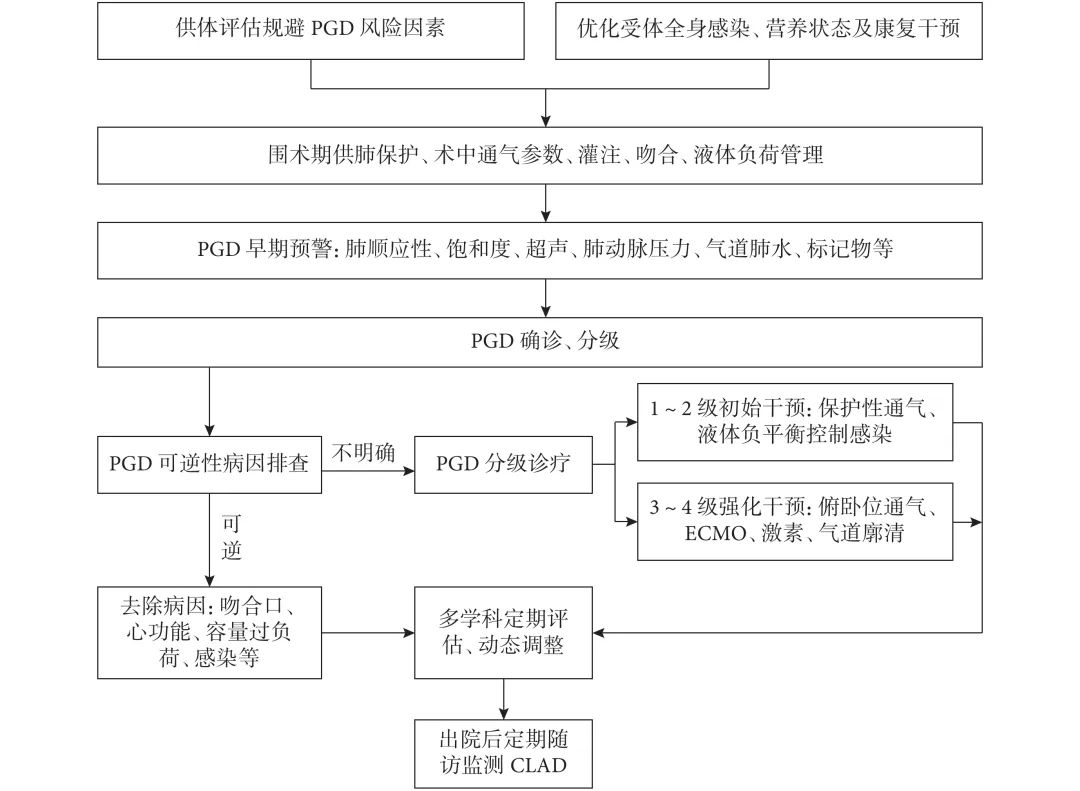
图1 PGD动态预警分级诊疗及随访流程图
PGD:原发性移植物失功;ECMO:体外膜肺氧合;CLAD:慢性肺移植物功能障碍。
利益冲突:无。
执笔:张坤鹏(同济大学附属上海市肺科医院),戴晨阳(同济大学附属上海市肺科医院),凌新宇(同济大学附属上海市肺科医院),孙长博(同济大学附属上海市肺科医院),张培(同济大学附属上海市肺科医院)
讨论和审稿专家:陈昶(同济大学附属上海市肺科医院),蔡开灿(南方医科大学南方医院),陈尔真(上海交通大学医学院附属瑞金医院),宋振举(复旦大学附属中山医院),李谦(复旦大学附属华山医院),艾静文(复旦大学附属华山医院),张晓林(上海市公共卫生临床中心),韩威力(浙江大学医学院附属第一医院),彭桂林(广州医科大学附属第一医院),王思桦(华中科技大学同济医学院附属协和医院),赵德平(同济大学附属上海市肺科医院),王海峰(同济大学附属上海市肺科医院),段亮(同济大学附属上海市肺科医院),谢冬(同济大学附属上海市肺科医院),陈乾坤(同济大学附属上海市肺科医院),何文新(同济大学附属上海市肺科医院),谢惠康(同济大学附属上海市肺科医院),韩彪(兰州大学第一附属医院),金锋(山东省公共卫生临床中心),饶栓(南方医科大学南方医院),励新健(宁波市第一医院),邵丰(南京市胸科医院),沈琦斌(湖州市中心医院),沈晓咏(华东医院),孙健(盐城市第一人民医院),谭黎杰(复旦大学附属中山医院),唐华(海军军医大学第二附属医院),王明松(上海交通大学医学院附属第九人民医院),张昊(徐州医科大学附属医院),杨明磊(中国科学院大学宁波华美医院),周永新(上海市同济医院)


