心房颤动作为临床上最常见的心律失常,显著增加患者卒中、心衰及死亡风险。全球目前有超过5000万房颤患者,随着人口老龄化进展,患者人数仍在持续攀升。心房纤维化作为房颤最主要的病理生理机制之一,一直是临床治疗的重大挑战。然而,针对心房纤维化的有效药物治疗仍然缺乏。内皮细胞作为心房与血液接触的直接界面,在心房微环境中能否作为信号传递的关键细胞,亟待深入研究。。
2025年7月8日,中国医学科学院阜外医院郑哲教授团队在国际心血管病学顶级期刊European Heart Journal发表题为“Endothelial plasticity in atrial fibrosis by integrating single-cell sequencing and genetic lineage tracing”的研究论文,首次揭示了内皮细胞通过间质激活分泌TGF-β1驱动心房纤维化的分子机制,为靶向内皮细胞治疗房颤提供了全新的理论依据和临床转化前景。

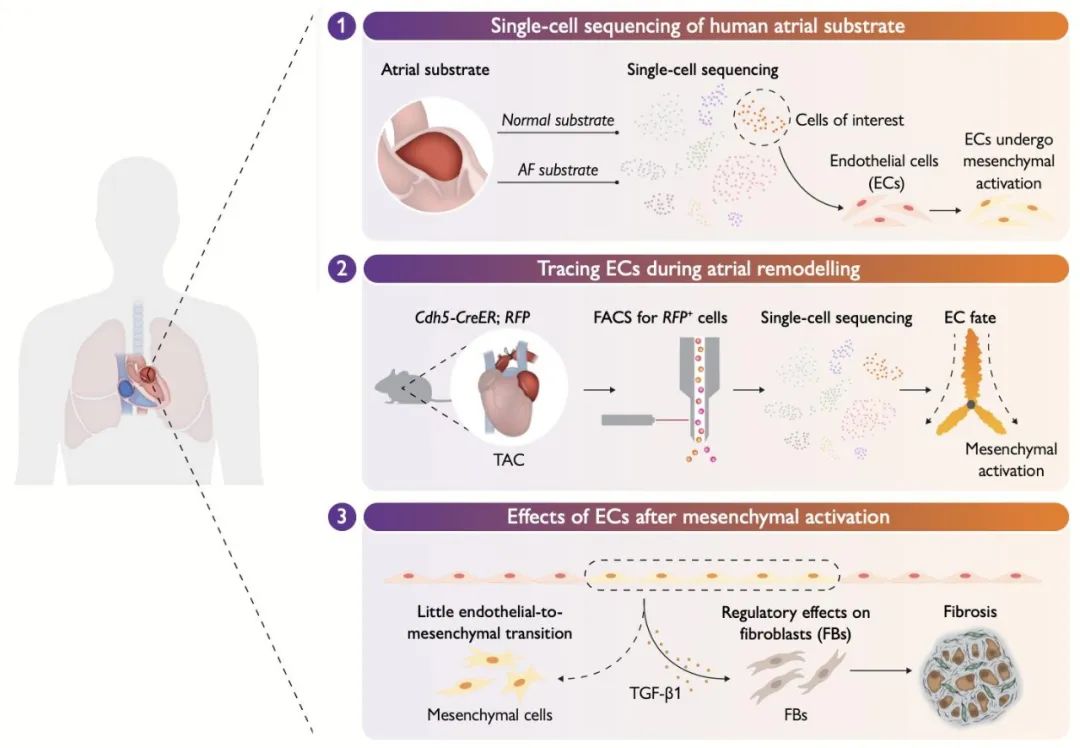
研究团队深入分析左心耳组织的单细胞转录组数据,根据细胞信号传递特征,将发送信号的细胞划分为3种模式。分析结果显示,内皮细胞所在模式的信号发送数量和强度最高,而其接收信号模式对应的相互作用对数量最少。基于这一发现,研究人员确认内皮细胞是心房组织中的主要信号发送细胞。
值得注意的是,成纤维细胞作为纤维化的主要贡献者,与内皮细胞之间存在极强的相互作用。因此,内皮细胞不仅是心房组织的信号传递枢纽,更是纤维化微环境中的关键调控细胞,与成纤维细胞共同构建了复杂而重要的信号网络。
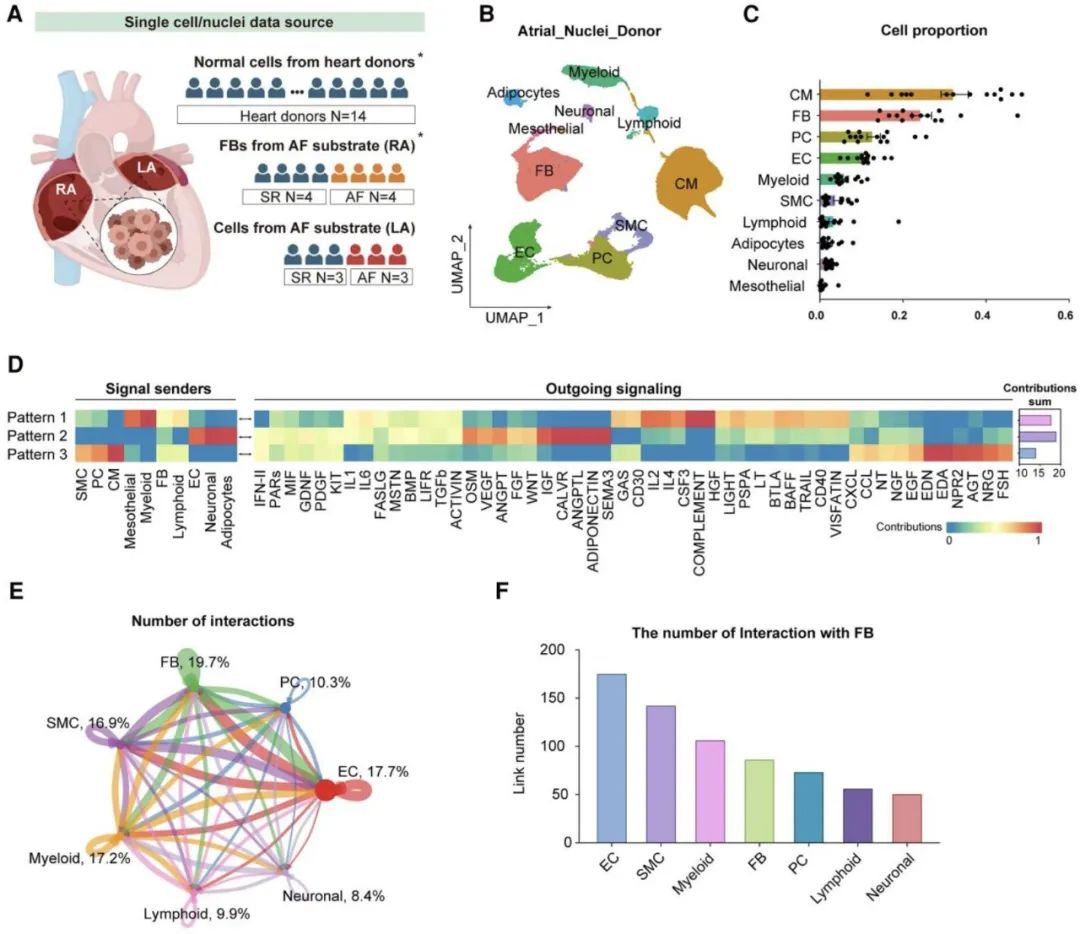
随后,研究人员在房颤患者左心耳组织中发现,内皮细胞的间质化分数显著升高,同时TGF-β1表达量同步增加。通过细胞相互作用及拟时序分析进一步揭示,在成纤维细胞活化过程中,内皮细胞与成纤维细胞的相互作用数量呈现逐渐增多的趋势。对大量房颤患者左心耳组织的病理学分析显示,心内膜下存在显著纤维化,这一现象提示内皮细胞可能通过自身转化(内皮-间质转化)或旁分泌途径参与心房纤维化的形成。
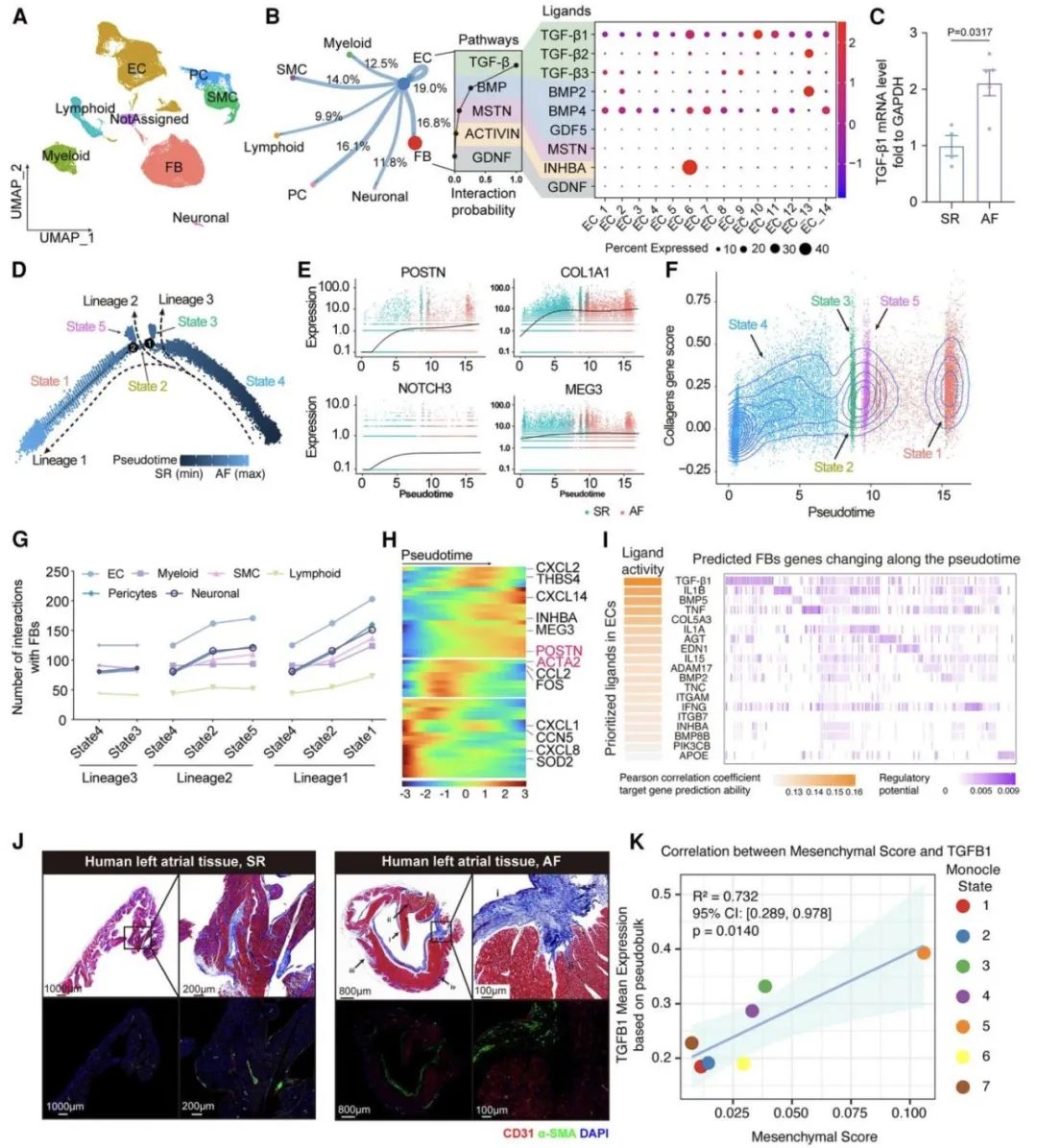
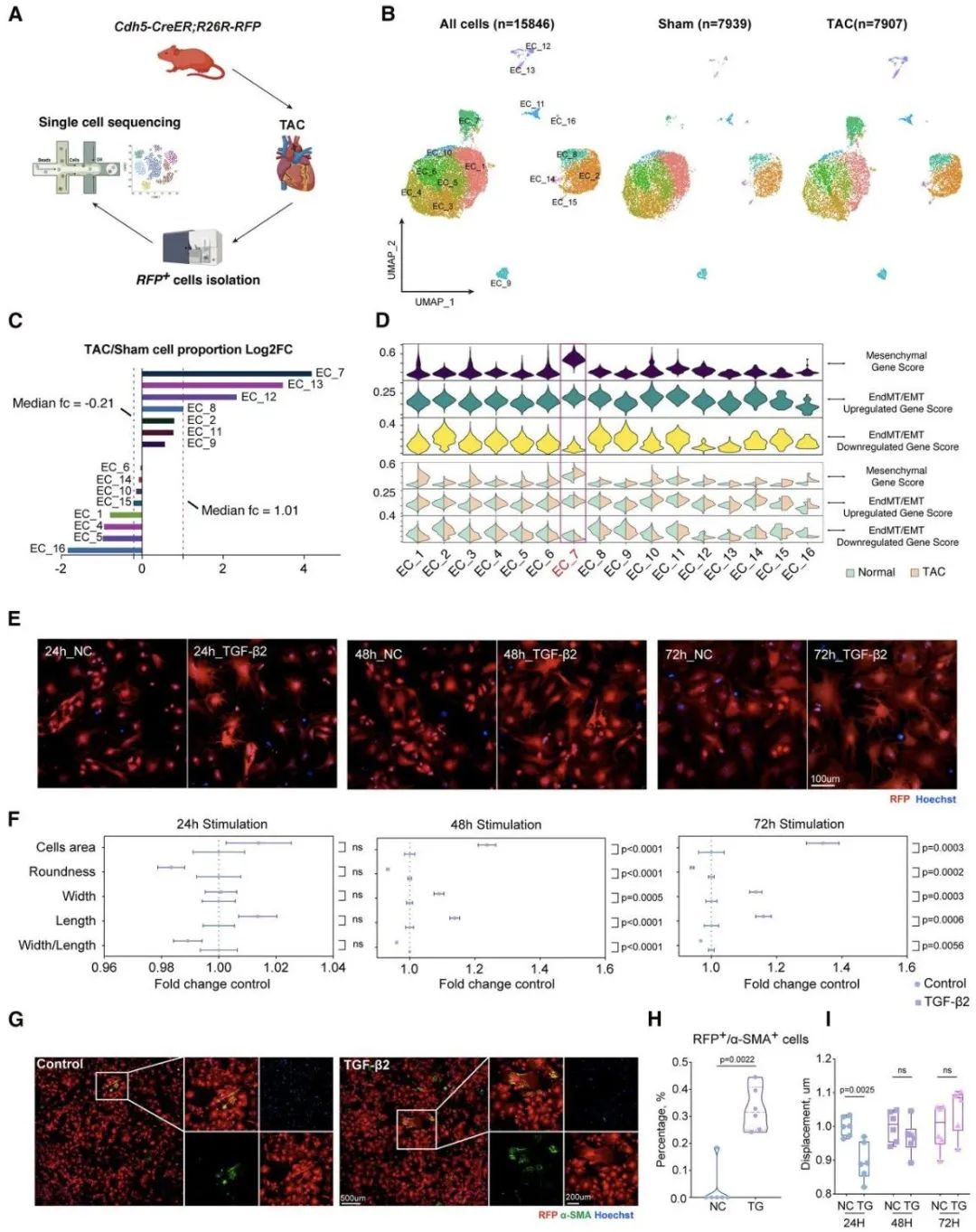
为了进一步验证上述两个猜想,研究团队首先构建了内皮细胞谱系示踪小鼠,通过流式分选获得对照组和TAC手术(主动脉缩窄术)干预后的小鼠左心耳内皮细胞。研究人员通过单细胞测序及体外细胞实验发现,尽管干预组的内皮细胞在转录层面出现间质相关基因表达升高,且形态上趋向于间质细胞,但极少完全转化为肌成纤维细胞(即极少表达α-SMA蛋白)。此外,研究人员利用大量人源及小鼠左心耳样本进行病理学分析,经三维重建显示,内皮细胞极少表达肌成纤维细胞相关蛋白。综合上述证据,研究团队认为内皮-间质转化并非心房心内膜下纤维化的主要来源。
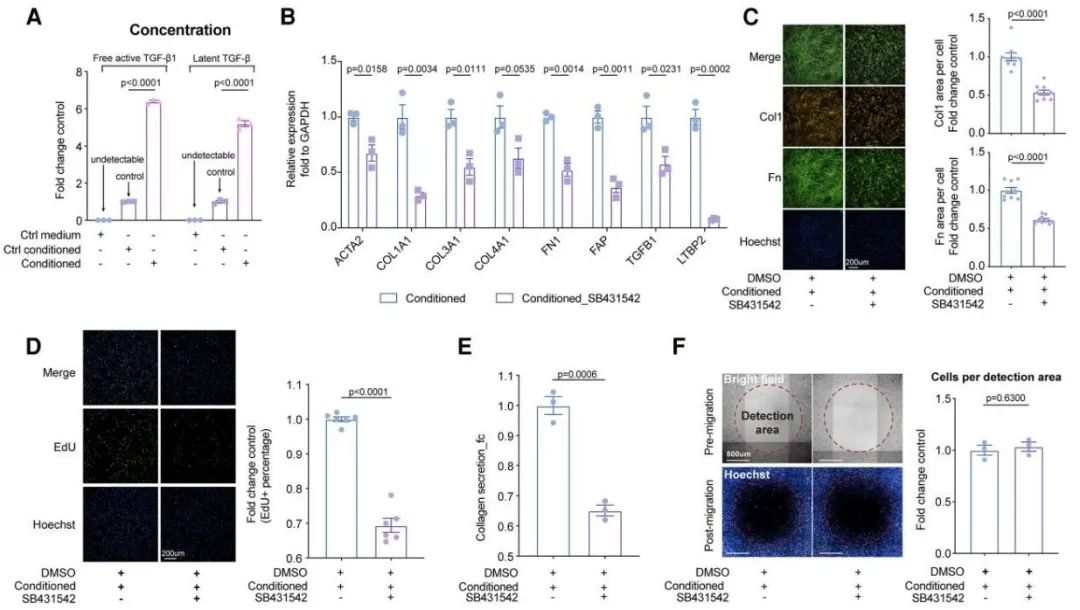
接下来,研究团队进一步分离人源左心房内皮细胞及成纤维细胞,开展两阶段验证实验。首先,研究人员用间质激活的内皮细胞条件培养基处理成纤维细胞。
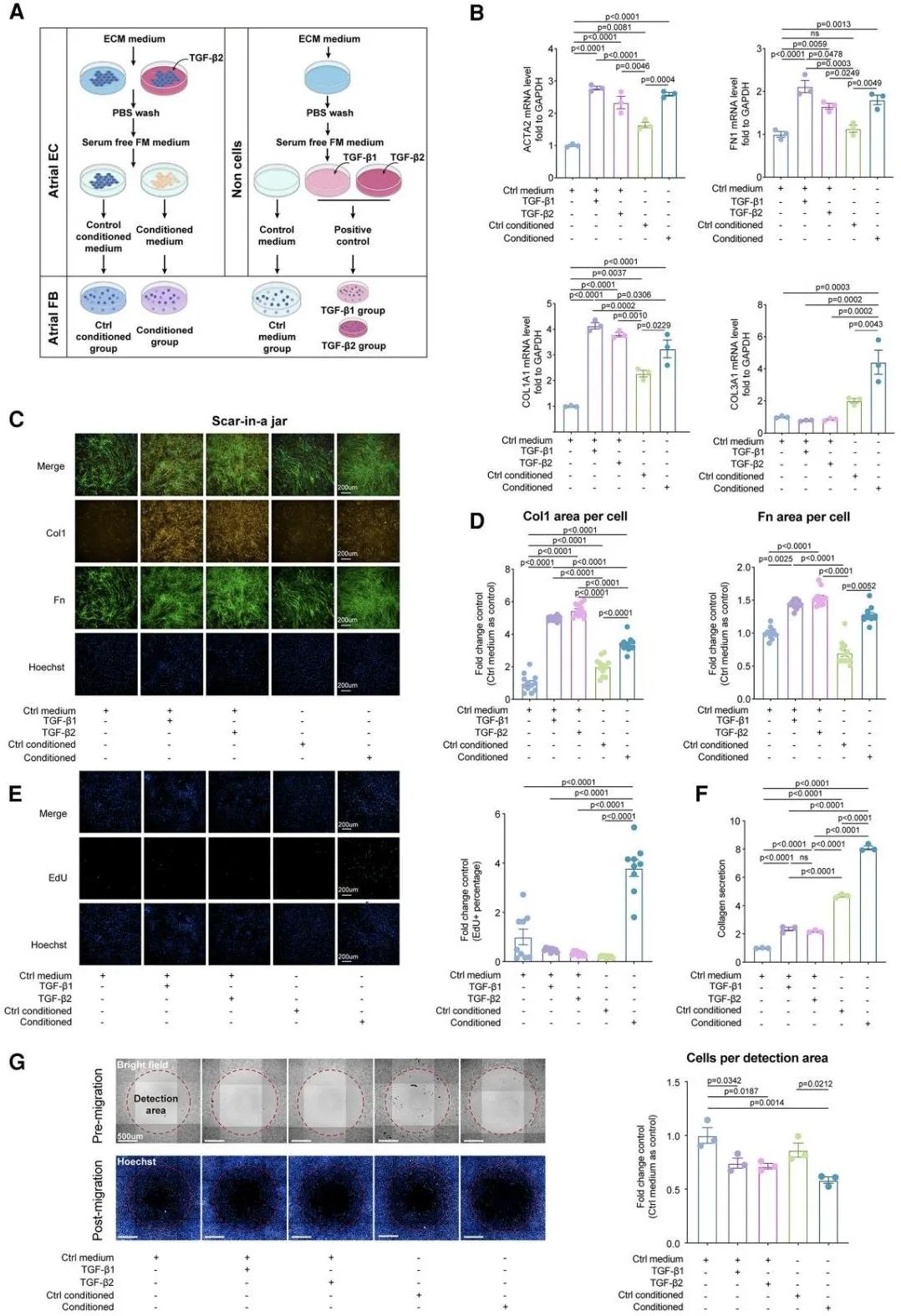
随后,使用TGF-β信号通路抑制剂干预成纤维细胞。实验结果表明,间质激活的内皮细胞能够通过旁分泌TGF-β1的方式促进成纤维细胞活化、增殖及胶原合成,从而证明了内皮细胞通过旁分泌途径参与心房纤维化的机制。
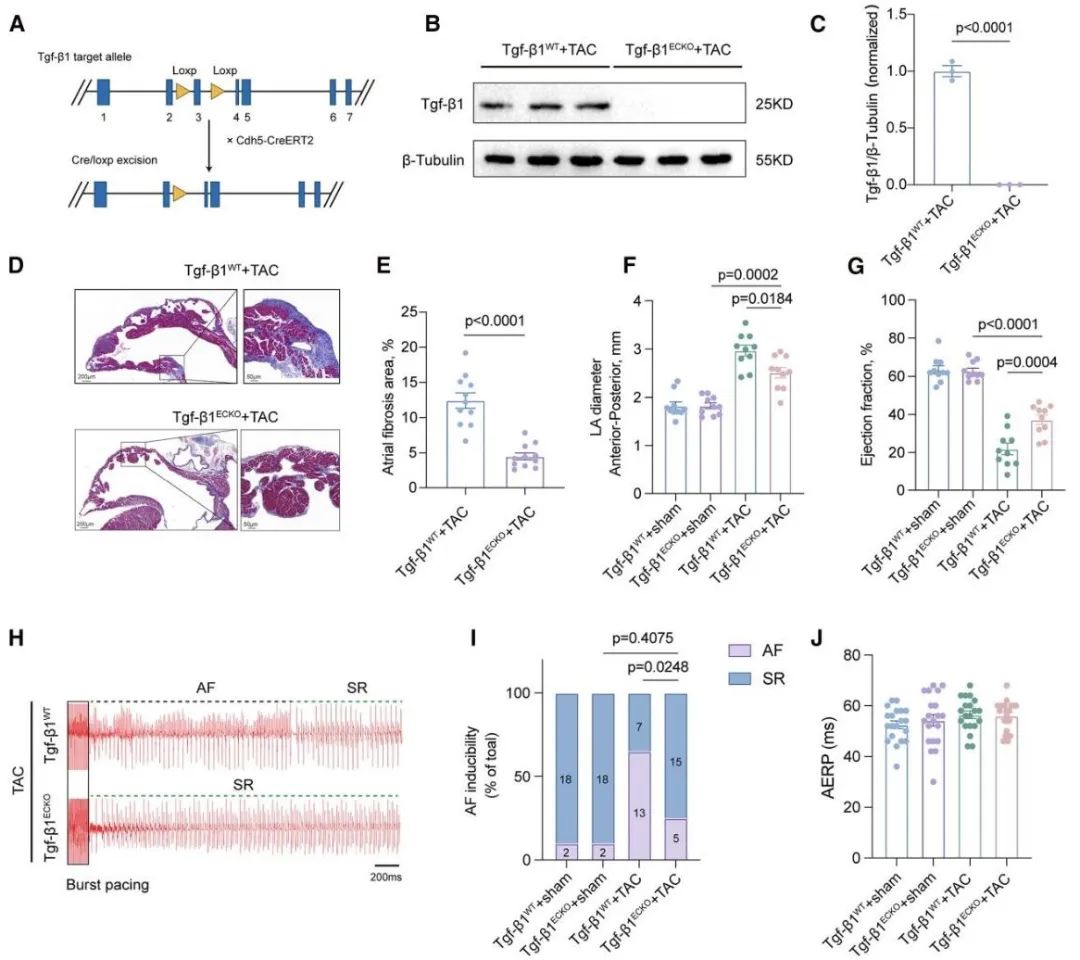
最后,研究人员建立了内皮细胞TGF-β1条件敲除小鼠模型,特异性敲除内皮细胞来源的TGF-β1。实验结果显示,与对照组相比,敲除组TAC模型小鼠左心房纤维化显著减少,房颤负荷也显著降低。
综上,本研究突破了传统内皮间质转化相关心房纤维化的认知,首次提出内皮间质激活-TGF-β1轴作为房颤治疗的新靶点。靶向内皮细胞分泌功能(而非细胞转分化)的干预策略,可能更高效且副作用更小。
中国医学科学院阜外医院郑哲教授和刘汉凝主治医师为该论文通讯作者,博士生曾志威和王小易医师为该论文共同第一作者。该研究得到了中国医学科学院创新工程、国家自然科学基金、中央高水平医院临床科研业务费及国家心血管病中心华中分中心自主课题等基金的支持。
原文链接:
https://doi.org/10.1093/eurheartj/ehaf372