低免疫原性与免疫逃逸是肿瘤免疫治疗面临的关键瓶颈。
2025年6月27日,四川大学米鹏独立通讯在Science Advances在线发表题为“Tumor-targeting nanocarriers amplified immunotherapy of cold tumors by STING activation and inhibiting immune evasion”的研究论文。该研究通过合成包含光敏剂、阳离子衍生物和巯基衍生物的多功能聚合物,构建了半乳糖修饰的干扰素基因刺激因子(STING)激动剂与程序性死亡配体1(PD-L1)小干扰RNA(siPDL1)共载纳米载体(cGAMP-siPDL1@GalNPs),旨在通过激活强效免疫应答实现低免疫原性肿瘤的协同免疫治疗。
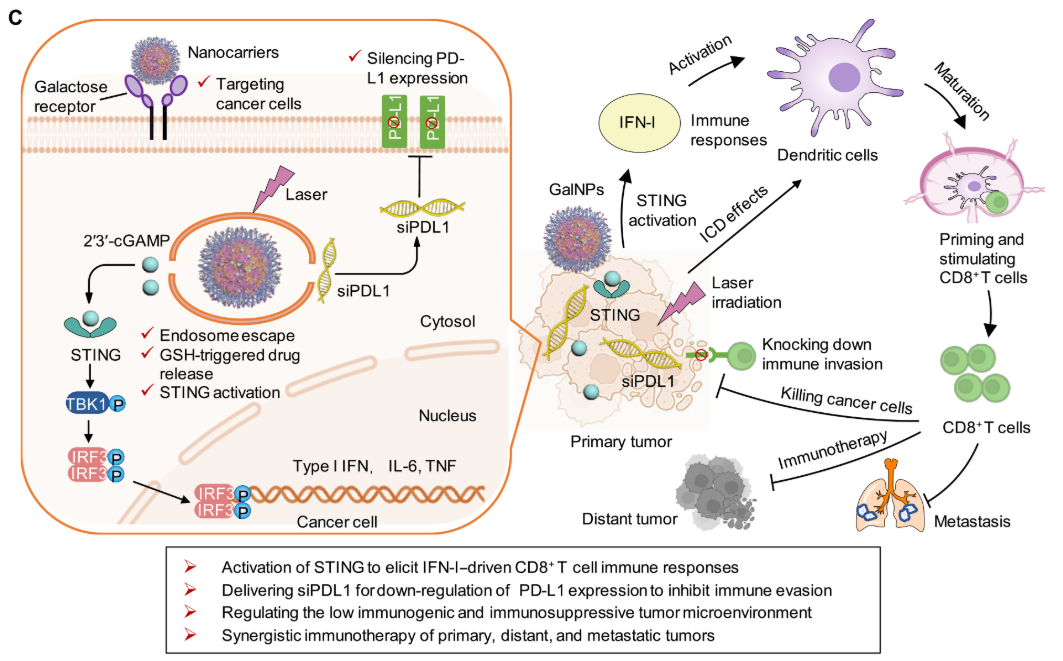
该纳米载体通过靶向半乳糖受体实现药物高效递送,并触发光/氧化还原/pH三重响应型药物释放。实验证实,cGAMP-siPDL1@GalNPs能通过激活STING通路和诱导免疫原性细胞死亡(ICD)增强抗肿瘤免疫,同时通过敲低肿瘤PD-L1表达抑制免疫逃逸,从而协同调控免疫抑制性肿瘤微环境。在激光照射下,该纳米载体可有效清除原发性黑色素瘤和原位三阴性乳腺肿瘤,并诱导ICD效应,对远端肿瘤和自发性肺转移产生协同抑制作用,显著提高生存率。本研究为开发激活抗肿瘤免疫并调控免疫侵袭的纳米载体提供了新策略。
免疫治疗作为继免疫检查点抑制剂临床应用后的重要肿瘤治疗策略已崭露头角。然而,由于肿瘤的异质性及低免疫原性肿瘤微环境(TME),仅有极少数肿瘤对免疫检查点抑制剂敏感。因此,增强强效抗肿瘤免疫应答对于免疫治疗的成功至关重要,特别是针对低免疫原性肿瘤。近期研究发现,干扰素基因刺激蛋白(STING)通路在肿瘤免疫治疗中起关键作用。STING是一种内质网(ER)蛋白,在肿瘤细胞和免疫细胞中均有表达,可被STING激动剂激活。当STING从内质网转运至高尔基体后,会激活TANK结合激酶1(TBK1)和IκB激酶,进而分别激活转录因子干扰素调节因子3(IRF3)和核因子κB。这些转录因子随后入核诱导I型干扰素(IFN-I)及肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)等细胞因子的表达,这些因子可直接杀伤肿瘤细胞或间接增强抗肿瘤免疫。
值得注意的是,多类细胞中STING的激活均可提升癌症免疫治疗效果。抗原呈递细胞(APCs)(如树突状细胞(DCs))中的STING激活可触发DC熟化,促进APCs与细胞毒性T淋巴细胞(CTLs)的交互作用,并增强抗肿瘤T细胞应答。STING激动剂还能将M2型巨噬细胞重编程为M1型抗肿瘤巨噬细胞。此外,选择性激活肿瘤细胞中的STING可产生趋化因子和细胞因子,从而招募肿瘤浸润淋巴细胞、启动CTLs,并使原本"冷"(低免疫原性)的肿瘤对免疫检查点阻断治疗敏感化。STING在肿瘤内皮细胞中的激活还能破坏异常血管结构以增加药物在肿瘤中的蓄积。目前已有多种化合物作为STING激活剂被研究,包括内源性高亲和力配体2',3'-环鸟苷酸-腺苷酸(cGAMP)。但这些化合物普遍存在易降解、细胞摄取率低、胞内转运效率差及肿瘤蓄积不足等问题,导致抗肿瘤免疫效果不佳并可能引发副作用。因此,开发递送STING激动剂的纳米载体对于选择性激活STING通路、增强天然免疫应答及减少副作用至关重要。
模式流程图(图片源自Science Advances)
STING激动剂在刺激CD8+ T细胞等抗肿瘤免疫因子的同时,也会上调肿瘤细胞程序性死亡配体1(PD-L1)的表达,这必然削弱活化CD8+ T细胞的效应并导致肿瘤细胞免疫逃逸。因此,将STING激动剂与PD-L1阻断联用是提高免疫治疗效果的必然选择。尽管抗PD-L1抗体(aPD-L1)是癌症免疫治疗的常规用药,但其存在扩散性差、肿瘤渗透率低及可能引发致命性心肌炎、结肠炎、白癜风等免疫相关不良事件的问题。此外,aPD-L1仅能阻断细胞膜上的PD-L1,而肿瘤细胞可持续表达该蛋白进行代偿。因此,通过RNA干扰(RNAi)敲低PD-L1是更具潜力的替代策略。aPD-L1仅对少数"热"肿瘤敏感,对冷肿瘤无效,需联合STING激动剂等方案激活抗肿瘤免疫应答。然而,RNAi与STING激活的联合疗法尚未得到充分研究。加之小干扰RNA(siRNAs)易被核糖核酸酶降解、难以进入肿瘤细胞并在肿瘤部位蓄积,因此开发基于可靠基因载体的siRNA递送策略对联合免疫治疗至关重要。
聚合物纳米载体通常由嵌段共聚物自组装而成,在递送siRNAs和抗癌药物等生物活性化合物方面具有显著优势,可提高疗效并减少副作用。纳米硒(Nanoxel)和杰尼索尔-PM(Genexol-PM)等聚合物纳米载体的成功临床转化,进一步推动了该领域的发展。特别是含阳离子片段的聚合物纳米载体,可通过与带负电的核酸相互作用,经内体逃逸机制将其递送至肿瘤细胞,实现基因表达调控或蛋白敲除。但多数离子复合物在生理条件下不稳定,需进一步优化。目前已有多种改进策略,包括:在纳米载体表面修饰配体实现主动靶向;设计刺激响应型载体实现可控释放;以及激光辐照介导内体逃逸。但如何实现基因与药物的稳定包载、高效递送至靶细胞并产生预期免疫效应,仍是当前面临的主要挑战。
本研究通过合成含光敏剂、阳离子链和巯基侧链的多功能三嵌段共聚物,构建了半乳糖修饰的cGAMP/siPDL1共载纳米粒(cGAMP-siPDL1@GalNPs)。该体系通过STING的特异性激活、免疫原性细胞死亡(ICD)效应及PD-L1表达沉默的协同作用,可同时增强免疫应答并抑制免疫逃逸,从而显著提升对低免疫原性肿瘤的治疗效果。该纳米载体以二硫键交联为核心,通过半乳糖受体实现肿瘤靶向,并借助pH响应型阳离子聚合物和光敏剂的光化学内化(PCI)效应实现高效的胞质递送。氧化还原响应释放的cGAMP可激活STING通路产生分泌干扰素-γ(IFN-γ)的CD8+ T细胞(IFN-γ+CD8+ T细胞)等多种免疫效应因子;siPDL1能敲低肿瘤细胞PD-L1表达;而光敏剂可通过肿瘤光动力治疗(PDT)诱导ICD。这些协同作用可有效清除原发灶、远端及转移性肿瘤,并抑制免疫逃逸。本研究开发的多功能纳米载体能高效递送免疫治疗药物,通过协同激活抗肿瘤免疫和阻断逃逸机制,为低免疫原性肿瘤提供了新型治疗策略。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adr1728