摘 要
目的 探讨脑脊液集落刺激因子1受体(colony stimulating factor 1 receptor, CSF1R)与阿尔茨海默病(Alzheimer disease,AD)脑脊液生物标志物的关系,并分析CSF1R是否与轻度认知障碍患者的认知相关。
方法 从阿尔茨海默病神经影像计划数据库中收集非痴呆成人的数据,根据NIA-AA标准将参与者分为4组(A-/TN-组、A+/TN-组、A+/TN+组和A-/TN+组),追踪AD不同病理阶段脑脊液CSF1R的动态变化。采用多元线性回归模型分析CSF1R与AD生物标志物和认知的关系,并利用中介模型研究CSF1R与AD病理的潜在关联。
结果 本研究共纳入451例非痴呆成人,与A+/TN-组相比,A-/TN+组(P<0.05)和A+/TN+组(P<0.05)脑脊液CSF1R水平增加。脑脊液CSF1R水平与脑脊液tau蛋白(P<0.001)、磷酸化的tau蛋白(P<0.001)水平呈显著正相关,而与β淀粉样蛋白无相关性(P=0.123),在认知正常组和轻度认知障碍组中也得到类似的结果。在轻度认知障碍组中,较高的脑脊液CSF1R水平与较低的认知水平相关(P<0.05)。此外,CSF1R和AD病理的关系部分由可溶性髓样细胞触发受体2(sTREM2)介导(19.3%~31.4%)。
结论 本研究首次发现了CSF1R与AD生物标志物和认知存在关联,CSF1R可能通过sTREM2影响AD病理。
关键词
集落刺激因子1受体;阿尔茨海默病;神经炎症;小胶质细胞;可溶性髓样细胞触发受体2
阿尔茨海默病(Alzheimer disease, AD)是一种常见的老年神经退行性疾病,也是最常见的痴呆类型,其病理特征是β淀粉样蛋白(amyloid β,Aβ)沉积和tau蛋白的过度磷酸化(phosphorylated-tau, P-tau),继而形成神经原纤维缠结。然而,这些病理变化可能在认知功能下降出现之前10年或更长时间就已经发生了[1-2]。既往的研究已经表明,小胶质细胞是引起AD神经炎症的主要免疫细胞。小胶质细胞的慢性激活是以神经炎症为特征的神经退行性疾病如阿尔茨海默病的常见病理学特征[3]。
集落刺激因子1受体(colony stimulating factor 1 receptor, CSF1R)属于Ⅲ型蛋白酪氨酸激酶受体家族,在中枢神经系统中主要由小胶质细胞表达,调节小胶质细胞的发育与稳态维持[4-5]。在阿尔茨海默病患者死后的尸检样本中发现表达上调的CSF1R和大量活化的小胶质细胞[6]。髓样细胞触发受体2(triggering receptor expressed on myeloid cells 2, TREM2)是一种跨膜受体,在中枢神经系统中主要由小胶质细胞表达[7-8]。TREM2 在小胶质细胞活化、存活和吞噬作用中起关键作用[9],其裂解物可溶性TREM2(soluble TREM2,sTREM2)主要释放到脑脊液(cerebrospinal fluid, CSF)中,CSF sTREM2的水平反映中枢神经系统小胶质细胞的活性,是一种潜在的神经炎症生物标志物[10-11]。
迄今为止,CSF1R影响阿尔茨海默病病理的过程尚不清楚。本研究旨在从阿尔茨海默病神经影像计划(Alzheimer’s Disease Neuroimaging Initiative, ADNI)数据库中提取CSF1R的数据,以研究CSF1R与AD病理、sTREM2、认知的关联,探讨CSF1R与AD病理的关系是否由sTREM2介导,以更好地了解疾病的早期阶段的特征[12-13]。
1 对象与方法
1.1 研究对象 本研究的研究对象来自ADNI数据库。ADNI项目是一项多中心纵向研究,于2004年启动,包括用于阿尔茨海默病早期诊断和随访的临床、影像、遗传和生物标志物。详细的入选标准和排除标准可在ADNI网站(www.adni-info.org)上查阅。ADNI由所有参与机构的机构审查委员会批准。所有参与者均签署书面知情同意书。
在ADNI数据库中,共有735名参与者接受了CSF CSF1R检测,其协变量数据(年龄、性别、受教育年限和APOE4基因型)可用。没有可用CSF CSF1R数据的35名参与者被排除,基线时诊断为AD的137 名参与者也被排除,112名没有CSF AD生物标志物的参与者和数据超出标准差(SD)3倍的参与者也被排除。最终,这项横断面研究共纳入了451人。
1.2 研究方法
1.2.1 一般资料收集
收集参与者的一般资料,包括年龄、性别、受教育年限、APOE4携带状态。
1.2.2 脑脊液生物标志物的测量
参与者均具有可用的脑脊液Aβ42、T-tau、P-tau、sTREM2、CSF1R等信息。在ADNI数据库中,采用Luminex xMAP技术和INNO-BIA AlzBio3免疫检测试剂盒检测脑脊液中聚集的Aβ(Aβ42)、聚集的P-tau和总tau(total-tau,T-tau)的水平;此外,本研究通过使用T-tau/Aβ42的比值和P-tau/Aβ42的比值反映AD病理学的变化[14]。采用SomaScan 7k平台检测脑脊液CSF1R水平,通过SomaLogic进行归一化;采用MSD平台测量脑脊液sTREM2的水平。
1.2.3 认知评估
本研究使用5种认知量表评估纳入人群的认知水平,包括简易精神状况检查量表(MMSE)、蒙特利尔认知评估量表(MoCA)、阿尔茨海默病评估量表(ADAS)[15]、ADNI记忆功能综合评分量表(ADNI-MEM)和Rey听觉言语学习测试 即时回忆量表(RAVLT immediate)。其中,ADAS量表得分越高,认知表现越差。相反,MMSE、MoCA、ADNI-MEM和RAVLT immediate量表得分越高,认知表现越好。
1.2.4 ATN框架
根据2018年美国国家老龄化研究所和阿尔茨海默病协会(National Institute of Aging and Alzheimer’s Association, NIA-AA)提出的阿尔茨海默病研究框架,将AD生物标志物分为ATN三类[16],“A”代指Aβ沉积(Aβ42),“T”代指磷酸化的tau(P-tau),“N”代指神经退行性变(T-tau)。根据AD生物标志物的截断值将其定义为正常(-)或异常(+)。将异常脑脊液生物标志物定义为Aβ42<976.6 pg/mL的个体为“A+”,P-tau>21.8 pg/mL的个体为“T+”,T-tau>245 pg/mL的个体为“N+”。由于CSF P-tau和CSF T-tau高度相关,本研究限制了比较组的数量,将P-tau和T-tau组合并为“TN”。“TN-”指的是P-tau和T-tau水平低于截断值的个体,而“TN+”指的是P-tau或T-tau水平高于截断值的个体。
1.2.5 中介模型
本研究根据Baron和Kenny的方法[17]进行中介分析,以探讨sTREM2是否介导CSF1R与脑脊液生物标志物之间的关系。建立中介效应必须满足以下条件:①CSF1R水平与脑脊液生物标志物相关;②CSF1R水平与sTREM2相关;③脑脊液生物标志物与sTREM2相关;④回归模型中加入sTREM2后,CSF1R与脑脊液生物标志物的相关性减弱。
1.3 统计学方法 本研究使用Shapiro-Wilk检验来评估连续变量是否符合正态分布。对于符合正态分布或近似正态分布的连续变量,用均数±标准差( ±s)表示,而不符合正态分布的变量则采用中位数及上下四分位数表示;分类变量则以例数(n)和百分比(%)来表示。为确保结果的可靠性,排除了高于或低于均数±3倍标准差的异常值,将脑脊液生物标志物数据均进行log10转化,并进一步标准化处理。组间比较方面,对于连续变量,使用t检验、单因素方差分析或Mann-Whitney U检验,而对于分类变量,则采用χ2检验进行分析。使用多元线性回归模型来评估脑脊液CSF1R与脑脊液生物标志物和认知的关联。上述所有的分析均将年龄、性别、受教育年限和APOE4携带状态作为协变量进行调整。检验水准α=0.05。
±s)表示,而不符合正态分布的变量则采用中位数及上下四分位数表示;分类变量则以例数(n)和百分比(%)来表示。为确保结果的可靠性,排除了高于或低于均数±3倍标准差的异常值,将脑脊液生物标志物数据均进行log10转化,并进一步标准化处理。组间比较方面,对于连续变量,使用t检验、单因素方差分析或Mann-Whitney U检验,而对于分类变量,则采用χ2检验进行分析。使用多元线性回归模型来评估脑脊液CSF1R与脑脊液生物标志物和认知的关联。上述所有的分析均将年龄、性别、受教育年限和APOE4携带状态作为协变量进行调整。检验水准α=0.05。
2 结果
2.1 纳入人群的基本特征 本研究总共纳入了来自ADNI数据库的451名非痴呆成人,其中包含116名认知正常(cognitively normal, CN)组和335名轻度认知障碍(mild cognitive impairment, MCI)组的参与者。在本研究中,参与者的年龄40~90岁[平均年龄为(73.14±7.21)岁],女性占总人群的41.5%,APOE4阳性率为50.1%。在MCI组中,APOE4阳性人群的比例显著高于CN组。而在脑脊液生物标志物方面,与CN组相比,MCI组有较高的T-tau、P-tau、T-tau/Aβ42和P-tau/Aβ42水平,而Aβ42水平较低。本研究也发现,两组在认知测试方面差异具有统计学意义(P<0.001)。见表1。
Tab.1 Basic characteristics of the participating population
表1 参与人群的基本特征
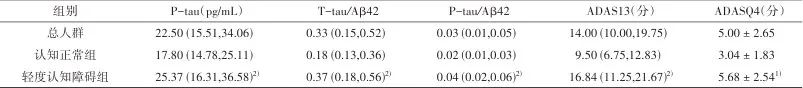
注:CSF1R,集落刺激因子1受体;sTREM2,可溶性髓样细胞触发受体2;Aβ42,β淀粉样蛋白42;T-tau,总tau蛋白;P-tau,磷酸化tau;ADAS,阿尔茨海默病评估量表;MMSE,简易精神状况检查量表;MoCA,蒙特利尔认知评估量表;RAVLT immediate,Rey听觉言语学习测试即时回忆量表;ADNI-MEM,ADNI记忆功能综合评分量表。1)轻度认知障碍组与认知正常组相比,经t检验,P<0.05;2)轻度认知障碍组与认知正常组相比,经Mann-Whitney U检验,P<0.05;3)轻度认知障碍组与认知正常组相比,经χ2检验,P<0.05。
2.2 不同生物标志物分组之间CSF CSF1R水平的差异 本研究使用ATN分类框架来评估CSF1R变化与Aβ沉积和下游淀粉样蛋白级联反应过程(即tau病理和神经退行性变)的关联,将不同诊断组的参与者分别分到4种不同的生物标志物谱中(A-/TN-、A-/TN+、A+/TN+和A+/TN-)。研究结果显示,在每个诊断组中,A+/TN-组的CSF1R水平均处于最低水平(见图1A、E、I)。与A+/TN-组相比,A-/TN+组和A+/TN+组CSF1R的水平显著升高。因此,本研究推断CSF1R水平升高与T-tau和P-tau有关。与T-亚组和N-亚组相比,T+亚组和N+亚组的CSF1R水平较高(P<0.001)(见图1B~D、F~H、J~L),以上结果表明CSF1R水平的增加可能是对tau病理学或神经退行性变的反应。
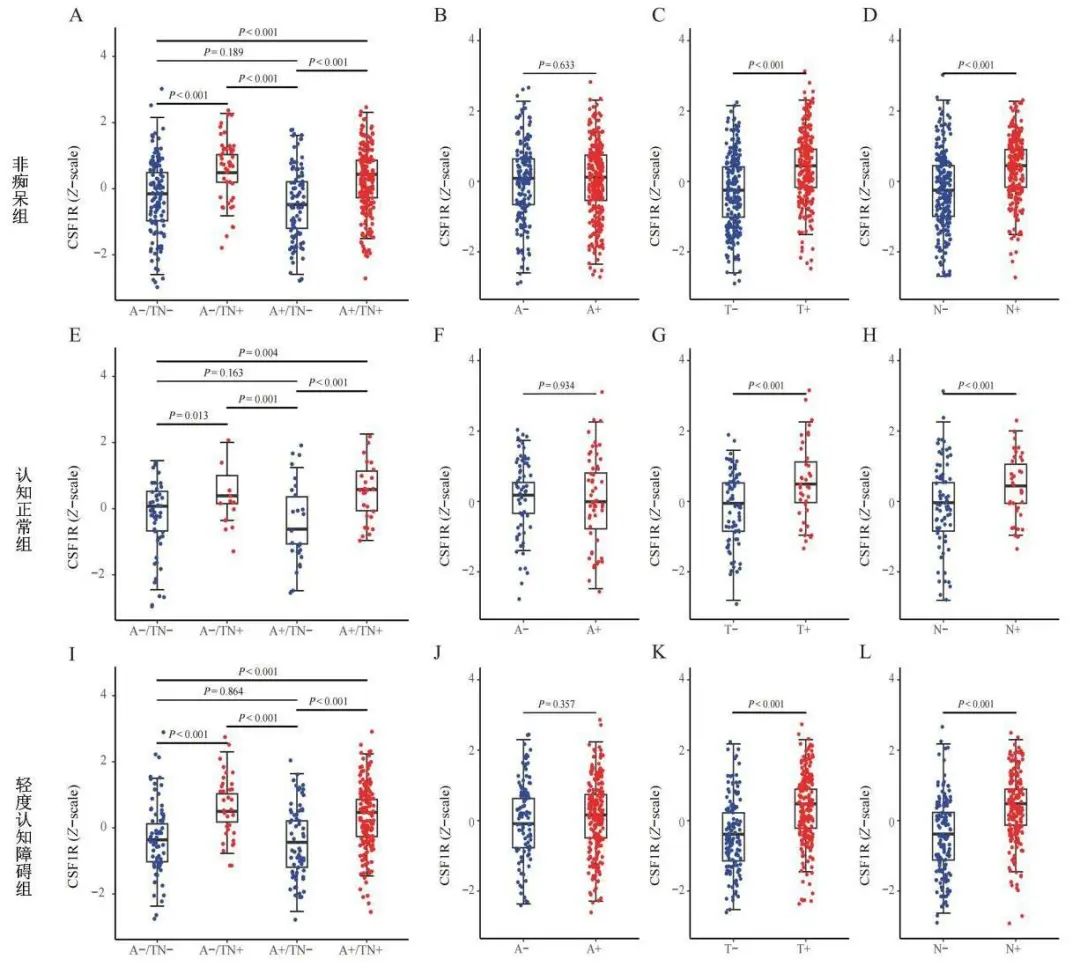
Fig.1 Levels of CSF1R in the ATN classification framework for different diagnostic groups
图1 不同诊断组ATN分类框架中CSF1R的水平 CSF1R,集落刺激因子1受体。
2.3 CSF1R与CSF AD生物标志物和认知的关系 在CN组和MCI组中,CSF CSF1R水平升高与T-tau和P-tau水平升高相关(见图2)。此外,CSF1R的水平也与T-tau/Aβ42和P-tau/Aβ42的水平呈显著正相关(见图2)。然而,本研究未发现CSF1R与Aβ42之间的相关性,这与之前文章的结果一致[18]。非痴呆人群的研究结果与上述结果一致。在认知方面,MCI组CSF1R水平升高与MMSE(P=0.042)、MoCA(P=0.008)、RAVLT immediate(P=0.037)和ADNI-MEM(P=0.014)得分降低有关,而与ADAS13(P=0.036)和ADASQ4(P=0.007)得分升高有关(见图3)。然而,在非痴呆组和CN组中未发现CSF CSF1R与认知的相关性。
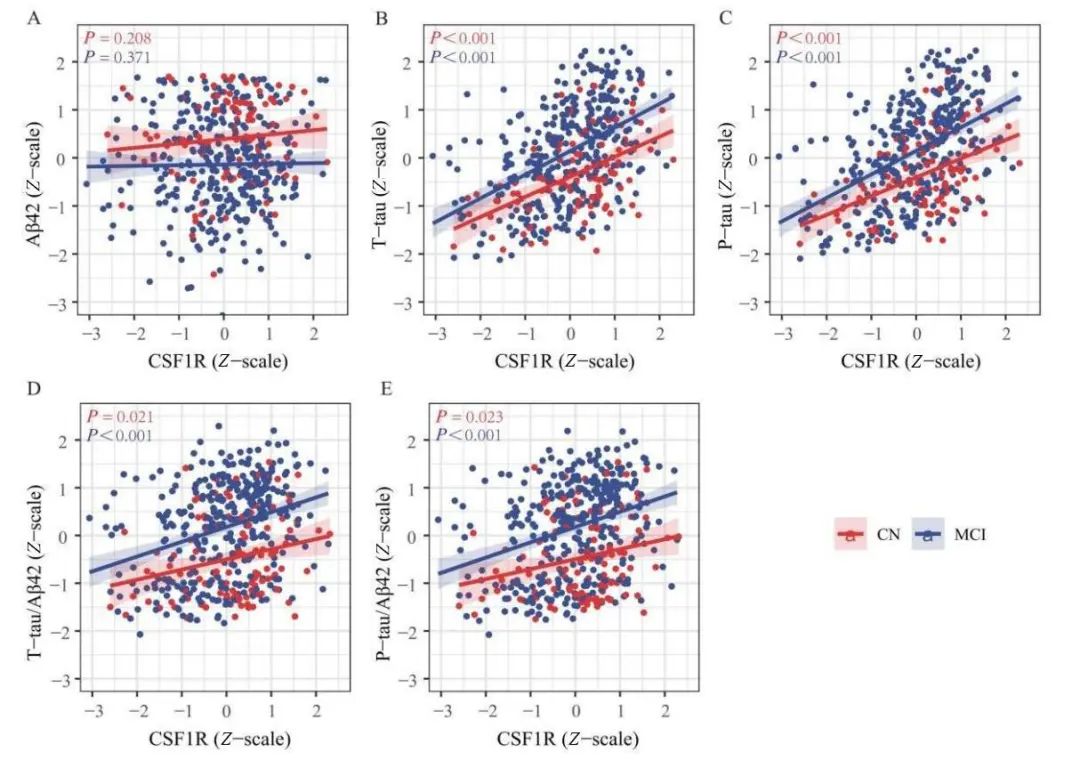
Fig.2 Correlation of cerebrospinal fluid CSF1R and cerebrospinal fluid AD biomarkers in different diagnostic groups
图2 不同诊断组脑脊液CSF1R和脑脊液AD生物标志物的相关性 CN,认知正常;MCI,轻度认知障碍;AD,阿尔茨海默病;CSF1R,集落刺激因子1受体;Aβ42,β淀粉样蛋白42;T-tau,总tau蛋白;P-tau,磷酸化tau蛋白。图中校正了年龄、性别、教育年限和APOE4携带状态。
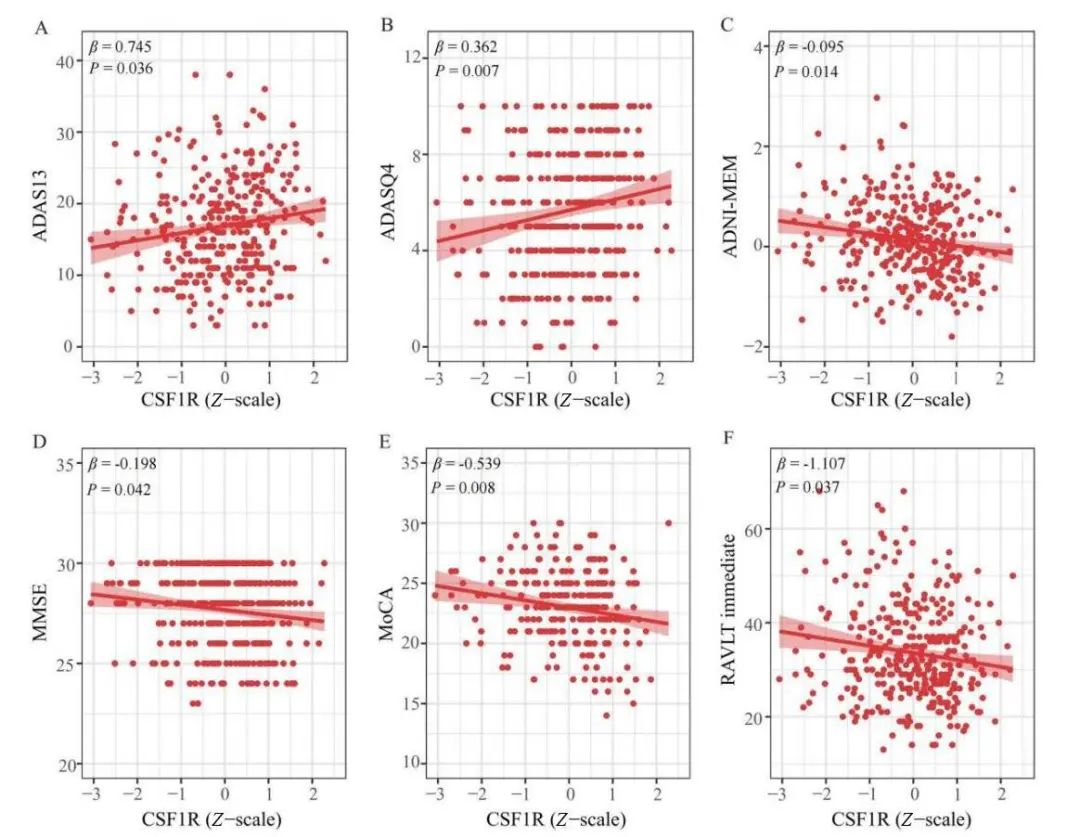
Fig.3 Association between cerebrospinal fluid CSF1R and cognition in the mild cognitive impairment group
图3 轻度认知障碍组脑脊液CSF1R与认知的关联 CSF1R,集落刺激因子1受体;ADAS,阿尔茨海默病评估量表;MMSE,简易精神状况检查量表;MoCA,蒙特利尔认知评估量表;RAVLT immediate,Rey听觉言语学习测试 即时回忆量表;ADNI-MEM,ADNI记忆功能综合评分量表。图中校正了年龄、性别、教育年限和APOE4携带状态。
2.4 中介分析 sTREM2对AD生物标志物的直接、间接和总效应均有统计学意义(P<0.05),提示CSF CSF1R与T-tau、P-tau、T-tau/Aβ42和P-tau/Aβ42之间的关系部分由sTREM2介导(见图4),中介比例为19.3%~31.4%。高水平的CSF1R与高水平的AD病理显著相关,CSF1R通过影响sTREM2的水平间接影响AD病理。由于本研究中Aβ42与CSF1R没有相关性,未将Aβ42纳入中介分析。
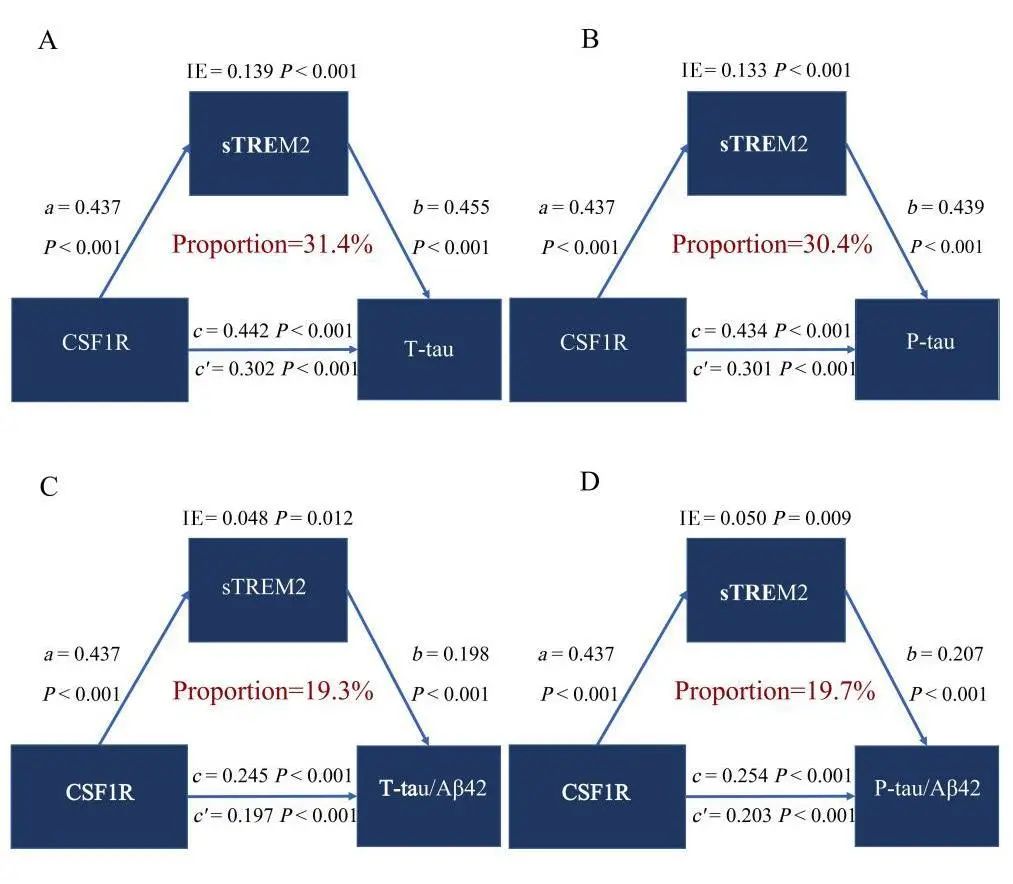
Fig.4 Mediation analysis of sTREM2 between CSF1R and AD biomarkers in cerebrospinal fluid
图4 sTREM2在脑脊液CSF1R与AD生物标志物之间的中介分析 sTREM2,可溶性髓样细胞触发受体2 ;CSF1R,集落刺激因子1受体;Aβ42,β淀粉样蛋白42;T-tau,总tau蛋白;P-tau,磷酸化tau蛋白;IE,总效应;AD,阿尔茨海默病。图中校正了年龄、性别、教育年限和APOE4携带状态。
3 讨论
小胶质细胞的增殖是神经系统退行性疾病(如阿尔茨海默病)进展的重要机制。大脑内小胶质细胞的存活依赖于CSF1R信号转导,CSF1R是促进小胶质细胞增殖和分泌神经炎症因子的重要调节因子,如果抑制该受体,几乎所有的小胶质细胞在中枢神经系统中都将被消除[18-19]。
本研究首次探索了非痴呆人群CSF1R与AD脑脊液生物标志物和认知的关联,并且发现CSF1R 与AD病理的关系可由sTREM2部分介导。基于ATN分类方案评估了AD早期脑脊液CSF1R水平的动态变化。动物研究表明,使用CSF1R抑制剂耗竭P301S小鼠小胶质细胞,可显著减弱tau病理学[20],这也为阐明小胶质细胞激活与tau病理学的关系提供了实验证据,本研究的结果与其一致,这表明CSF1R可能是连接小胶质细胞与AD病理的关键分子。此外,使用CSF1R抑制剂阻断CSF1R信号转导可显著改善小鼠认知[21],表明较高的CSF1R水平与较差的认知相关,本研究也得到了类似的结果(见图3)。
sTREM2调节中枢神经系统的淀粉样蛋白病理和神经退行性变。使用CSF1R抑制剂耗竭小鼠的小胶质细胞,可显著下调小胶质细胞TREM2基因mRNA水平[22],减轻神经炎症反应。CSF sTREM2的浓度反映小胶质细胞的活性,CSF sTREM2水平升高与 CSF P-tau 和 T-tau 水平升高相关[23-24],这与本研究的结果类似,表明CSF1R可通过调节小胶质细胞影响sTREM2的水平进而影响AD病理。
本研究的优势在于这是第一个使用基于人群的数据系统的探讨CSF1R与AD病理以及认知能力相关性的研究。然而,目前的研究有几个应该考虑的局限性。首先,本研究采用了横断面设计,虽然可以观察到相关性,但这种设计使得无法确定因果关系。其次,未开展纵向研究进一步验证结果的可靠性。此外,本研究使用的样本相对较少。因此,未来的工作应该使用高灵敏度测量的CSF CSF1R和大规模队列来验证本研究的结果。
综上所述,本研究发现,CSF1R与AD病理和认知相关,以及sTREM2可能在CSF1R与AD病理之间的关联中发挥重要作用。这些发现为CSF1R信号通路与AD病理改变的相关机制提供了新的证据。
参考文献:
1. LANE C A, HARDY J, SCHOTT J M. Alzheimer’s disease[J]. Eur J Neurol, 2018, 25(1): 59-70.
2. WEINER M W, AISEN P S, JACK C R, et al. The Alzheimer’s disease neuroimaging initiative: Progress report and future plans [J]. Alzheimers Dement, 2010, 6(3): 202-211, e207.
3. ZHANG W, XIAO D, MAO Q, et al. Role of neuroinflammation in neurodegeneration development[J]. Signal Transduct Target Ther, 2023, 8(1): 267.
4. ELMORE M R, NAJAFI A R, KOIKE M A, et al. Colony-stimulating factor 1 receptor signaling is necessary for microglia viability, unmasking a microglia progenitor cell in the adult brain[J]. Neuron, 2014, 82(2): 380-397.
5. ERBLICH B, ZHU L, ETGEN A M, et al. Absence of colony stimulation factor-1 receptor results in loss of microglia, disrupted brain development and olfactory deficits[J]. PLoS One, 2011, 6(10): e26317.
6. OLMOS-ALONSO A, SCHETTERS S T, SRI S, et al. Pharmacological targeting of CSF1R inhibits microglial proliferation and prevents the progression of Alzheimer’s-like pathology[J]. Brain, 2016, 139(Pt 3): 891-907.
7. JAY T R, VON SAUCKEN V E, LANDRETH G E. TREM2 in Neurodegenerative Diseases[J]. Mol Neurodegener, 2017, 12(1): 56.
8. SCHMID C D, SAUTKULIS L N, DANIELSON P E, et al. Heterogeneous expression of the triggering receptor expressed on myeloid cells-2 on adult murine microglia[J]. J Neurochem, 2002, 83(6): 1309-1320.
9. ULRICH J D, ULLAND T K, COLONNA M, et al. Elucidating the Role of TREM2 in Alzheimer’s Disease[J]. Neuron, 2017, 94(2): 237-248.
10. SUÁREZ-CALVET M, KLEINBERGER G, ARAQUE CABALLERO M Á, et al. sTREM2 cerebrospinal fluid levels are a potential biomarker for microglia activity in early-stage Alzheimer’s disease and associate with neuronal injury markers[J]. EMBO Mol Med, 2016, 8(5): 466-476.
11. MA L Z, TAN L, BI Y L, et al. Dynamic changes of CSF sTREM2 in preclinical Alzheimer’s disease: The CABLE study[J]. Mol Neurodegener, 2020, 15(1): 25.
12. GIAU V V, BAGYINSZKY E, An S S A. Potential Fluid Biomarkers for the Diagnosis of Mild Cognitive Impairment [J]. Int J Mol Sci, 2019, 20(17): 4149.
13. TALWAR P, KUSHWAHA S, CHATURVEDI M, et al. Systematic Review of Different Neuroimaging Correlates in Mild Cognitive Impairment and Alzheimer’s Disease[J]. Clin Neuroradiol, 2021, 31(4): 953-967.
14. HANSSON O, SEIBYL J, STOMRUD E, et al. CSF biomarkers of Alzheimer's disease concord with amyloid-β PET and predict clinical progression: A study of fully automated immunoassays in BioFINDER and ADNI cohorts[J]. Alzheimers Dement, 2018, 14(11): 1470-1481.
15. MOHS R C, KNOPMAN D, PETERSEN R C, et al. Development of cognitive instruments for use in clinical trials of antidementia drugs: additions to the Alzheimer’s Disease Assessment Scale that broaden its scope.The Alzheimer’s Disease Cooperative Study[J]. Alzheimer Dis Assoc Disord, 1997, 11: 13-21.
16. JACK C R, BENNETT D A, BLENNOW K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease[J]. Alzheimers Dement, 2018, 14(4): 535-562.
17. BARON R M, KENNY D A. The moderator-mediator variable distinction in social psychological research: conceptual, strategic, and statistical considerations[J]. J Pers Soc Psychol, 1986, 51(6): 1173-1182.
18. SPANGENBERG E E, LEE R J, NAJAFI A R, et al. Eliminating microglia in Alzheimer’s mice prevents neuronal loss without modulating amyloid-β pathology[J]. Brain, 2016, 139(Pt 4): 1265-1281.
19. SPANGENBERG E, SEVERSON P L, HOHSFIELD L A, et al. Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimer’s disease model[J]. Nat Commun, 2019, 10(1): 3758.
20. MANCUSO R, FRYATT G, CLEAL M, et al. CSF1R inhibitor JNJ-40346527 attenuates microglial proliferation and neurodegeneration in P301S mice[J]. Brain, 2019, 142(10): 3243-3264.
21. SOSNA J, PHILIPP S, ALBAY R, et al. Early long-term administration of the CSF1R inhibitor PLX3397 ablates microglia and reduces accumulation of intraneuronal amyloid, neuritic plaque deposition and pre-fibrillar oligomers in 5XFAD mouse model of Alzheimer’s disease[J]. Mol Neurodegener, 2018, 13(1): 11.
22. NI R J, WANG Y Y, GAO T H, et al. Depletion of microglia with PLX3397 attenuates MK-801-induced hyperactivity associated with regulating inflammation-related genes in the brain [J]. Zool Res, 2023, 44(3): 543-555.
23. YANG J, FU Z, ZHANG X, et al. TREM2 ectodomain and its soluble form in Alzheimer’s disease[J]. J Neuroinflammation, 2020, 17(1): 204.
24. SUÁREZ-CALVET M, MORENAS-RODRÍGUEZ E, KLEIN-BERGER G, et al. Early increase of CSF sTREM2 in Alzheimer’s disease is associated with tau related-neurodegeneration but not with amyloid-β pathology[J]. Mol Neurodegener, 2019, 14(1): 1.
【引用格式】王誉静,徐一心,张丹丹,等.脑脊液集落刺激因子1受体与阿尔茨海默病脑脊液生物标志物和认知的相关性研究[J]. 中国神经精神疾病杂志,2025,51(2):85-102.
【Cite this article】WANG Y J,XU Y X,ZHANG D D,et al.Association of cerebrospinal fluid colony stimulating factor 1 receptor with cerebrospinal fluid biomarkers and cognition in Alzheimer disease[J]. Chin J Nervous Mental Dis,2025,51(2):85102.
DOI:10.3969/j.issn.1002-0152.2025.02.005