近年来,肥胖问题已引起全球范围内的广泛关注,被视为可能引发代谢性疾病的潜在威胁。据预测,到2030年,全球肥胖人口将超过10亿。目前,诸如奥利司他、西布曲明和二甲双胍等抗肥胖治疗手段存在五种主要不良反应,部分药物因安全问题已被限制或禁止长期使用。因此,研发新型、安全且有效的药物以管理肥胖已成为迫切需求。
桔梗根(PR)具有抗肥胖、抗炎以及抗氧化等多种生物活性。植物化学研究揭示了PR中存在多种具有生物活性的化合物,包括多糖、三萜皂苷、黄酮类化合物、酚酸以及植物甾醇等。多糖是PR抗肥胖的关键生物活性成分,这一点已由先前的研究得到证实,而高脂饮食(HFD)诱导的体重增加和脂肪积累得到了显著抑制,并且脂质代谢紊乱得到了调节。同样,研究显示PR多糖通过减轻体重、改善血清脂质水平以及缓解炎症反应,有效预防肥胖及其相关症状。尽管如此,但关于PR多糖抗肥胖作用的生物学机制的研究仍然较少,需进一步深入探讨。
近期,一篇题为“Platycodonis Radix Polysaccharides Suppress Progression of High-Fat-induced Obesity Through Modulation of Intestinal Microbiota and Metabolites”的论文深入探讨了PR多糖(PG1、PG2)在抑制HFD诱导的肥胖进展中的作用机制。

图1 论文首页
PG对HFD-Fed小鼠体重和组织病理学变化的影响
具体实验步骤参考图2A,在90天的观察期后,MC组小鼠的体重增长超过了NC组,相较于MC组,高剂量的PG1和PM2治疗显著抑制了体重的增加。尤其是高剂量PG1在减轻体重方面几乎与辛伐他汀具有同等的效力(图2B)。HE染色技术展示了HFD诱导的肝组织病理变化(图2C)。结果显示,MC组小鼠的肝细胞显示出严重的空泡变性、肝索排列紊乱、肝细胞坏死以及炎症细胞浸润。但高剂量PG1治疗后,肝细胞形态恢复正常,肝索排列变得均匀。在缓解HFD引起的肝脏组织病理变化方面,PG1比PG2更为有效。如图2D所示,MC组小鼠的脂肪细胞体积较大。值得注意的是,PG1-H组的脂肪细胞体积有所减小,与NC组和PC组观察到的减小趋势一致。
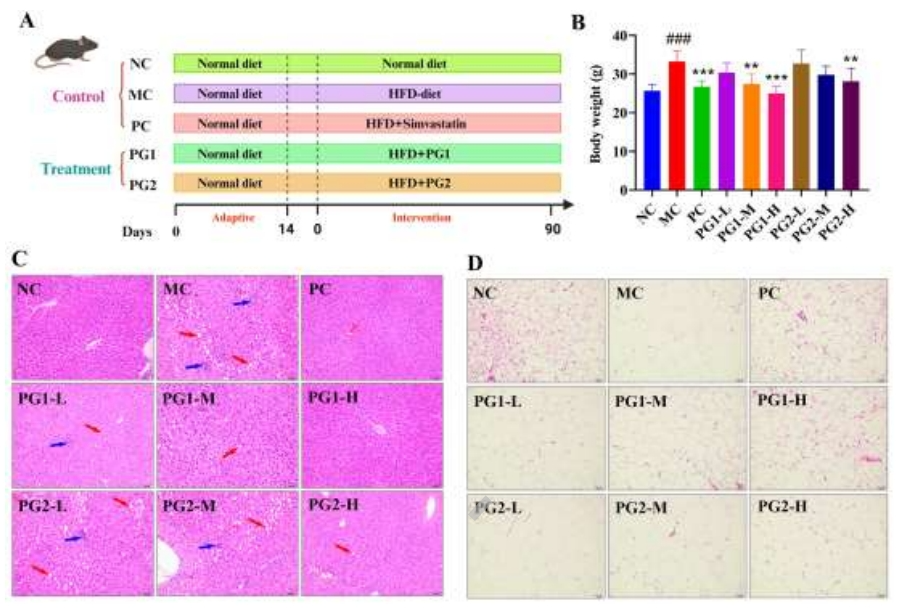
图2 PG1、PG2对HFD诱导肥胖小鼠的影响
此外,组织学分析表明,MC组小鼠盲肠隐窝深度和杯状细胞数量显著减少,这暗示了肠屏障功能的损害(图3)。尽管PG1和PG2均能改善这些变化,但高剂量PG1治疗带来了最为显著的治疗效果。综上所述,高剂量PG1干预能够有效预防由HFD诱导的肝组织、附睾脂肪和盲肠组织中功能失调的组织病理学改变。
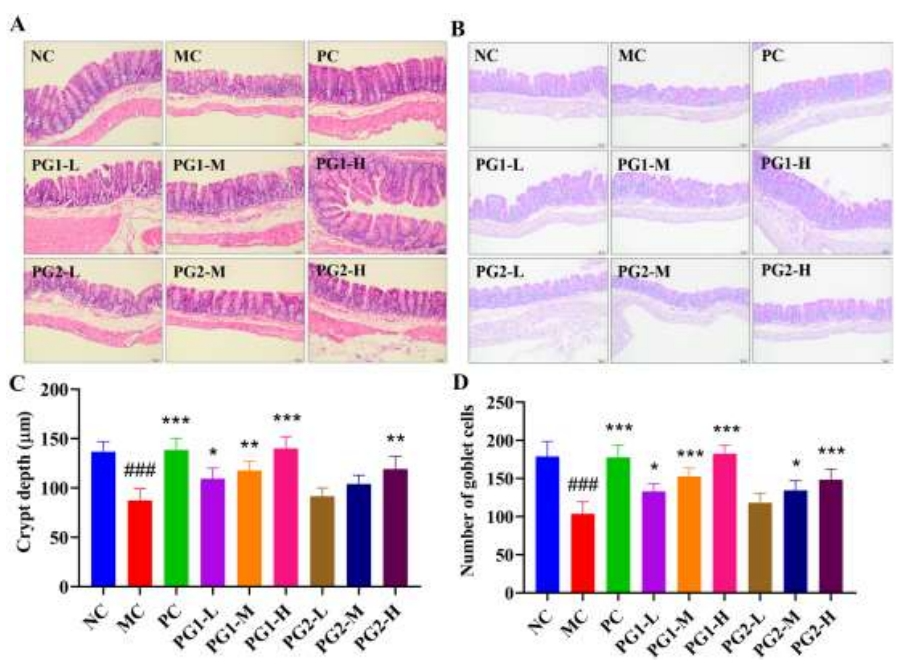
图3 PG1、PG2对HFD诱导肥胖小鼠盲肠组织的影响
PG对HFD喂养小鼠脂质代谢、肝功能和炎症的影响
图4A-I展示了PG给药对HFD喂养小鼠的血脂、肝功能和炎症标志物的影响。高剂量PG1能够显著降低血浆中的总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)水平,同时提升高密度脂蛋白胆固醇(HDL-C)水平。尽管高剂量PG2治疗在改善血脂、肝功能和炎症标志物方面也显示出一定的效果,但相较于PG1,其效果明显较弱,特别是在改善血脂谱和肝功能方面。
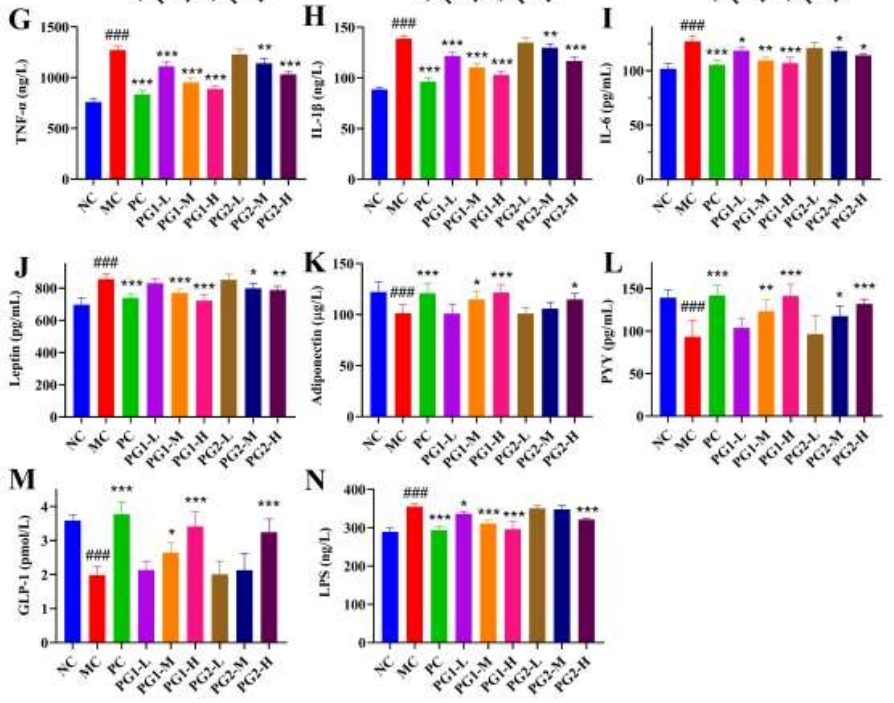
图4 PG1、PG2对HFD喂养小鼠脂质代谢、肝功能、炎症和血清激素的影响
PG对HFD喂养小鼠血清激素水平的影响
血清激素水平受PG影响的情况如图4J-M所展示。在MC组中,HFD饮食导致瘦素水平显著上升,而脂联素、PYY和GLP-1水平显著下降。PG治疗,尤其是PG1治疗,有效地缓解了这些变化。相较于MC组,PG1-H干预使得瘦素含量减少了15.68%,同时脂联素、PYY和GLP-1水平分别提升了19.84%、51.50%和72.11%。PG1在改善血清激素水平方面的效果明显优于PG2。
PG对HFD喂养小鼠GM的影响
在PG1-H组中,Shannon指数(该指数反映了肠道菌群的均匀性和多样性)显著上升(图5A)。这一变化表明,高剂量的PG1能够显著提升微生物群落的多样性。在门水平上的分析揭示了HFD小鼠与标准饮食小鼠之间肠道微生物组成存在显著差异(图5B-E)。通常情况下,小鼠的肠道菌群主要由厚壁菌门和拟杆菌门构成。MC组小鼠摄入HFD后,导致厚壁菌门数量增加而拟杆菌门数量减少,进而使得厚壁菌门与拟杆菌门的比例上升。然而,PG1和PG2的高剂量治疗显著降低了这一比例。主坐标分析(PCoA)展现了肠道微生物群落(GM)结构的显著变化,突显了NC组与MC组之间群落结构的显著差异(图5F-G)。研究结果表明,高剂量PG1干预能够显著逆转由HFD引起的肠道生态失调,其效果在PC组中甚至超过了辛伐他汀的干预效果。
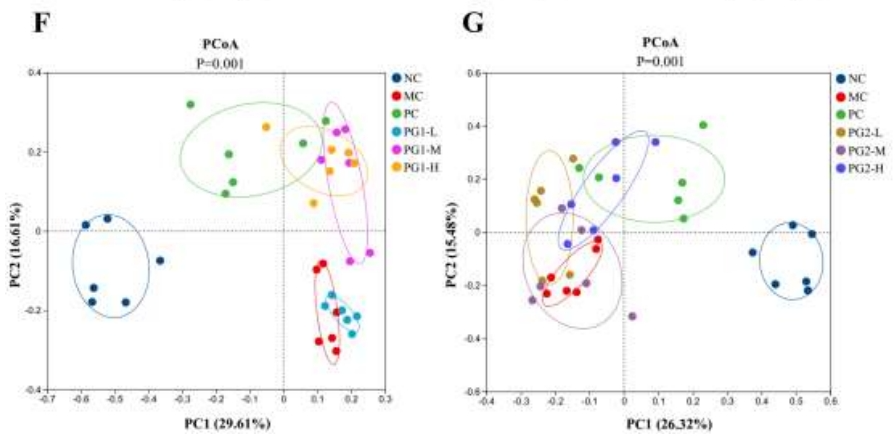
图5 PG1、PG2对GM调控的影响
PG对BAs代谢相关基因和蛋白表达的影响
图6A-D揭示,HFD显著提升了盲肠中法尼酯X受体(FXR)和成纤维细胞生长因子15(FGF15)的表达水平,同时增加了成纤维细胞生长因子受体4(FGFR4)的表达,并导致肝脏中胆固醇7α-羟化酶(CYP7A1)的表达减少。然而,高剂量的PG1干预显著逆转了这些变化趋势。
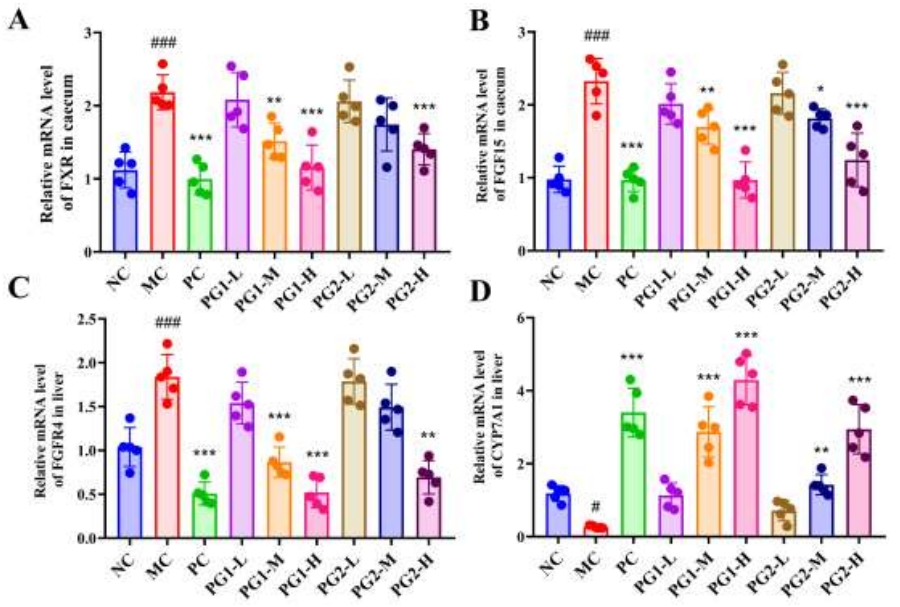
图6 PG1、PG2对胆汁酸(BA)代谢相关基因表达的调节作用
进一步地,图7A、B及D-E中的WB分析验证了HFD显著提升了盲肠中总FXR、核FXR和FGF15的蛋白表达,而这些效应被PG1处理有效地缓解。图7C-H的结果显示,高剂量PG1显著降低了肝脏中FGFR4蛋白的表达,并提升了CYP7A1的表达,尽管PG2治疗展现了类似的效果,但其疗效明显不及PG1。
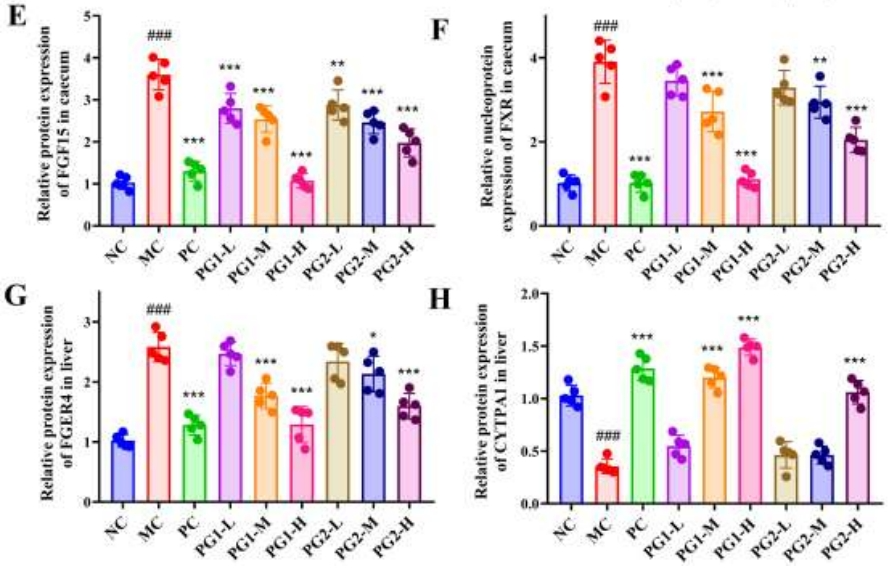
图7 PG1、PG2对胆汁酸(BA)代谢相关蛋白表达的调节作用
结论总之,源自PR的PG1饮食干预策略,通过改善脂质代谢、降低炎症反应、增强肝脏功能、预防脂肪积累以及维护肠道完整性,有效地遏制了饮食诱导的肥胖进展。PG1的抗肥胖作用机制与GM的调节密切相关,其可能通过激活GM-短链脂肪酸(SCFA)-G蛋白偶联受体(GPR)通路和抑制GM-胆汁酸(BA)-法尼醇X受体(FXR)-成纤维细胞生长因子15(FGF15)通路来减轻肥胖症状。因此,PG1有潜力作为一种有效的益生元剂,用于治疗肥胖症及转基因生态失调。
参考文献:
Nannan Zhi , Xiangwei Chang , Liangping Zha , Kailun Zhang ,Jutao Wang , Shuangying Gui.Platycodonis Radix Polysaccharides Suppress Progression of High-Fat-induced Obesity Through Modulation of Intestinal Microbiota and Metabolites.Phytomedicine.https://doi.org/10.1016/j.phymed.2025.156653