脂肪组织是重要的能量储存库,其在衰老过程中会发生显著变化,影响代谢紊乱的发病机制,包括肥胖。肥胖是一种加速衰老的状态,与衰老共享许多关键的生物学特征,这些特征与功能失调的脂肪组织密切相关。因此,深入理解肥胖与衰老之间复杂的分子关系对于开发有效的干预策略至关重要。近年来,转录组学研究通过分析基因表达模式,揭示了与肥胖相关的潜在基因和调控通路。
意大利米兰大学的Stephana Carelli教授团队在本刊发表了题为“Gene expression analysis in subcutaneous adipose tissue reveals a predominant influence of lncRNAs during growth”的研究快讯。该研究通过整合肥胖患者的皮下脂肪组织的RNA测序数据集,揭示了肥胖儿童和成人中基因表达的差异,强调了长非编码RNA(lncRNA)在肥胖相关基因调控中的主导作用。
1 研究方法
研究团队利用Gene Expression Omnibus(GEO)数据库,检索了肥胖患者皮下脂肪组织的公开RNA测序数据集。根据筛选标准,共纳入8个肥胖成人患者(OBAD)数据集,包含129个样本,以及2个肥胖儿童患者(OBPED)数据集,包含34个样本。研究团队对这些数据集重新处理,分析了编码基因和非编码基因的表达差异,以探索与肥胖相关的通路,并识别新的潜在调控通路。
2 研究结果
研究团队通过主成分分析发现肥胖成人(OBAD)和肥胖儿童(OBPED)样本存在明显分离,提示性别和种族等因素可能影响基因表达模式(图1A)。火山图分析鉴定出3330个差异表达的RNA(DE-RNAs),其中非编码基因占绝大多数(3140个),且主要表现为上调(2665个)。此外,差异表达基因(DEGs)的3'UTR长度与基因组整体分布不同,倾向于更长且更易变化的3'UTR长度,这与lncRNA通过结合3'UTR调节mRNA稳定性的作用一致(图1B、C)。ShinyGo预测分析显示,编码基因的DE-RNAs数量显著低于预期,而非编码RNA(ncRNA)则相反,提示非编码RNA在肥胖中可能发挥重要作用(图1D)。
研究还发现210个差异表达的miRNA,其中206个上调,4个下调。通过miRTarBase分析发现,这些miRNA在癌症相关过程中富集,提示成人和儿童肥胖患者可能具有不同的癌症易感性(图1E)。此外,研究鉴定出1314个差异表达的lncRNA,并进行了编码RNA、miRNA和lncRNA的联合KEGG富集分析,发现脂肪细胞因子信号通路和寿命调节通路的失调,提示特定lncRNA可能在这些过程中发挥作用(图1H)。进一步分析显示,上调的lncRNA在老年个体中表达显著增加,支持其在年龄相关机制中的潜在作用(图1I、J)。
此外,研究识别了2860个具有切换特征的差异表达异构体,涉及1444个独特基因,其中大多数为蛋白编码基因。这些异构体的变化主要影响蛋白结构域、编码潜力、无序区域和内含子保留等。基于这些异构体的KEGG功能富集分析显示,与衰老相关的疾病(如神经退行性疾病、细胞衰老)以及代谢通路和癌症通路的富集(图1K、L)。
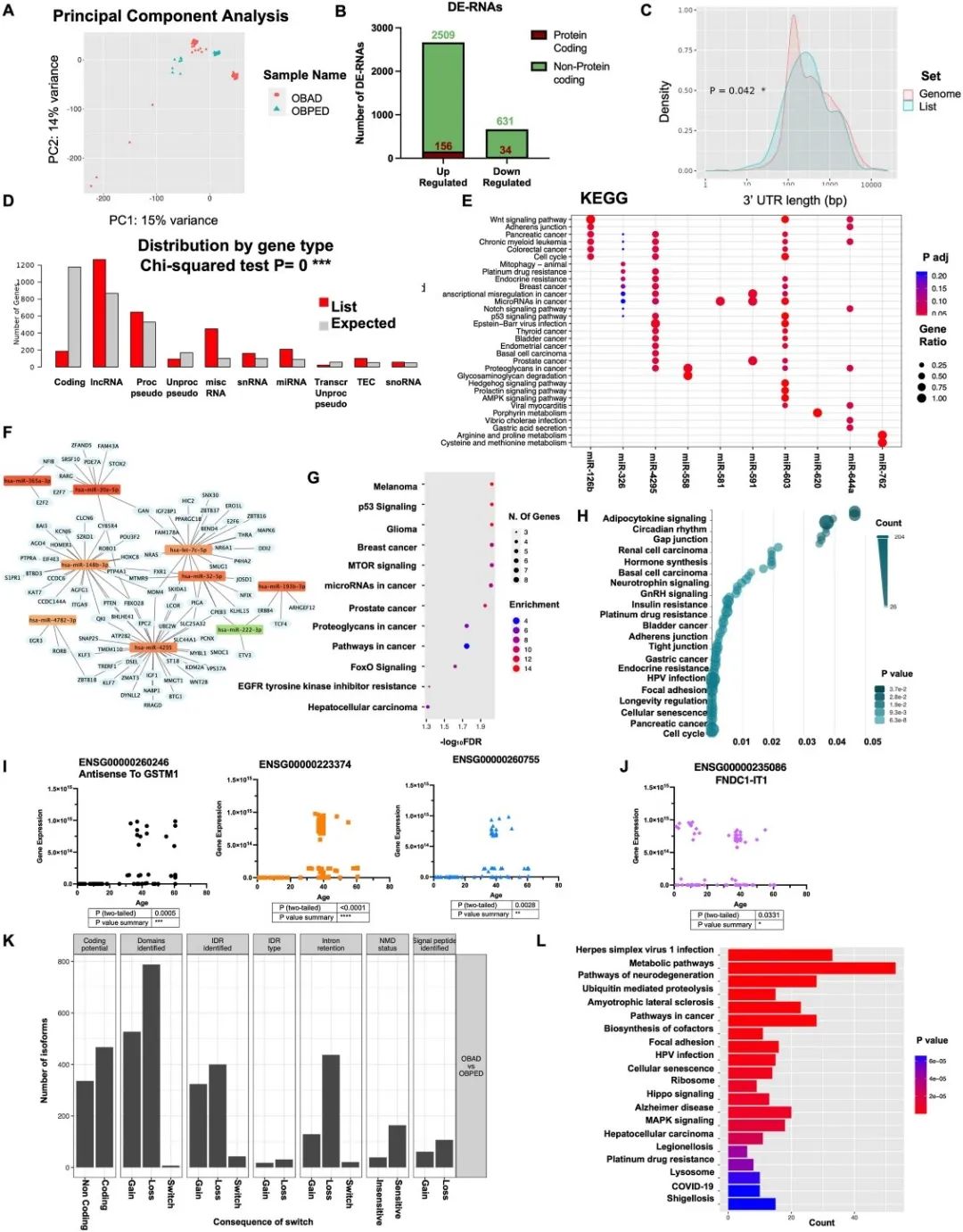
图1生长过程中脂肪组织中RNA的失调
3 研究结论
本研究通过分析肥胖儿童和成人的皮下脂肪组织基因表达差异,揭示了非编码RNA(尤其是lncRNA)在肥胖相关基因调控中的主导作用。这些发现为未来研究提供了新的靶点和方向,强调了非编码RNA在肥胖发病机制中的重要作用,并可能为肥胖的干预策略提供新的方向。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S235230422400148X
引用这篇文章:
Rey F, Messa L, Berardo C, et al. Gene expression analysis in subcutaneous adipose tissue reveals a predominant influence of lncRNAs during growth. Genes Dis. 2025;12(2):101351.