晚期上皮性卵巢癌(AOC)的治疗管理随着分子诊断技术的出现取得了重大进展,尤其是在基于同源重组修复缺陷(HRD)状态来预测对PARP抑制剂(PARPi)的反应方面。然而,对于HRD状态之外的敏感性和耐药性的理解仍然不够清晰。本研究旨在探索那些可能解释为何HRD状态不能始终如一地预测PARPi敏感性的分子因素。研究者对来自ENGOT-ov24/NSGO-AVANOVA第1部分和第2部分试验(NCT02354131)的福尔马林固定石蜡包埋肿瘤样本进行了事后转化分析,重点关注与影像学反应和无进展生存期(PFS)相关的基因变异。使用TruSight Oncology 500 HT基因panel进行了DNA测序,并根据最新指南对变异进行了分类。HRD状态由Myriad MyChoice CDx检测评估。在ENGOT-ov24/NSGO-AVANOVA第1部分和第2部分试验的92名患者中,研究者在81个样本中鉴定出了151个致病性或可能致病性变异。在来自临床获益(PFS≥12个月)患者的10个HRD阴性样本中,有2个样本发现了PARPi增敏变异,而在来自没有获益(PFS≤6个月)患者的10个HRD阳性样本中,有3个样本携带了与PARPi耐药相关的变异。此外,对BRCA1变异的分析显示,当尼拉帕利与贝伐珠单抗联合使用时,外显子11的截短变异与临床获益相关。总之,本研究结果突显了晚期卵巢癌中对PARPi反应的复杂性,并强调了探索HRD状态之外的体细胞变异的重要性。有必要进一步研究BRCA1外显子11变异以及联合治疗的潜力。
研究背景
通过分子诊断和个性化治疗的应用,AOC的治疗管理取得了显著进展。HRD状态仍然是预测PARPi反应的最可靠生物标志物。然而,有趣的是,一部分HRD阴性(HRDneg)肿瘤患者对治疗仍有反应,而一些被归类为HRD阳性(HRDpos)肿瘤的患者却并未从PARPi治疗中获益。
Myriad MyChoice CDx(Myriad Genetics公司;MyChoice)和FoundationOne CDx(Foundation Medicine公司)检测是经美国FDA批准用于评估HRD状态和预测患者对PARPi反应的突出工具。在过去几年中,出现了一些实验室研发的HRD检测方法,并经过验证显示出一致性,尤其是与MyChoice检测方法相比。值得注意的是,ENGOT欧洲HRD倡议在这些检测方法的开发和验证中发挥了关键作用,其使用了来自参与PAOLA-1试验的患者的DNA样本——PAOLA-1试验是一项III期临床试验,研究在卵巢癌一线维持治疗中,将奥拉帕利添加到贝伐珠单抗治疗方案中的效果。同样,丹麦国家医院基因组医学中心也建立了一种实验室研发的HRD状态检测方法。这种实验室研发的检测方法与NSGO-CTU开展的ENGOT-ov24/NSGO-AVANOVA 第1部分和第2部分(AVANOVA1&2)试验中患者的MyChoice检测所确定的HRD状态一致。
克服耐药性的努力仍然是一个备受关注的话题。尽管已经提出了许多耐药机制,但对这些机制的全面理解仍然不够明确。临床前研究表明,抗血管生成药物可在BRCA1/2野生型(BRCA1/2wt)细胞以及对铂类药物产生耐药的BRCA1/2突变(BRCA1/2m)细胞中诱导HRD。这些发现支持了PARPi与抗血管生成药物联合使用是有效的这一观点,这一联合方案在两项阳性的II期研究中得到了进一步探讨。相比之下,III期PAOLA-1试验表明,对于HRD阴性肿瘤患者,无论存在几种风险因素,在贝伐珠单抗基础上添加奥拉帕利均未带来PFS获益。遗憾的是,PAOLA-1试验未探索奥拉帕利单药治疗的效果以作比较。不过,基于PRIMA研究中总体研究人群的阳性PFS结果,尼拉帕利已被批准作为所有新诊断的高级别浆液性卵巢癌患者的一线维持治疗药物,无论其HRD状态如何。
一些评估PARPi在AOC中疗效的临床试验已经发表了事后转化子研究,在这些研究中,通过下一代测序(NGS)方法对试验参与者的组织样本进行了分析,主要使用的是靶向基因panels。在ARIEL2研究中,RAD51C/D突变和高水平的BRCA1甲基化可预测对卢卡帕利的反应,类似于BRCA1/2的致病性变异。在PAOLA-1研究中,对所有BRCA1/2突变的样本进行了筛选,作者发现无论这两个基因上氨基酸变化的位置如何,在贝伐珠单抗基础上添加奥拉帕利均有获益。Lheureux及其同事研究了来自Study 19和Study 41的肿瘤组织样本,并发现BRCA2突变在对奥拉帕利有长期反应的患者中富集。
在本研究中,研究者试图确定体细胞变异,以解释AVANOVA1&2试验中患者在影像学反应和PFS方面出现的意外反应。
研究方法
ENGOT-ov24/NSGO-AVANOVA2(NCT02354131)试验是一项开放标签、随机、II期研究。在该研究中,年龄18岁及以上、患有可测量或可评估的铂敏感高级别浆液性或子宫内膜样卵巢癌复发患者,按1:1的比例随机分组,分别接受每日一次口服300毫克尼拉帕利单药治疗,或联合每3周一次静脉注射15毫克/千克贝伐珠单抗治疗,直至疾病进展。在开展II期研究之前,进行了一项I期研究(ENGOT-ov24/NSGO-AVANOVA1),以评估联合治疗方案的理想剂量。从现在起,这两项研究统一称为AVANOVA1&2。基因组不稳定性评分(GIS)≥42和/或BRCA1/2存在致病性变异的样本被标注为HRD阳性。为了统一I期和II期研究的临床数据,PFS定义为从首次服用尼拉帕利至疾病进展的时间。PFS≥12个月的患者被定义为有临床获益,也称为“有反应者”;PFS≤6个月的患者被定义为无临床获益,也称为“无反应者”。PFS在6至12个月之间的患者被视为处于灰色地带,既不属于有反应者也不属于无反应者。本转化研究包括对AVANOVA1&2数据的事后探索性分析。除了纳入“贝伐珠单抗单药治疗”组的患者外,所有纳入AVANOVA1&2的患者均符合事后转化分析的条件。
研究结果
研究队列:
排除了在涉及贝伐珠单抗单药治疗的第三治疗组关闭前入组的6名患者后,共有109名患者仍符合后续转化研究的条件。由于组织样本缺失、患者拒绝以及研究站点或区域生物样本库未参与等因素,研究者成功收集了94份FFPE肿瘤组织样本,其中92份样本通过了质量检测(图1)。对患者特征进行了分析,以评估从每个治疗组收集的样本分布情况——见表1。在这92份样本中,41份来自接受尼拉帕利单药治疗的患者,而51份样本来自联合治疗组的患者。尽管治疗组之间最初存在这种不平衡,但研究者发现,在新辅助化疗、国际妇产科联盟(FIGO)分期、年龄、组织学类型、体能状态和HRD状态方面,两组具有良好的可比性。BRCA1的致病性变异在单药治疗组中更为常见(n = 9/13),而BRCA2的致病性变异在联合治疗组中更为常见(n = 8/11)。


图1

表1
适合基因panel分析的样本:
研究者手动识别并确认了92份FFPE样本中81份样本存在致病性变异。11份样本未发现任何致病性变异。值得注意的是,在这11份样本中,有2份样本在AVANOVA1&2试验最初开展时已分别被诊断出存在胚系BRCA1和BRCA2致病性变异。在FFPE样本中再次鉴定出了这两种胚系变异。为了探究这11份意外缺乏致病性变异的样本的肿瘤纯度,研究者评估了相应的拷贝数阵列数据(这些数据是研究者所在团队另一项研究的一部分)。这项评估证实了11份样本中的9份样本(包括两个BRCA1/2胚系样本)正常组织比例较高的怀疑,揭示了一个平衡的等位基因谱,没有拷贝数变化。此外,在这9份样本中,仅5份样本成功分析出了MyChoice HRD状态。其中,2份显示BRCA1/2(胚系)变异的样本被归类为HRD阳性,3份BRCA1/2野生型样本的GIS在8到18之间。其余4名患者被分层为HRD阴性/未知。在本研究队列中,另有5份样本MyChoice未能成功分析,导致总失败率为10%(9/92份样本)。
BRCA1/2突变状态:
通过最初的MyChoice分析鉴定出的所有致病性和可能致病性BRCA1/2变异,在本次基因panel的结果中均得到了证实。根据更新后的分类方案,BRCA1和BRCA2中的两个变异可能具有致病性;然而,此前它们被认为是“意义未明的变异”。这种重新分类对分层没有任何影响,因为它们最初仅根据GIS就被分层为HRD阳性。此外,根据更新后的标准,两个意义未明的BRCA1变异和两个意义未明的BRCA2变异实际上可能是良性变异。
致病性变异与临床数据:
在本研究中,研究者在81份肿瘤组织样本中鉴定出了151个致病性或可能致病性变异——图2。与现有文献一致,几乎所有高级别浆液性AOC肿瘤中都存在TP53的有害突变。总体而言,99%(n = 74/75)的高级别浆液性AOC肿瘤组织样本中都存在TP53的致病性变异。值得注意的是,在两份TP53野生型样本中,一份与低级别浆液性AOC肿瘤相关,该肿瘤携带BRAF V600E变异。显著的是,BRCA1/2的致病性变异在有临床获益和无临床获益的患者中均有出现,而其他已知的同源重组修复(HRR)基因的变异仅在有临床获益患者的肿瘤样本中被鉴定出来(ABRAXAS1、FANCA和RAD51C)。此外,其他已知的DNA修复基因(不包括TP53)的致病性变异在有临床获益患者的样本中显著富集(P = 0.02)。有趣的是,PI3K/AKT/mTOR通路和RAS/RAF/MEK通路的致病性变异在无临床获益患者(n = 10/34)中比在有临床获益患者(n = 5/31)中更为普遍,尽管这种差异没有统计学意义(P = 0.25)。

图2
影像学反应与总体HRD状态:
AVANOVA1&2是一项在患者复发时直接治疗的临床研究;因此,所有患者在入组时都有可测量的疾病。70名患者的可测量靶病灶可进行评估,其中68名患者的“最佳影像学反应”可计算为评估扫描中靶病灶的最小总和除以基线时靶病灶的总和。70名患者中有2名在首次扫描时出现疾病进展并伴有新病灶,此处未报告这2名患者的数据。图3显示了按HRD状态标注的最佳影像学反应。值得注意的是,无论治疗组如何,HRD阳性肿瘤患者更有可能出现深度影像学反应。此外,在影像学上肿瘤呈生长状态(最佳反应)的患者样本中,不存在BRCA1/2或其他HRR基因的致病性变异。对于每个治疗组中HRD阴性肿瘤样本且肿瘤病灶影像学缩小的患者,以及HRD阳性样本但肿瘤未缩小的患者,这些意外反应均不能用“临界GIS”来解释,这意味着除了联合治疗组中1例完全缓解(GIS = 38)和单药治疗组中1例部分缓解(GIS = 37)的患者外,HRD阴性肿瘤的GIS均未接近42的临界值。同样,没有任何肿瘤缩小的HRD阳性肿瘤的GIS评分均较高。

图3
HRD阳性肿瘤与影像学反应:
对于12名被分层为HRD阳性且最佳影像学反应为病情稳定的患者,其中3份肿瘤样本存在癌基因的竞争性功能获得性变异(EGFR错义突变、MYC和AKT2扩增),2份样本存在肿瘤抑制基因的致病性变异(分别为KDM5C的移码突变和TSC1的预测剪接变异)。文献中描述了EGFR的功能获得性变异会降低对PARPi的敏感性。在MYC驱动的三阴性乳腺癌中,MYC阻断与PARPi联合使用可产生合成致死效应,这为晚期卵巢癌未来的临床试验提供了潜在的治疗机会。同样,PI3K–Akt通路的激活也与对PARPi的耐药相关。
HRD阴性肿瘤与影像学反应:
相比之下,在11名HRD阴性样本且最佳反应为部分缓解或完全缓解的患者中,仅有3名患者除了TP53外还同时存在其他致病性变异,并且这些变异(CCNE1扩增、NRG1的移码突变和FGFR2的错义突变)均无法解释影像学上肿瘤缩小这一矛盾现象。所有HRD状态未知的肿瘤组织样本均携带TP53的致病性变异,且不存在其他致病性变异。
PFS与总体HRD状态:
PFS是AVANOVA1&2的主要终点,研究发现联合治疗优于单药治疗。在此,研究者报告了按HRD状态标注的每位患者的PFS(图4)。在可进行PFS分析的92名患者中,17名患者因疾病进展以外的其他原因停止治疗[毒性(n = 14)、部分撤回同意(n = 2)、研究者决定(n = 1)],3名患者在研究结束时仍在接受治疗。对于本研究纳入的患者队列,我们使用Kaplan–Meier方法和Cox比例风险计算进行了PFS分析。值得注意的是,与主要发表的研究不同,本分析中排除了HRD状态未知的患者(在主要发表研究中,这些患者被分析为HRD阴性/未知)。在这个亚组中,接受联合治疗和单药治疗的患者之间在PFS方面没有统计学显著差异(P = 0.18)。然而,当不考虑两个治疗组时,在HRD阳性样本的患者中发现了显著的PFS获益(HR = 0.56;95%CI,0.34–0.95;P = 0.03)。
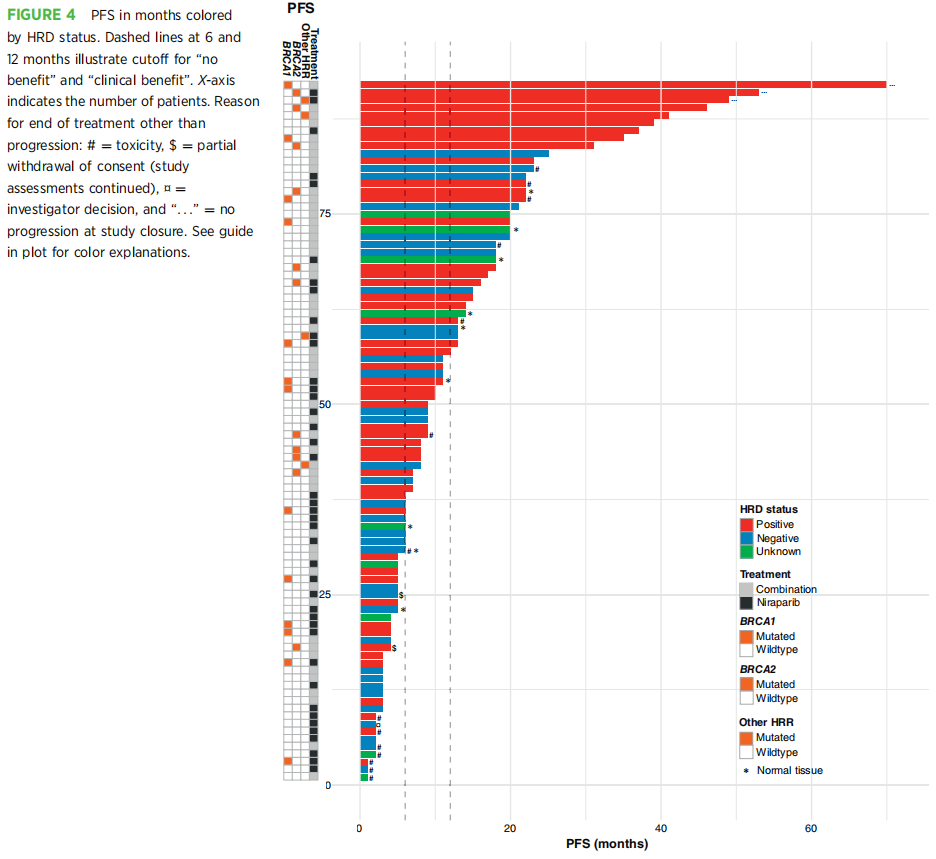
图4
HRD阳性肿瘤与PFS:
在10名HRD阳性样本且在治疗6个月内出现疾病进展的患者中,5名患者存在BRCA1的致病性变异,且均同时伴有TP53突变。在这5名无反应且存在BRCA1致病性变异的患者中,3名患者通过靶向测序发现至少在另一个基因(NRAS、SMC1A、B2M和TSC1)中同时存在致病性变异。到目前为止,尚未有报道称这些基因与BRCA1突变联合会导致对PARPi的耐药。对于其余5名在6个月内出现疾病进展的HRD阳性肿瘤患者,除了TP53突变外,3名患者还同时存在致病性变异(EGFR、MYC和AKT2)。这些患者与之前在影像学反应方面描述的3名患者相同。
HRD阴性肿瘤与PFS:
在10名被分层为HRD阴性且有临床获益(无论停止治疗的原因是什么)的患者中,9名患者存在致病性变异,其中5份样本仅在TP53中发现致病性变异。1份样本被发现来自低级别肿瘤,该肿瘤在ZBTB7A、ABRAXAS1和BRAF中存在致病性变异,而在TP53中不存在致病性变异。另一份样本在RB1和PTEN中存在致病性变异。据报道,ZBTB7A、ABRAXAS1和RB1与对PARPi和/或铂类治疗的反应相关;相反,关于PTEN对PARPi敏感性的解释存在矛盾。剩下的2份HRD阴性样本分别显示KRAS扩增和PTPRD的截短变异,以及CCNE1扩增,这两种扩增均与对PARPi的耐药相关。尽管鉴定出了HRD状态之外的增敏和耐药性变异,但值得注意的是,在PFS最长的9名患者中,所有患者均为HRD阳性肿瘤,7名患者在BRCA1/2或另一个HRR基因中存在有害变异。在研究结束时仍在接受治疗且PFS最长的3名患者,分别在BRCA1、BRCA2或RAD51C中存在截短变异。
BRCA1/2变异的位置与治疗反应:
在BRCA1(I15S)和BRCA2(W2626C)中仅各观察到一次致病性错义变异,且分别位于重要的功能结构域(RING结构域和DNA结合结构域)。对于这两种错义变异,在联合治疗时均观察到了临床获益。通过SpliceAI预测,BRCA2外显子13(供体位点)和外显子24(受体位点)的两个剪接变异具有有害性,但与临床获益无关。然而,截短变异(无论是无义突变还是移码突变)最为常见,且随机分布,其位置与治疗反应之间没有关联。值得注意的是,BRCA1外显子11的9个截短变异中仅有2个与临床获益相关——见图5说明。这与有证据表明在BRCA1外显子11存在无义突变的情况下会发生BRCA1的可变剪接,从而导致BRCA1-Δ11q异构体的表达一致。BRCA1-Δ11q与对PARPi和顺铂的耐药均相关。在BRCA1外显子11的7个无临床获益的截短变异中,5个被MyChoice分类为HRD阳性,而对其余2份样本的HRD评估未能成功分析。2名存在外显子11截短变异且有临床获益的患者接受了联合治疗,而无临床获益的患者接受了尼拉帕利单药治疗。尽管病例有限,但这表明对于BRCA1外显子11存在致病性变异的患者,联合治疗可能具有潜在益处(P = 0.03)。对于BRCA2突变有反应的患者,2名接受单药治疗,4名接受联合治疗,且在变异位置方面未发现显著差异。

图5
讨 论
在这项研究中,研究者探寻了一些分子层面的发现,这些发现或许能解释为何HRD状态并不总是能预测PARPi的敏感性。本队列由92名接受治疗的患者组成,这些患者所患的是铂敏感复发性AOC,他们接受的治疗方案要么是尼拉帕利单药治疗,要么是尼拉帕利联合贝伐珠单抗治疗。本研究存在局限性,包括纳入的患者数量有限,以及可用的FFPE组织样本有限。此外,患者接受了两种不同的治疗方案,这也限制了用于比较的样本数量。然而,在10名HRD阳性样本且在开始治疗后6个月内出现病情进展的患者中,有7名患者携带除TP53突变之外的其他致病性变异,其中3名患者的变异(EGFR、MYC和AKT2的功能获得性变异)与PARPi耐药相关。同样,在10名HRD阴性肿瘤且在治疗12个月后出现病情进展的患者中,分别有2名患者被发现ABRAXAS1和ZBTB7A基因以及RB1基因存在与PARPi增敏相关的变异。相反,有2名患者尽管其HRD阴性肿瘤样本分别存在KRAS和CCNE1基因扩增(通常与对PARPi耐药相关),但仍获得了良好的临床结局。如果在治疗前就对这些变异进行评估,对于HRD阳性肿瘤患者而言,可能并不会改变他们的治疗方案。因此,如果对更广泛的基因进行检测,发现潜在的PARPi增敏变异,那么因HRD阴性肿瘤样本而错过使用PARPi治疗潜在应答患者的可能性就可能降低。在这种情况下,本研究中34名HRD阴性肿瘤患者中可能有2名会被检测出是潜在的应答者。另一个值得注意的发现是,少数BRCA1基因第11外显子存在截短变异的患者对治疗有应答,而且这些有应答的患者接受的是联合治疗而非单药治疗。对此谨慎的解读是,携带BRCA1基因第11外显子变异的患者可能需要联合治疗,比如联合贝伐珠单抗,以使肿瘤细胞对PARPi敏感。作为下一步,研究者计划在更大的队列中分析携带BRCA1/2变异的患者对PARPi的应答情况,以进一步探究这一假设。
在将高成本检测(如NGS分析)纳入常规诊断时,成本与效益之间的平衡是一个持续存在的问题。考虑到基因组分析正处于变革时代,且测序成本迅速下降,很有可能接受高通量测序分析的实体癌患者数量正在增加。因此,在提出新假设时,将全面的癌症变异图谱分析作为现有临床试验的探索性转化研究是非常有意义的。
使用FFPE肿瘤组织作为MyChoice检测的样本时,失败率较高,这给那些检测结果不确定的患者留下了空白。在本研究中,MyChoice检测的失败率为10%,而在真实世界的常规MyChoice检测中,失败率约为20%。高失败率主要是由于DNA质量不佳和/或肿瘤细胞含量低。正在进行的研究旨在寻找更好的样本组织,例如使用来自腹腔积液的循环肿瘤DNA(ctDNA)。随着学术性HRD检测方法得到验证并作为开源脚本发布,其中一些检测方法的测序和算法与Myriad MyChoice和FoundationOne CDx不同,并且有可能用于FFPE组织样本以外的其他样本。已有两项研究发表,展示了使用来自腹腔积液的ctDNA所取得的令人鼓舞的结果。
在全球范围内,尽管欧洲药品管理局和美国FDA已批准PARPi作为一线维持治疗药物,且不考虑HRD状态,但市面上可获得的HRD检测仍被用于确定AOC患者的最佳治疗方案。如果治疗获益可能性较低的患者(如HRD阴性肿瘤患者),则需要考虑成本和潜在的副作用。对于这些患者而言,作为一线维持治疗的另一种选择可能是贝伐珠单抗单药治疗。AVANOVA第二部分研究探讨了尼拉帕利单药治疗或联合贝伐珠单抗治疗复发性卵巢癌的效果,结果显示联合治疗组有获益。经过仔细分析,似乎在本研究队列中,当复发时直接进行治疗,在尼拉帕利的基础上加用贝伐珠单抗对肿瘤缩小效果有一定的额外提升。尽管PAOLA-1试验在一线维持治疗中未发现奥拉帕利联合贝伐珠单抗对HRD阴性分层患者有获益,但NIRVANA-1试验目前正在另一项II期研究中招募患者,让他们在辅助化疗后接受尼拉帕利或尼拉帕利联合贝伐珠单抗治疗,以进一步探究在PARPi基础上加用抗血管生成药物的获益情况。
据研究者所知,这是为数不多的针对卵巢癌临床试验开展的转化性子研究之一,旨在为HRD阴性肿瘤患者对PARPi的敏感性以及HRD阳性肿瘤患者对PARPi的耐药性寻找个体化的解释。研究者建议进一步研究BRCA1基因第11外显子变异,以探究是否应对其中一些肿瘤采用不同的治疗方法,例如联合治疗,从而使患者对PARPi产生应答。
有必要在细胞培养中开展更多功能研究,并对在临床试验中接受过PARPi治疗的患者进行回顾性基因组分析。最后,除了基因组测序之外,开发并整合转录组学、蛋白质组学、表观基因学和空间分析等技术,有可能更深入地了解PARPi敏感性。综上所述,确定参与对PARPi应答和耐药的其他因素对于进一步加强AOC患者的个体化治疗至关重要。
参考文献:
Kjeldsen MK, Jørgensen M, Grønseth DSB, et al. Beyond HRD Status: Unraveling Genetic Variants Impacting PARP Inhibitor Sensitivity in Advanced Ovarian Cancer. Cancer Res Commun. 2024;4(12):3190-3200. doi:10.1158/2767-9764.CRC-24-0294
