在胶质瘤中,瘤内出血不太常见,但可能是首发临床表现,可通过 MRI 发现;然而,其对患者预后的确切影响仍不清楚且存在争议。2021 WHO CNS 5 分类强调遗传和分子特征,引发了确定出血与分子改变相关性的需要。本研究旨在确定不同胶质瘤亚型中的瘤内出血发生率,并确定相关的分子和临床特征,以改善患者管理。回顾了 2011年1月至 2022年1月在北京协和医院神经外科接受手术且病理证实为胶质瘤的患者的临床资料和影像学结果。根据术前磁共振成像将患者分为出血组和非出血组。对两组进行比较和生存分析。在亚组分析中,根据 WHO CNS 5 分类,综合组织学和分子特征,患者被分为:星形细胞瘤,IDH 突变型;少突胶质细胞瘤,IDH 突变伴 1p/19q 共缺失型;胶质母细胞瘤,IDH 野生型;儿童型胶质瘤;或局限性胶质瘤。457 例患者被纳入分析,包括 67 例(14.7%)瘤内出血患者。出血组年龄显著较大,术前 Karnofsky 体能状态评分较差。出血组神经功能损伤发生率较高,Ki-67 指数较高。分子分析表明,出血组 CDKN2B、KMT5B 和 PIK3CA 突变率较高(CDKN2B,84.4% vs 62.2%,p = 0.029;KMT5B,25.0% vs 8.9%,p = 0.029;PIK3CA,81.3% vs 58.5%,p = 0.029)。生存分析显示,出血组的预后显著较差(出血 18.4 个月 vs 非出血组 39.1 个月,p = 0.01)。在亚组分析中,多变量分析显示,瘤内出血仅在胶质母细胞瘤,IDH 野生型(162/457,HR = 1.72,p = 0.026)中是独立危险因素,在其他类型的胶质瘤中不是。在出血组和非出血组中,CDK6(出血组 p = 0.004,非出血组 p < 0.001)、EGFR(出血组 p = 0.003,非出血组 p = 0.001)和 FGFR2(出血组 p = 0.007,非出血组 p = 0.001)分子改变均与总生存时间较短相关。本研究表明,术前瘤内出血的胶质瘤患者预后比非出血患者差。CDKN2B、KMT5B 和 PIK3CA 突变与较高的瘤内出血发生率相关,可能是未来进一步研究瘤内出血的靶点。
研究背景
胶质瘤是一组异质性的原发性脑肿瘤,全球年发病率为 6 /10万人。与成人弥漫性胶质瘤相关的常见症状包括癫痫、神经认知改变和颅内压升高的体征,目前的标准治疗包括替莫唑胺化疗、放疗和手术。然而,即使治疗不断改进,一些胶质瘤亚型的预后仍然相当糟糕,胶质母细胞瘤(最常见的原发性中枢神经系统恶性肿瘤)的中位生存期不到 2 年。磁共振成像(MRI)是一种无创的查看颅内病变的方法,可以在疾病管理的早期发现基于影像学的预后因素。通过术前 MRI 诊断的瘤内出血在脑肿瘤患者偶尔看到。尽管瘤内出血的发生频率低于上述胶质瘤其他常见症状(胶质母细胞瘤为 2.5%),但它可能是胶质瘤的首发体征,并可能导致不良结局。
然而,肿瘤相关出血对患者预后的确切影响仍不清楚,考虑到新发布的 2021 世界卫生组织分类(WHO CNS 5 分类),这令人失望。这些诊断标准强调遗传和分子特征,但忽略了出血。此次更新还更改了特定肿瘤类型的分类。例如,先前分类中的 WHO II-III 级 IDH 野生型星形细胞瘤,如果存在 EGFR 扩增、染色体 +7/-10 或 TERT 启动子突变,则在最新分类中升级为胶质母细胞瘤。相应地,不同胶质瘤亚型的出血发生率现在也可能在诊断上重新分类。因此,迫切需要对胶质瘤相关出血进行更新探索,这可能为具有不同分子和临床特征的患者的临床管理分层提供有价值的见解。
除了对瘤内出血的临床意义的争议外,与较高出血风险相关的肿瘤类型也尚不清楚。以前的研究采用了较早的 2016 WHO 分类或分析了异质性患者群体,包括原发性和转移性脑肿瘤。尽管有证据表明,在脑转移患者中,术前瘤内出血是生存时间较短的独立预测因子 ,但缺乏与胶质瘤相关的瘤内出血的大型同质队列研究。了解出血如何影响胶质瘤患者的结局尤为重要,因为瘤内出血可能是某些胶质瘤亚型(如胶质母细胞瘤(GBM))的首发表现。
迄今为止,只有少数研究关注胶质瘤相关瘤内出血,并且其中大多数采用旧的 2016 WHO 分类,患者群体存在异质性。因此,本研究旨在根据新的 WHO 分类,确定不同胶质瘤亚型中瘤内出血的发生率,并确定出血患者不同于非出血患者的分子和临床特征。本研究仅针对原发性脑肿瘤大队列,为潜在的出血相关分子标志物作为生存预测因子提供可靠的见解,为临床管理提供指导。
研究结果
有和无瘤内出血的胶质瘤患者的基线特征
回顾了 2011年1月至 2022年1月在北京协和医院神经外科接受手术且病理证实为胶质瘤的患者的临床资料和影像学结果。根据术前磁共振成像将患者分为出血组和非出血组。纳入了 457 例影像学资料全面的胶质瘤患者,包括 67 例(14.7%)瘤内出血患者。入组患者中,男性 263 例,出血患者 58.2% 为男性。所有患者的中位年龄为 49.0 岁,出血患者年龄大于非出血患者(53.0 vs. 48.0,p = 0.012)。出血组患者的术前中位 Karnofsky 体能状态评分(KPS)为 80,差于非出血组的 90(p = 0.015)。在临床表现方面,神经功能损伤在两组中均是最常见的症状,但在出血组中的发生率往往更高(74.6% vs. 53.9%,p = 0.002)。颅内压增高在非出血组中更常见(28.4% vs. 45.5%,p = 0.013)。两组间肿瘤生长存在显著差异,出血组 Ki-67 较高(20% vs. 10%,p = 0.001)。两组之间的组织学分级或 WHO CNS 5 分类没有差异。胶质母细胞瘤,IDH 野生型是出血组中最常见的胶质瘤亚型(33/67, 57.9%)。详细信息如表 1 所示。
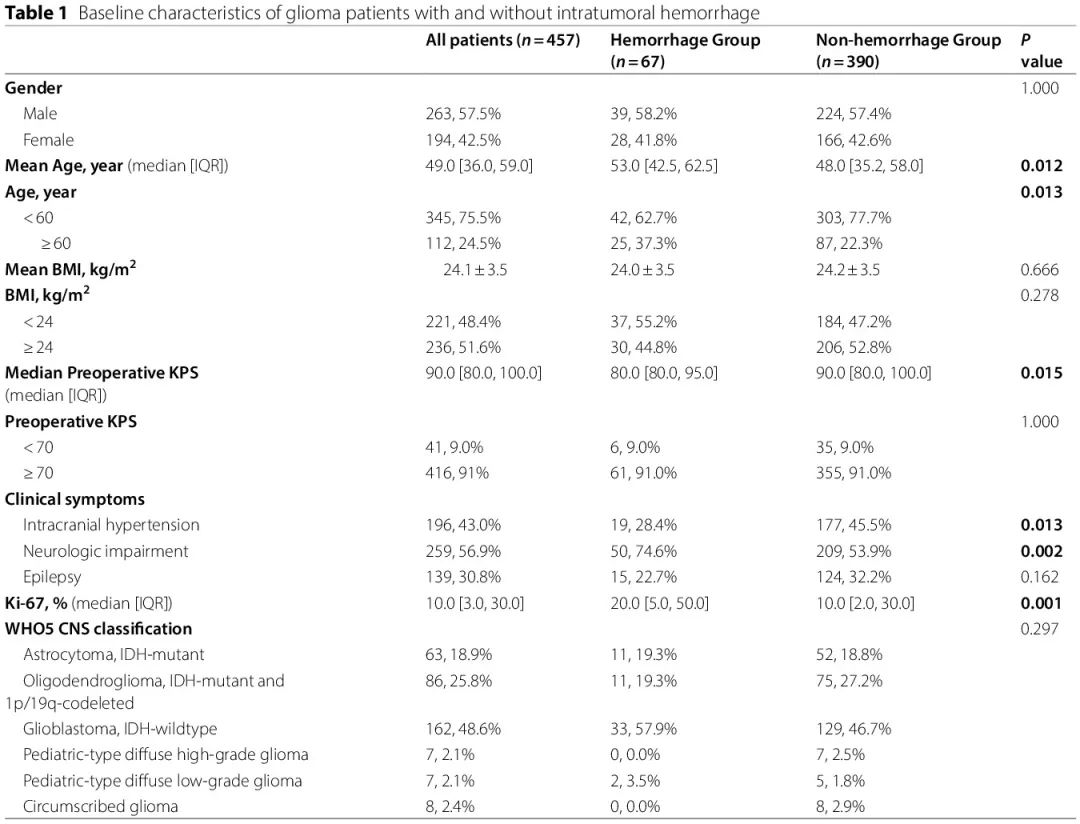
表1
有和无瘤内出血的患者的生存状况和亚组分析
分析有和无瘤内出血的患者的生存状况,发现两组患者的中位总生存期(mOS)分别为 18.4 个月和 39.1 个月,瘤内出血患者的预后显著差于非出血组(p = 0.010,图 1)。进一步的亚组生存分析显示,显著影响无出血患者预后的基线因素在出血组中较少见,包括年龄、KPS 评分和病理亚型。在非出血组中,60 岁以上、KPS 小于 70 和胶质母细胞瘤患者的生存时间往往较短(p < 0.001,p < 0.001 和 p = 0.002)。在出血组中,年龄和 WHO CNS 5 分类对患者预后无显著影响(p = 0.728 和 p = 0.125),而 KPS < 70 导致预后显著较差(p = 0.029)。
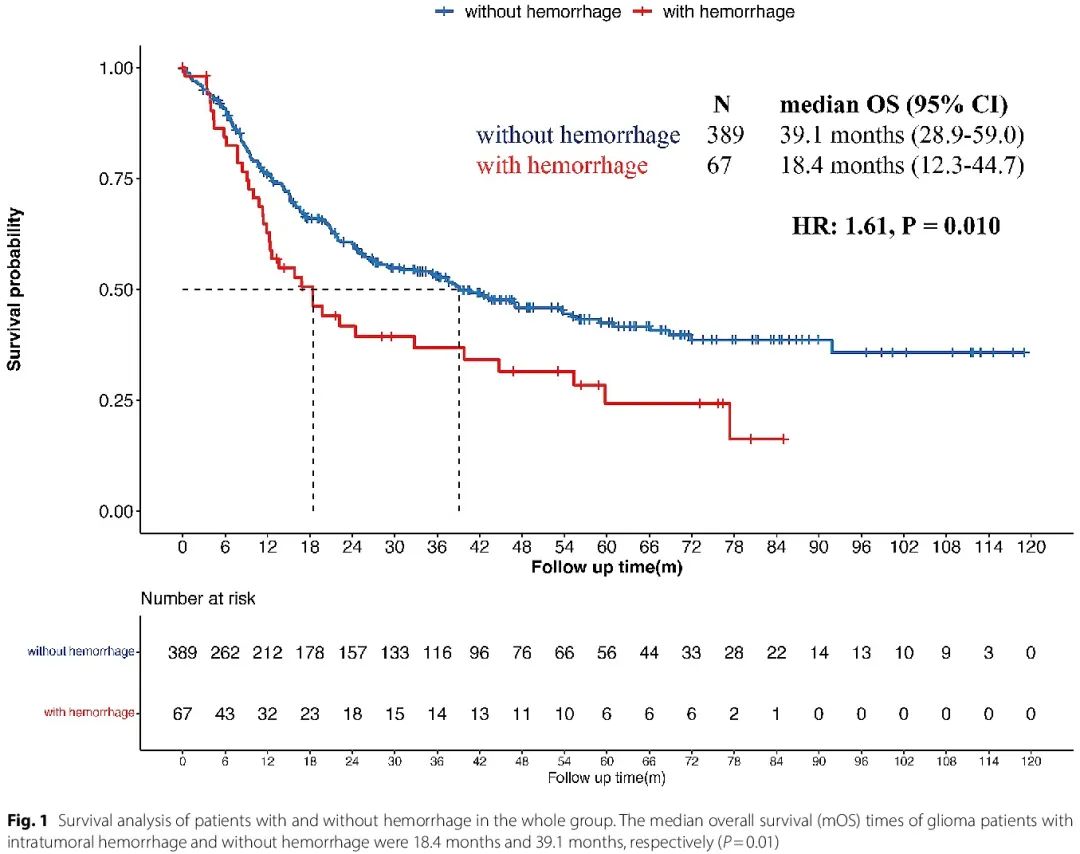
图1
此外,在星形细胞瘤,2 或 3 级和 4 级以及少突胶质细胞瘤中,出血组和非出血组之间的 OS 不存在显著差异(p = 0.075、p = 0.067 和 p = 0.797)。在胶质母细胞瘤患者中,出血患者的 mOS 显著较低(11.3 个月vs 15.2 个月,p = 0.017,图 2)。
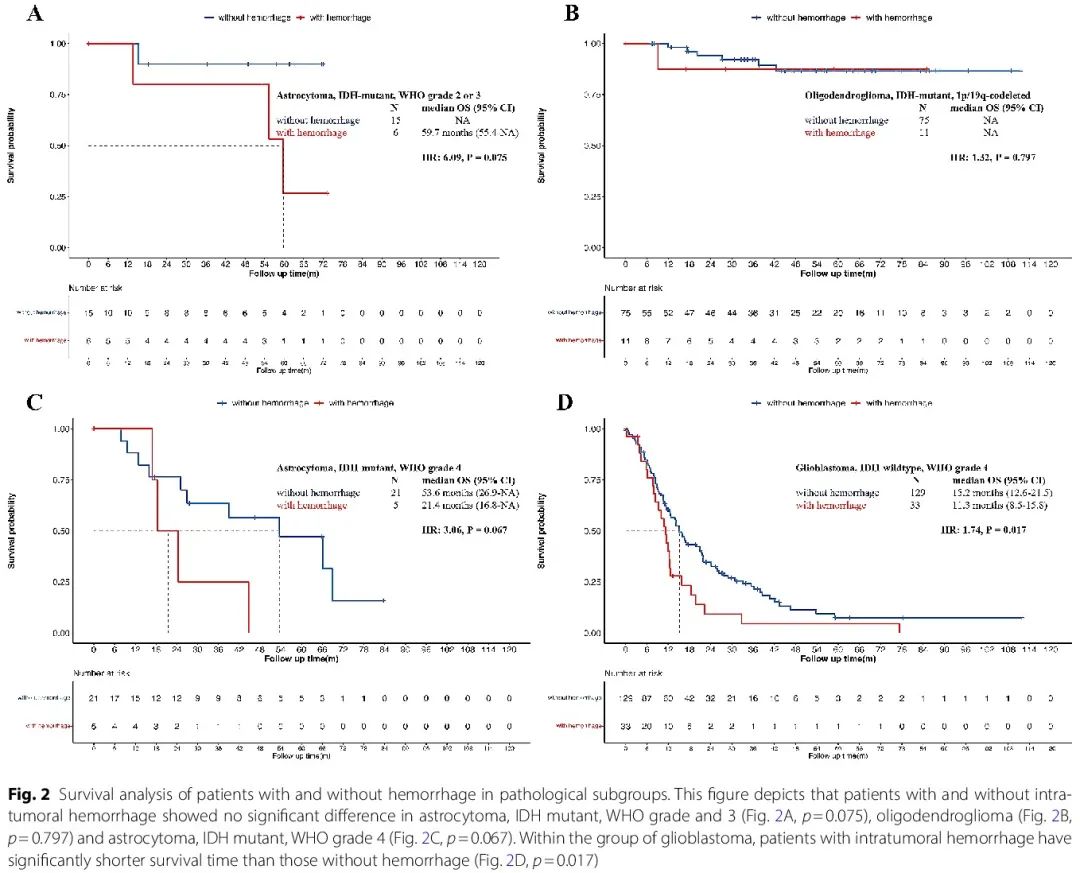
图2
与生存相关的临床特征的单变量和多变量分析
使用 Cox 回归确定对胶质瘤患者生存有显著影响的变量。在星形细胞瘤(IDH 突变型,WHO 2 级和 3 级)、少突胶质细胞瘤(IDH 突变伴 1p/19q 共缺失型,WHO 2 级和 3 级)和星形细胞瘤(IDH 突变型,WHO 4 级)亚组分析中,Cox回归结果显示,出血对预后无显著影响。在 GBM 患者亚组分析中,单变量 Cox 回归分析表明,瘤内出血是与预后较差相关的显著不良危险因素(HR = 1.7,p = 0.018,图 3A)。在多变量分析中,术前 KPS 和瘤内出血是显著的独立危险因素,瘤内出血是不良预后因素(HR = 1.72,p = 0.026,图 3B 和 C)。
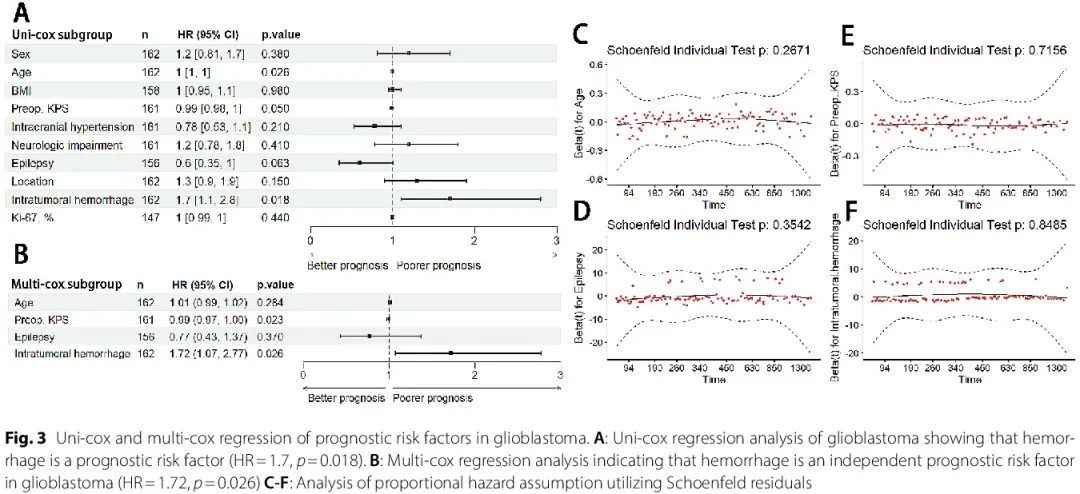
图3
瘤内出血患者的分子特征
使用NGS、PCR 和 FISH 分析了患者的分子改变。有和无出血组的分子改变总结于表 2 和图 4。167 例患者具有全面的分子特征:出血组 32 例,非出血组 135 例。两组之间的 CDKN2B、KMT5B 和 PIK3CA 改变存在显著差异,出血组的改变率更高(CDKN2B,84.4% vs. 62.2%,p = 0.029;KMT5B,25.0% vs. 8.9%,p = 0.029;PIK3CA,81.3% vs. 58.5%,p = 0.029),提示这些分子改变可能与瘤内出血的发生和潜在机制有关。两组间其他分子改变没有显著差异(表 2)。
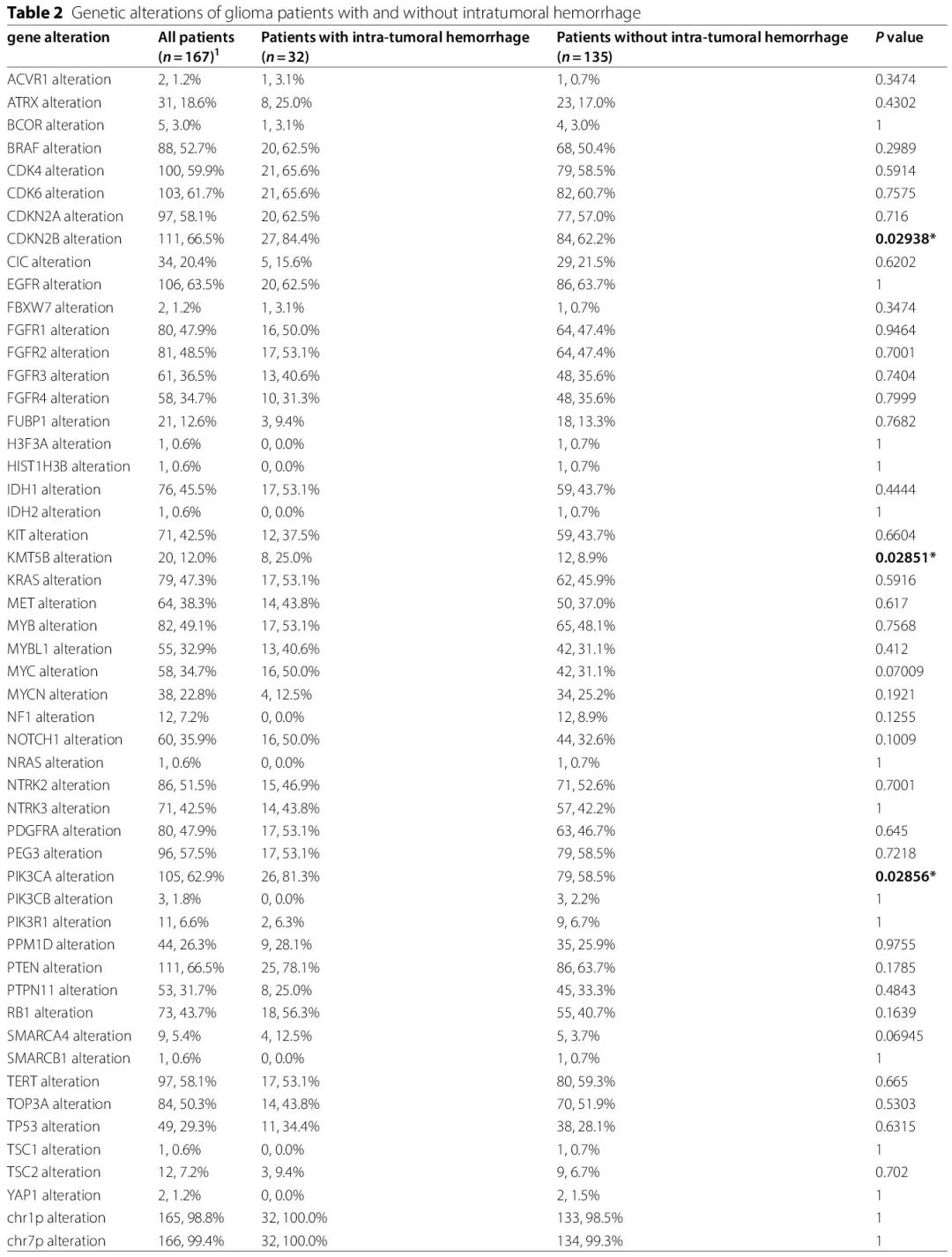
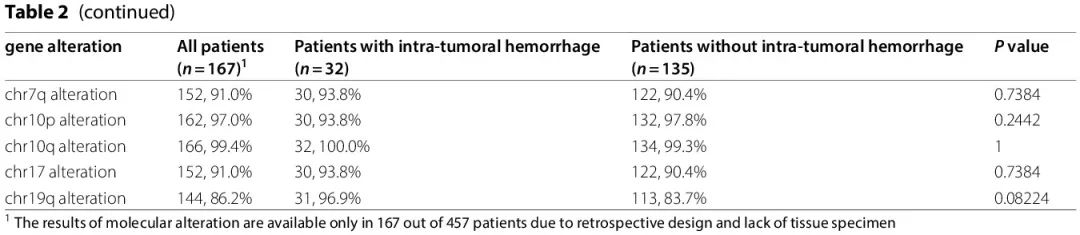
表2
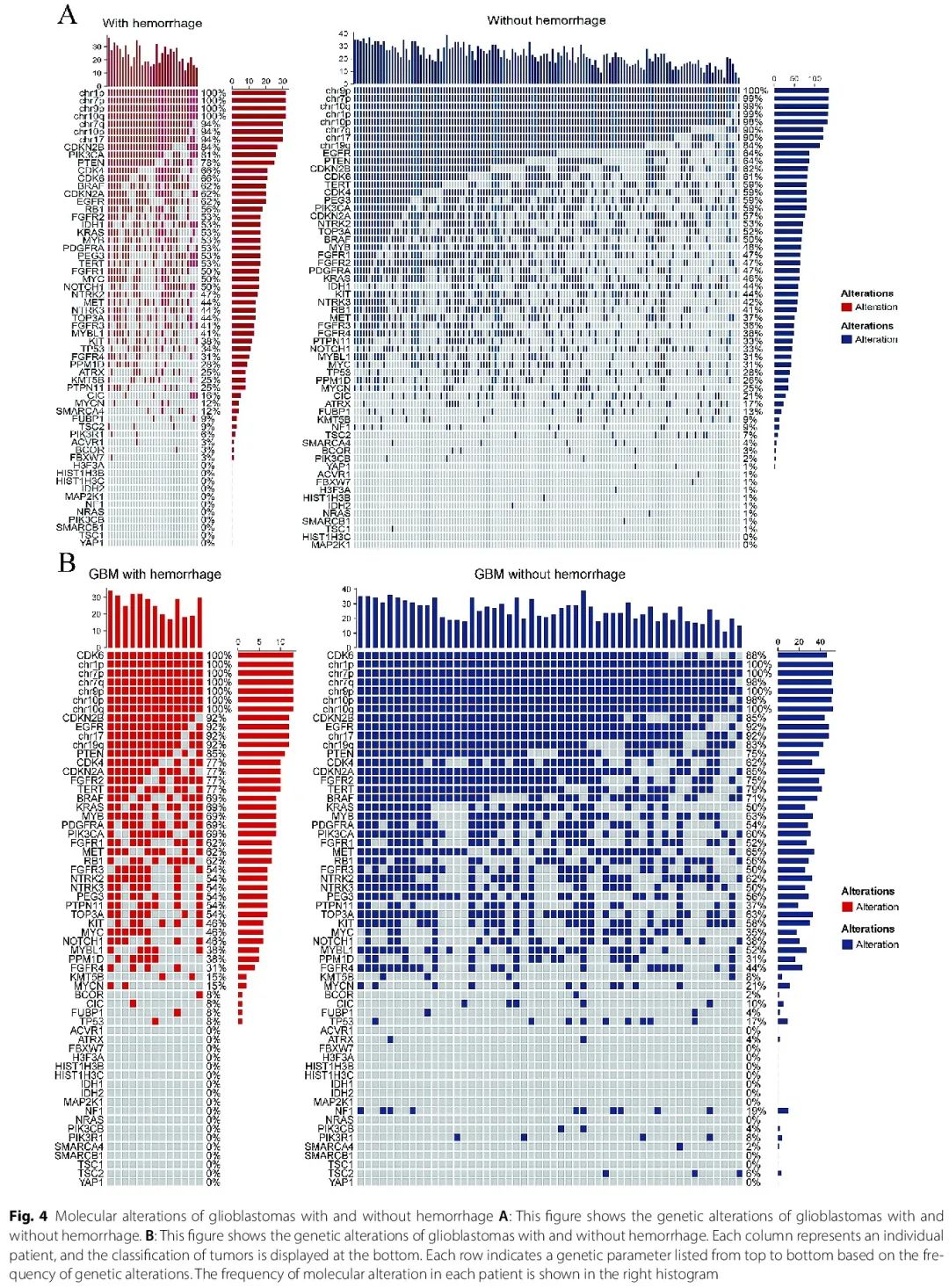
图4
分子改变对瘤内出血患者生存的影响
由于分子改变对胶质瘤患者预后的统计学意义,还进行了 Kaplan-Meier 生存分析,以阐明在有和无出血患者中,分子标志物与生存时间的相关性,为预后预测和更明智的临床决策寻找潜在线索。在出血组和非出血组中,CDK6、EGFR 和 FGFR2 分子改变均与较短的总生存时间相关(图 5)。CDKN2A/B、FGFR3、MET、MYB、MYBL1、IDH1 和 TERT 改变在非出血组中显示出预后意义,在出血组中没有差异。此外,在两组中未观察到其他分子改变与患者生存时间的相关性。
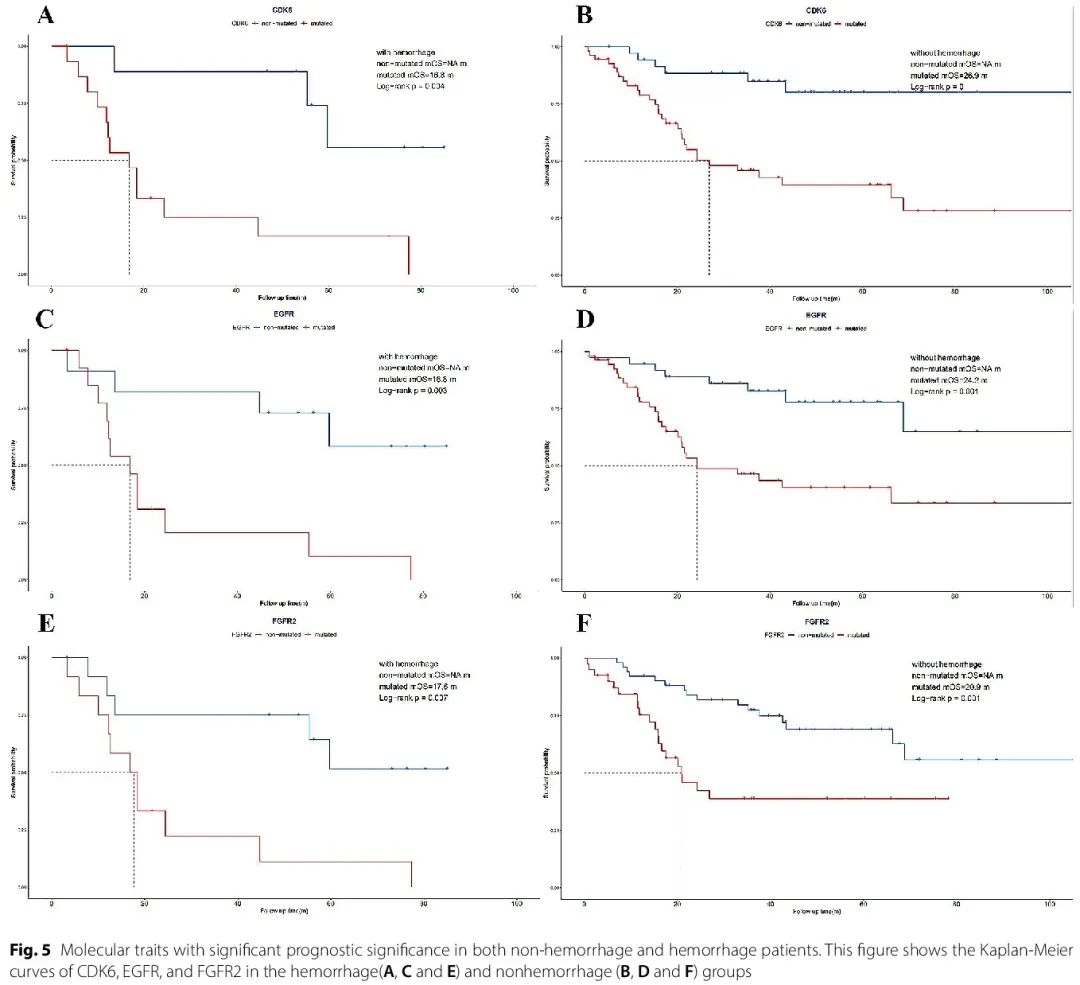
图5
使用临床和影像学特征构建出血预测模型
由于瘤内出血是胶质瘤患者的显著不良预后因素,使用 Cox 回归分析来筛选特征并构建模型来预测胶质瘤患者瘤内出血的存在(图 6A)。混杂T1信号、高血压、囊性病变和坏死的患者往往存在瘤内出血。然后将该模型应用于研究队列,可以将出血患者与非出血患者区分开来(图 6B)。
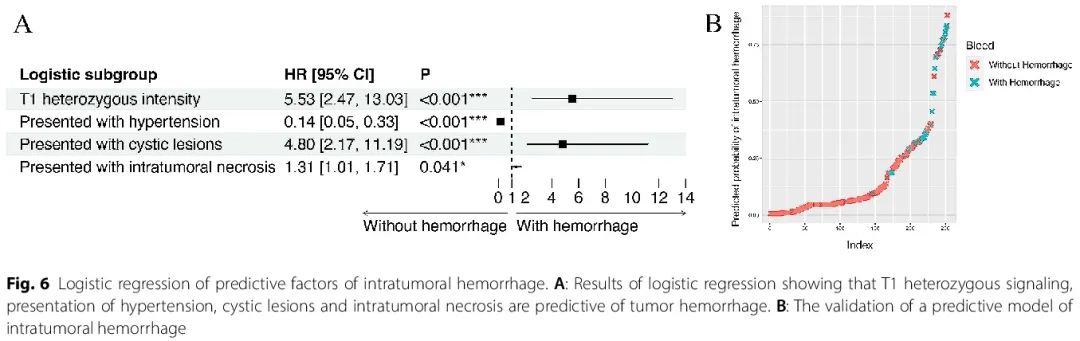
图6
讨 论
本研究采用术前 MRI 揭示胶质瘤中瘤内出血的发生率及其对生存的消极影响。令人惊讶的是,亚组分析显示,术前瘤内出血掩盖了通常与较差预后相关的其他因素,提示术前瘤内出血可能是更关键的临床指标。此外,我们确定了几个在两组中均可能与预后较差相关的分子改变,包括 CDK6、EGFR 和 FGFR2 改变。最后,各种临床表现和分子改变与瘤内出血发生率较高相关,例如较高的 Ki-67 水平以及 CDKN2B、KMT5B 和 PIK3CA 改变,这可能是未来术前瘤内出血研究的潜在靶点。
本研究中 14.7% 的胶质瘤患者术前影像学显示瘤内出血。这与文献中报道的比例相似,再次证实瘤内出血在胶质瘤患者中并不罕见。然而,既往研究通常将所有类型的脑肿瘤合并为一组,并且未在亚组分析中包括遗传和分子特征。本研究根据更新的 2021 年 WHO 5 分类对患者进行分类,从而提供更具临床相关性的有关出血影响的研究结果。与既往数据相比,在原发性脑肿瘤中,较高的肿瘤级别和星形细胞瘤/胶质母细胞瘤与瘤内出血发生率最高相关。然而,以前关于瘤内出血的研究主要集中在转移性脑肿瘤上,很少关注原发性脑肿瘤。相比之下,本研究仅包括成人弥漫性胶质瘤患者,因此,我们的结果可以更准确地反映该特定患者群体的临床结果。综上所述,本研究提供了有关成人胶质瘤患者瘤内出血发生率的最新数据。
本研究的生存分析表明,即使两组术前表现相似,出血组的 Ki-67 显著更高,神经功能损伤更频繁,预后更差(表1)。在单变量和多变量分析中,瘤内出血也是一个独立的预后不良因素(图 3)。这一发现很重要,因为尽管胶质瘤患者的结局可能取决于各种因素,但基于影像学的瘤内出血仍然是独立的不良预后因素,突出了将此类特征纳入临床管理的考量中。此外,出血的这种消极影响可用于临床上帮助预测结局。例如,Kong 等人应用基于肿瘤微出血特征的磁敏感加权成像来区分低级别胶质瘤和高级别胶质瘤。更重要的是,瘤内出血是一种在术前就可以通过无创 MRI 成像轻松发现的特征,提供了个性化管理的机会。我们的研究结果支持瘤内出血的预测价值以及使用简单无创成像对胶质瘤患者进行术前分层。
有趣的是,在亚组分析中,通常与预后较差相关的因素,例如较低的 KPS、高龄和胶质母细胞瘤,对瘤内出血结局的预测性降低。这提示出血可能是较差生存的独立预测因子,其影响超过了年龄、KPS 和 WHO 分类。这突出了临床管理调整对该胶质瘤患者亚组的重要性。一些研究人员推荐对恶性胶质瘤进行抗血管生成治疗,但其有效性,尤其是对已经出现瘤内出血的患者,仍有待确定,需要进一步研究。
此外,本研究表明,细胞增殖指标 Ki-67 在出血组和非出血组之间存在显著差异(表 1);然而,Cox 分析(图 3)显示其为非独立风险因素(p = 0.440),提示细胞增殖可能与瘤内出血有关。这与一项既往研究一致,该研究显示,具有不同微血管模式的胶质母细胞瘤具有显著不同的 Ki-67 指数和生存时间。高增殖活性和高耗氧量更可能导致肿瘤缺氧,刺激 HIF-1α 过表达,从而促进血管生成。既往研究报道,微血管的强度随着星形细胞瘤分级的增加而增加,不同级别的胶质瘤具有不同的新生血管。血管生成和新生成的血管缺乏紧密连接且脆弱,增加了血管破裂和出血的风险。这些结果表明,血管生成是 Ki-67 与肿瘤相关出血之间相关性的潜在原因。
考虑到高级别胶质瘤的增殖更高,出血与胶质瘤分级或分类无关令人惊讶(表 1)。然而,出血组的高级别胶质瘤比例较高(表 1)。胶质母细胞瘤和星形细胞瘤的出血发生率也高于少突胶质细胞瘤(表 1)。星形细胞瘤的发生率较高可能是因为 53.2% 为 4 级。不显著可能是由于样本量小,值得进一步探索。
考虑到瘤内出血与较差的预后相关,识别与出血相关的生物标志物至关重要。CDKN2B、KMT5B、MAP2K1、PIK3CA 和 chr9p 改变与出血有关(表 2),这可能是由于它们中的大多数影响胶质瘤细胞增殖和侵袭。KMT5B 编码一种组蛋白赖氨酸甲基转移酶(KMT),使用 H4K20me1 为底物,产生 H4K20me2。既往研究表明,KMT5B 过表达降低胶质母细胞瘤细胞的增殖,KMT5B 活性增强可能抑制内皮细胞中 VEFGR2 的表达。在本研究人群中,所有 KMT5B 改变都是点突变,可能导致功能丧失,这可能解释了为什么瘤内出血患者往往 KMT5B 改变发生率较高。
生存分析确定了以下 3 个在出血组和非出血组中均具有显著预后影响的分子特征:CDK6、EGFR 和 FGFR2。首先,CDK6 是一种与细胞周期调控相关的分子,其突变通常会导致细胞周期蛋白依赖性激酶 6 活性增强和肿瘤生长,这与我们研究的显著预后差异一致。EGFR 和 FGFR2 在肿瘤血管生成中起着重要作用,因此可能增加出血的可能性,进而可能导致预后较差。然而,在本研究中,这两个分子特征引起的预后恶化与出血的存在与否无关,因此,我们推测 EGFR 和 FGFR2 血管生成影响对预后的影响更有可能通过促进肿瘤增殖和迁移而不是出血引起。
10 个基因改变仅影响无出血患者的预后:CDKN2A/B、FGFR3、MET、MYB、MYBL1、IDH1、TERT、PTEN 和 RB1。CDKN2A/B 编码 p16/p15 蛋白,其失活导致肿瘤进展加速。FGFR3 和 MET 在肿瘤生长中起关键作用。MYB 和 MYBL1 调节细胞周期蛋白依赖性激酶的表达,促进癌症发展。然而,野生型 MYB 的过表达不足以完全转化人上皮细胞;它仅在与其他基因改变共存时促进肿瘤发生。IDH1 突变普遍存在,与胶质瘤预后较好相关。TERT 启动子突变可导致 TERT 转录上调和细胞增殖。RB1 和 PTEN 都是细胞的负调节因子。
上述机制表明了这些基因在无出血组中的影响;突变可导致预后的显著差异。然而,在出血组中,我们发现出血可以掩盖这些基因的预后差异,无论它们最初的预后影响如何。特别是,IDH1 和 TERT 对胶质瘤的预后有显著影响,可以用作 CNS 肿瘤分类的明确标准。尽管如此,正如我们之前提到的,它们并不能预测出血患者的生存。因此,在临床环境中应特别关注这些问题,并应开发新的出血患者预后相关分子特征。
最后,我们利用影像学和临床特征构建了一个模型来预测胶质瘤患者瘤内出血的发生。该模型包括可识别的临床表现,例如颅内压增高和瘤内坏死,以辅助早期出血诊断(图 6)。许多研究探索了瘤内坏死对胶质瘤(如 GBM 和少突胶质细胞瘤)患者预后的消极影响。然而,坏死与瘤内出血之间的关联尚未得到探索。在我们的出血预测模型中,坏死是瘤内出血的阳性危险因素。这些成像特征背后是否存在共同的分子机制值得进一步研究。
本研究仍然存在一些局限性。首先,由于本研究是回顾性的,并且瘤内出血是根据影像学表现确定的,而影像学特征和解剖学表现可能存在差异,导致分组时的歧义。未来的研究应探索组织学与影像学定义的瘤内出血之间的患者特征差异。其次,由于本回顾性研究样本小,尤其是出血和非出血组以及分子改变亚组分析的数量不平衡,可能存在潜在的选择偏倚。然而,两组间不平衡的数量也可能突出了胶质瘤患者瘤内出血的固有发生。因此,未来需要对更大的患者群体进行研究来验证我们的结果。第三,我们预先设计了一个分子panel,这对于分析胶质瘤患者的生存至关重要,但是,还有其他分子生物标志物可能与瘤内出血有关,将来,全外显子组测序可能是这个问题的潜在解决方案。
本回顾性队列研究表明,术前瘤内出血的胶质瘤患者预后较差,无论年龄、KPS 或胶质瘤分级如何。CDKN2B、KMT5B 和 PIK3CA 改变在出血组中较常见,提示瘤内出血预后价值的可能机制。此外,在两组中发现了几个共同的预后相关分子改变,需要进一步研究。
参考文献:
Shi Y, Kang X, Ge Y, Cao Y, Li Y, Guo X, Chen W, Guo S, Wang Y, Liu D, Wang Y, Xing H, Xia Y, Li J, Wu J, Liang T, Wang H, Liu Q, Jin S, Qu T, Li H, Yang T, Zhang K, Feng F, Wang Y, You H, Ma W. The molecular signature and prognosis of glioma with preoperative intratumoral hemorrhage: a retrospective cohort analysis. BMC Neurol. 2024 Jun 14;24(1):202. doi: 10.1186/s12883-024-03703-2. PMID: 38877400; PMCID: PMC11177380.
