免疫检查点抑制剂(ICIs)是指南认可的错配修复缺陷或微卫星高度不稳定性(dMMR/MSI-H)mCRC患者的首选,但很大一部分患者经历了原发性或继发性耐药。BRAF V600E突变(BRAFm)和dMMR/MSI-H mCRC可以用BRAF+EGFR抑制剂治疗,但对ICIs治疗发生进展的患者,其疗效具体数据缺失。研究者收集了2017年至2024年间连续接受BRAFi+EGFRi+/-MEKi联合治疗的BRAFm dMMR/MSI-H mCRC患者,这些患者在ICIs治疗后发生疾病进展。一个对照队列为BRAFm pMMR/MSS mCRC患者接受二线的康奈非尼+西妥昔单抗+/-比美替尼治疗。
与pMMR/MSS(n = 170)患者相比,dMMR/MSI-H(n = 50)BRAFm mCRC患者多为>70岁,原发肿瘤位于右侧,无肝脏转移但淋巴结转移较多。这些患者在二线治疗后接受治疗的比例更高,45%是对ICIs原发进展。与pMMR/MSS患者相比,dMMR/MSI-H患者的较低客观缓解率(ORR,18% vs 32%,p = 0.09)和疾病控制率(DCR,60% vs 73%,p = 0.11)均未达到显著性差异。中位随访14.04个月后,两组无进展生存期(PFS,中位5.13个月 vs 4.50个月,HR 0.83,95%CI:0.57-1.20,p = 0.31)和总生存期(OS,中位10.75个月 vs 9.11个月,HR 0.89,95%CI:0.59-1.32,p = 0.55)差异无统计学意义。
本研究结果表明,BRAFm dMMR/MSI-H mCRC患者在ICIs治疗进展后从BRAFi+EGFRi+/-MEKi中获益。尽管ORR和DCR较低,但结局与pMMR/MSS BRAFm CRC中观察到的结局无差异,并且与BEACON注册试验的结局一致。
-
BRAFm dMMR/MSI-H mCRC在对ICIs治疗进展时受益于BRAFi+EGFRi±MEKi;
-
BRAFm dMMR/MSI-H组的ORR/DCR数值低于pMMR/MSS mCRC组;
-
在BRAFm dMMR/MSI-H和pMMR/MSS mCRC中,BRAFi+EGFRi±MEKi的PFS和OS相似;
-
BRAFm dMMR/MSI-H mCRC患者接受BRAFi+EGFRi±MEKi治疗后的严重毒作用发生率较高;
-
BRAFm dMMR/MSI-H mCRC接受BRAFi+EGFRi±MEKi治疗的结局与BEACON试验一致。
研究背景
在过去的十年中,肿瘤分子诊断和药物开发的进步深刻地改变了转移性结直肠癌(mCRC)的治疗。分子分析,即检测最小限度的RAS、BRAF以及MMR/MSI状态,国际指南建议在转移性疾病诊断时进行此项检测,以便确定最佳的前期治疗方案并改善患者的预后情况。对于早期患者,MMR状态也应进行评估,作为Lynch综合征的普遍筛查,并指导辅助治疗策略。近15%的早期CRC和5%的mCRC具有dMMR/MSI-H的特征,这些肿瘤中有30 - 50%的病例与BRAF V600E突变(BRAFm)相关。
BRAFm和同时存在的dMMR/MSI-H状态定义了一种罕见的(约2%)mCRC亚型,该亚型具有独特的临床和病理特征以及多种治疗方案。BRAFm dMMR/MSI-H mCRC是右侧CRC和散发dMMR/MSI-H状态的老年患者的典型表现。从转录组学的角度来看,该亚型通常属于共识分子亚型分类的第1类,其特征是肿瘤基因组的整体高甲基化,称为CpG岛甲基化表型(CIMP),被认为是该亚型的主要肿瘤发生途径。从治疗的角度来看,在KEYNOTE-177研究获得阳性结果之后,针对程序性死亡蛋白-1(PD-1)的免疫检查点抑制剂(ICI)单药治疗成为指南认可的所有dMMR/MSI-H mCRC患者在一线时的首选治疗。ICIs对dMMR/MSI-H mCRC患者的疗效已得到另外两项随机研究的证实,这些研究检测了抗程序性死亡受体配体-1(抗PD-L1)用于二线治疗,或者抗PD-1联合抗细胞毒性T淋巴细胞抗原-4(抗CTLA-4)用于一线治疗。在关键的KEYNOTE-177试验中,BRAFm或野生型肿瘤的肿瘤学结局相似,因此两种肿瘤均在一线接受ICI治疗。然而,相当比例的dMMR/MSI-H mCRC患者对ICIs存在原发性或继发性耐药,根据使用的方案和治疗线,原发性耐药(一般定义为第一次评估CT扫描时的疾病进展)的范围为15%-50%,继发性耐药(一般定义为治疗12个月前的疾病进展)的范围为20-30%。值得注意的是,dMMR/MSI-H型mCRC存在化疗耐药,尤其是BRAFm肿瘤。
根据BEACON试验的结果,BRAFm mCRC患者可以在接受过一线或二线治疗后,接受BRAF抑制剂(BRAFi)康奈非尼和抗表皮生长因子受体单克隆抗体(EGFRi)西妥昔单抗联合治疗。因此,对于接受ICIs治疗后进展的BRAFm dMMR/MSI-H患者,BRAFi+EGFRi可作为一种治疗选择。
由于临床试验和目前可用的真实世界研究中纳入的dMMR/MSI-H和BRAFm患者数量有限,因此无法就这些患者的BRAFi+EGFRi活性和疗效得出合理的结论,并且缺乏ICIs治疗进展后用药顺序的具体数据。
为此,研究者进行了一项国际研究,收集了那些罕见的BRAFm dMMR/MSI-H mCRC患者,这些病例在ICIs治疗期间疾病进展后接受BRAFi+EGFRi+/-MEK抑制剂(MEKi)联合治疗。研究者描述了这些患者的特征和结局,并与之前建立的欧洲队列进行了比较,该队列包括接受康奈非尼+西妥昔单抗联合治疗(联合或不联合MEKi比美替尼)的BRAFm pMMR/MSS的mCRC患者。
研究结果
患者人群:
共220例BRAFm mCRC患者,包括50例dMMR/MSI-H患者和170例pMMR/MSS患者,纳入分析。在全球范围内,134例患者(61%)分别通过IHC和PCR对其肿瘤进行了MMR和MSI检测,而54例患者(24%)仅进行了MMR检测,32例患者(15%)仅进行了MSI检测。在使用两种方法检测的患者中,未发现MMR和MSI状态之间的数据不一致。
患者的主要基线特征见表1。与pMMR/MSS患者(25%)相比,dMMR/MSI-H mCRC患者年龄更大,52%(26/50)的患者年龄在70岁以上,更多的患者原发肿瘤位于右侧(98% vs 57%),有淋巴结转移(54% vs 25%)和无肝转移(64% vs 41%)。dMMR/MSI-H mCRC患者二线治疗后接受BRAFi+EGFRi+/-MEKi治疗的比例更高(70% vs 37%)。7例(14%)dMMR/MSI-H和12例(7%)pMMR/MSS患者接受了三联方案(BRAFi+EGFRi+MEKi)治疗。在dMMR/MSI-H患者中,86%的患者既往接受的免疫治疗是抗PD-1单药治疗。
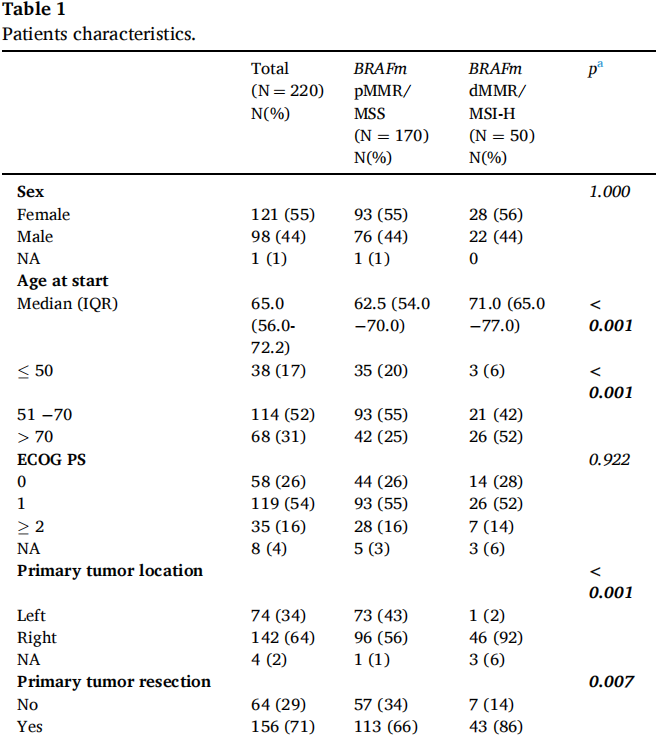
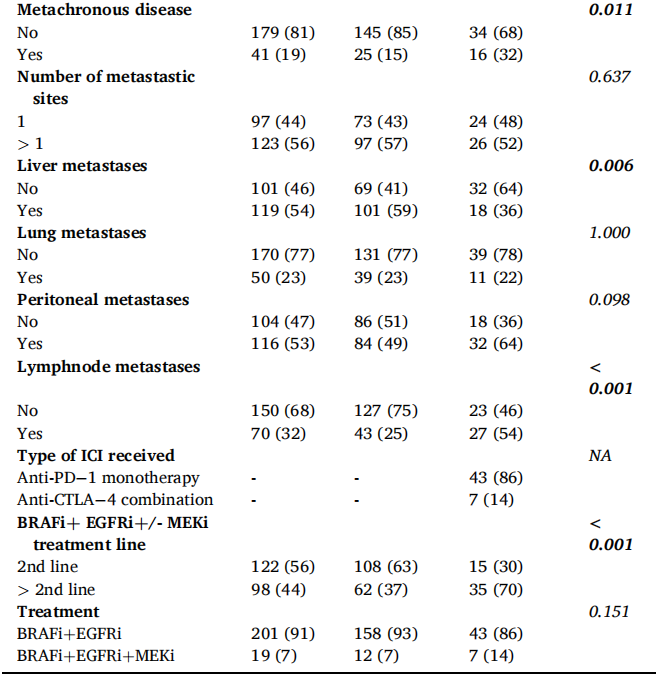
表1
BRAFi+EGFRi+/-MEKi的肿瘤学结局:
在dMMR/MSI-H mCRC队列和pMMR/MSS队列中,可获得RECIST 1.1反应数据的患者比例分别为80%(40/50)和89%(152/170)。表2总结了BRAFi+EGFRi+/-MEKi的肿瘤学结局。
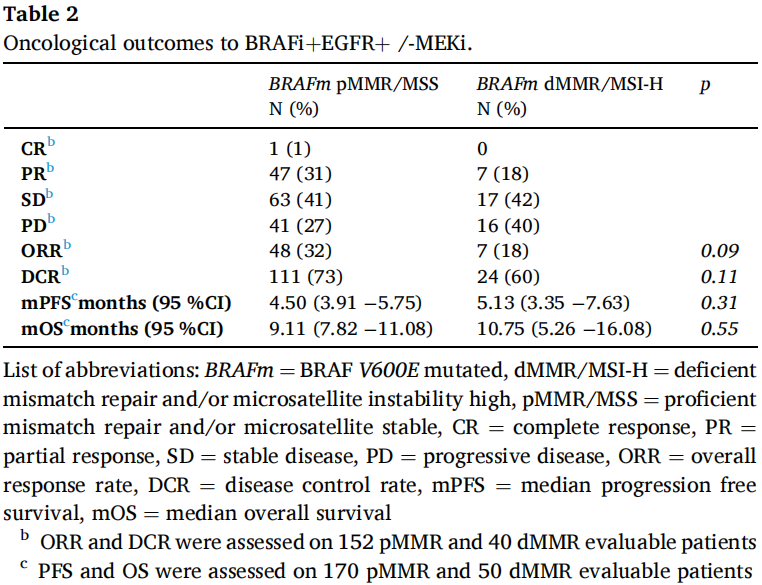
表2
在BRAFm dMMR/MSI-H的mCRC患者中,与pMMR/MSS相比,虽然没有达到统计学显著性(ORR 18% vs 32%,OR 0.46,95%CI:0.18-1.06,p = 0.09和DCR 60% vs 73%,OR 0.55,95%CI:0.27-1.16,p = 0.11),但观察到ORR和DCR有较低的趋势。中位随访PFS 13.22个月(IQR: 6.90-21.17)后,dMMR/MSI-H和pMMR/MSS mCRC患者之间无统计学差异(HR 0.83,95%CI: 0.57-1.20, p = 0.31,图1A)。dMMR/MSI-H组和pMMR/MSS组的中位PFS分别为5.13个月(95%CI:3.35-7.63)和4.50个月(95%CI:3.91-5.75)。中位随访OS 14.04个月(IQR:7.59-21.34)后,dMMR/MSI-H患者的OS与pMMR/MSS mCRC患者相比无统计学差异(HR 0.89,95%CI:0.59-1.32, p = 0.55,图1B)。dMMR/MSI-H组和pMMR/MSS组的中位OS分别为10.75个月(95%CI:5.26-16.08)和9.11个月(95%CI:7.82-11.08)。在对两组间存在显著不平衡的基线特征(即治疗开始时的年龄,原发肿瘤侧别,原发肿瘤切除,异时性疾病,肝和淋巴结转移,以及治疗线)进行校正后,dMMR/MSI-H和pMMR/MSS mCRC患者的PFS和OS仍然没有差异(PFS的校正HR 0.94,95%CI:0.60-1.48,p = 0.79);OS的校正HR 0.87,95%CI:0.53-1.41,p = 0.57)。当分析仅考虑接受目前BRAFi+EGFRi标准双重组合治疗的患者时,研究者发现PFS和OS与在整个人群中观察到的结果非常相似,无论是在未校正的比较中(PFS的HR 0.76,95%CI:0.51-1.12,p = 0.17;OS的HR 0.79,95%CI:0.51-1.23,p = 0.29),还是校正显著不平衡的基线特征后的比较(PFS的HR 0.82,95%CI:0.51-1.32,p = 0.42;OS的HR 0.71,95%CI:0.42 - 1.21,p = 0.21)。
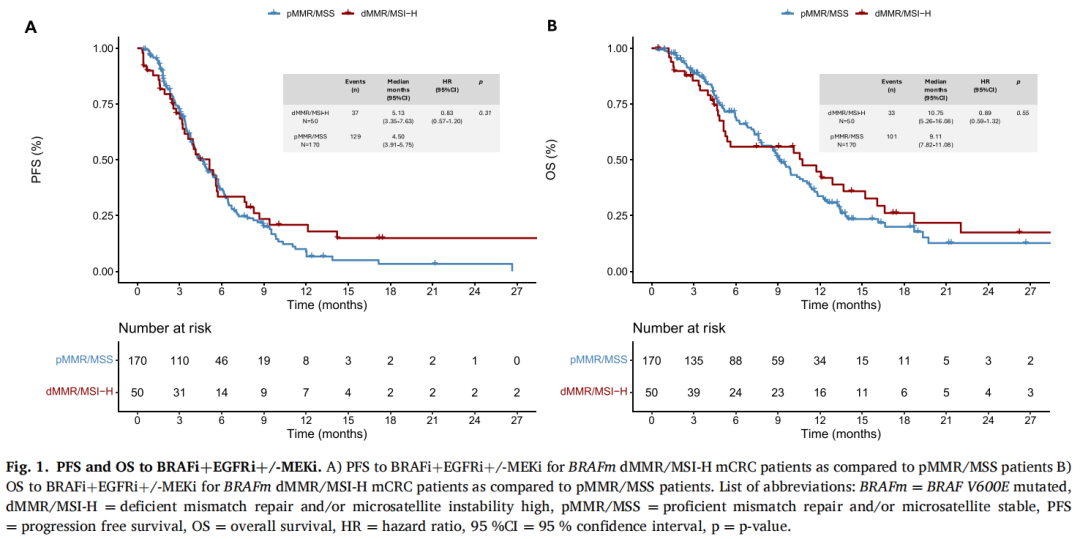
图1
在dMMR/MSI-H和pMMR/MSS mCRC患者中,比较二线或二线以上BRAFi+EGFRi+/-MEKi治疗的生存结局时结果也一致,未观察到差异。在pMMR/MSS队列中,与二线以上治疗的患者相比,二线治疗患者的OS较长,但PFS未见延长。对于二线或二线以上接受BRAFi+EGFRi+/-MEKi治疗的患者,在dMMR/MSI-H队列中未发现PFS有显著差异。
依据对免疫疗法的反应情况来看BRAFi+EGFRi±MEKi的治疗结局:
在BRAFm dMMR/MSI-H队列中,47%(23/49)的RECIST 1.1可评估人群对ICIs的最佳反应为PD,45%(n = 22/49)被定义为原发性进展(因为1例PD患者出现假性进展)。ICIs的ORR为31 % (15/49),DCR为53 %(26/49)。ICIs的中位PFS为3.09个月(95%CI:2.56-5.75)。图2总结了每例患者接受ICIs和BRAFi+EGFRi+ /-MEKi顺序治疗的时间。
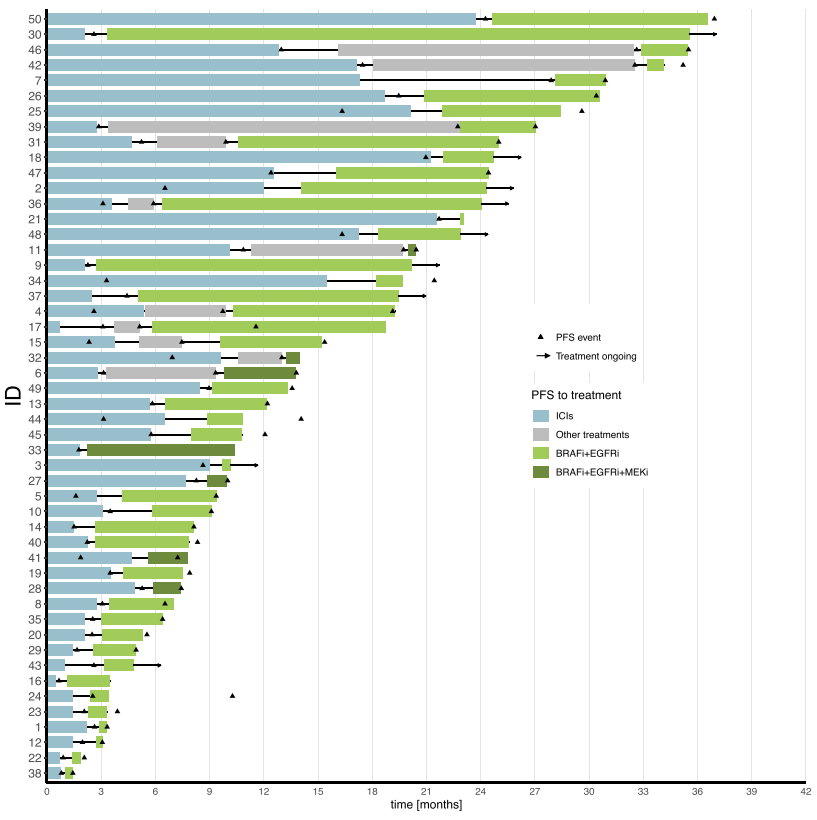

图2
然后,研究者根据患者对ICIs的反应研究了BRAFi+EGFRi+/-MEKi治疗患者的结局。在接受ICI治疗后立即出现PD或有临床获益的患者中,观察到相似的PFS(p = 0.80)和OS(p = 0.72)。
BRAFm dMMR/MSI-H mCRC的单变量和多变量分析:
研究者评估了已知的预后因素对BRAFm dMMR/MSI-H mCRC患者BRAFi+EGFRi+/-MEKi治疗结局的影响。在单变量分析中,与生存率显著相关的因素是年龄< 50岁(PFS较短)和三联疗法(BRAFi+EGFRi+MEKi)(OS较短)。在多变量模型中,年龄<50岁仍然是PFS(HR 6.53,95%CI:1.75-24.33,p = 0.005)和OS(HR 3.66,95%CI: 1.05-12.69,p = 0.026)的独立不良预后因素,而BRAFi+EGFRi+MEKi治疗与较短的OS相关(HR 2.68,95%CI:1.13-6.39,p = 0.026)(表3)。
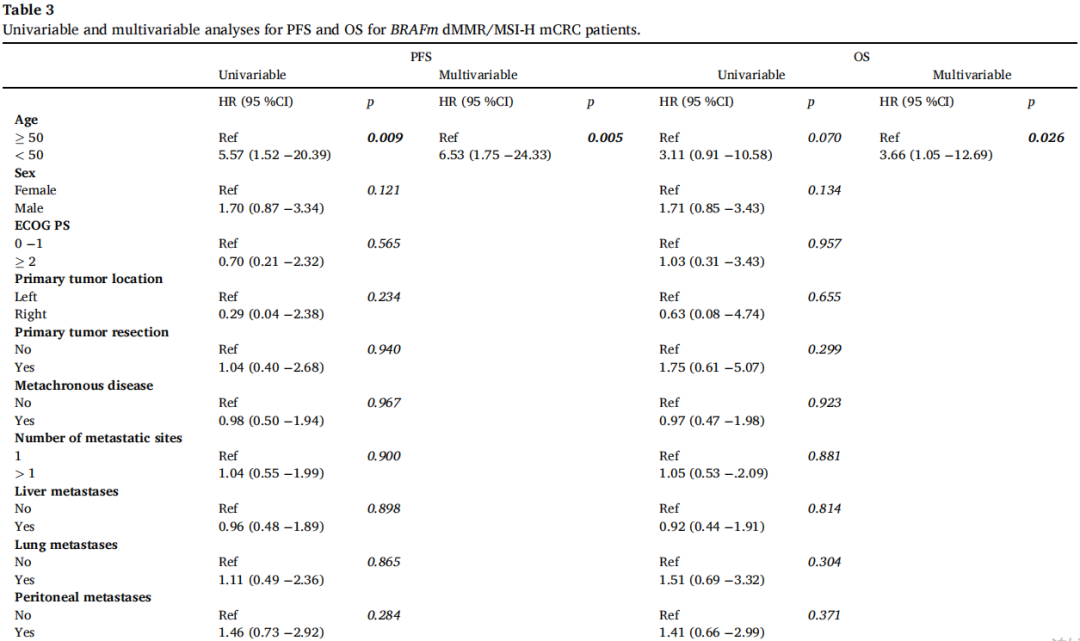

表3
治疗耐受性:
在BRAFi+EGFRi±MEKi治疗的情况下,46名dMMR/MSI-H患者以及167名pMMR/MSS患者中出现3级/4级不良事件(G3/4 AEs)的发生率是可获得的。在BRAFi+EGFRi+/- MEKi治疗的情况下,20例(43%)dMMR/MSI-H和29例(17%)pMMR/MSS患者发生了G3/4级不良反应(p < 0.001)。dMMR/MSI-H患者更易出现乏力,恶心呕吐和EGFRi过敏反应发生率更高。两组的BRAFi减量率相似,但dMMR/MSI-H组的BRAFi停药率高于pMMR/MSS组(11% vs 3%,p = 0.03),EGFRi减量和停药率也高于pMMR/MSS组(13% vs 4%,p = 0.04;9% vs 2%,p = 0.06)。
讨 论
在过去10年中,mCRC的治疗格局发生了巨大变化。ICIs和BRAFi+EGFRi联合疗法于2020年获批,几乎同时获批于dMMR/MSI-H和BRAFm mCRC。因此,由于dMMR/MSI-H mCRC对ICIs非常敏感,肿瘤同时存在这两种分子变异的患者的治疗序列数据非常少。据研究者所知,这是第一项在既往接受过ICIs治疗的BRAFm dMMR/MSI-H mCRC患者中报告BRAFi+EGFRi+/-MEKi疗效和安全性的重要系列研究。
在本队列中,与BRAFm pMMR/MSS mCRC患者相比,dMMR/MSI-H患者年龄更大,超过50%的患者年龄超过70岁,这与BRAFm肿瘤中MMR缺陷的散发病因有关,这种病因与CpG岛甲基化表型(CIMP)以及MLH1启动子高度甲基化相关,并且随后林奇综合征年轻患者大多集中在这一群体之外。考虑到BRAFm和dMMR/MSI-H在近端结肠中相对较高的频率,正如预期的那样,右侧原发肿瘤占主导地位。MSI-H与MSS mCRC的转移范围不同,肝脏转移较少,淋巴结转移较多,这与文献中MSI-H和MSS mCRC一致。
在肿瘤结局方面,dMMR/MSI-H mCRC患者的PFS和OS与pMMR/MSS患者无显著差异,ORR和DCR尽管数值上较低,但未达到统计学意义。BRAFm dMMR/MSI-H mCRC患者队列比pMMR/MSS患者队列有更多线的治疗,这可能解释了两组之间观察到的ORR和DCR的差异。然而,在对康奈非尼+西妥昔单抗+/-比美替尼进行评估的BEACON注册试验中,既往治疗线数与ORR或DCR无关。
当在BRAFi+EGFRi+/-MEKi治疗dMMR/MSI-H患者中观察与较差的OS和PFS独立相关的预后因素时,令人惊讶的是只有年龄< 50岁和三联疗法显著。据研究者所知,这些结果以前没有报道过,可能受到少数相关患者(分别为3例和7例)的影响。
在dMMR/MSI-H患者中,BRAFi+EGFRi+/-MEKi治疗的总体疗效结果与注册BEACON试验在ORR、DCR、PFS和OS方面一致。
实体肿瘤的转化研究揭示了抑制PD-1/CTLA-4和MAPK通路之间存在协同作用,并证明对MAPK抑制剂(MAPKi)的反应至少部分是免疫介导的。在黑色素瘤中对ICIs和BRAFi+MEKi的顺序进行评估的临床试验表明,与反向顺序相比,一线使用ICIs时OS更长,这与预先的抗肿瘤免疫激活可能正向影响MAPKi的活性这一假设相一致。在本研究中,BRAFm dMMR/MSI-H和未经ICIs治疗的pMMR/MSS mCRCs的相似结局可能提示免疫治疗既没有诱导dMMR/MSI-H患者对BRAFi+EGFRi+ /-MEKi策略的耐药,也没有增强其敏感性。然而,没有一个队列,即BRAFm dMMR/MSI-H mCRCs患者接受过BRAFi+EGFRi+ /-MEKi治疗,并且没有既往的免疫治疗,因此研究者无法完全回答这些问题。
在未来,优化BRAFm dMMR/MSI-H mCRCs这一特定亚组的治疗结局的一种方法可能是预先联合所有治疗。目前正在进行中的II期随机试验SEAMARK(NCT05217446)正在探索这一问题,该试验评估了在抗PD-1帕博利珠单抗标准治疗的基础上加用康奈非尼+西妥昔单抗作为一线治疗。之前,在BRAFm mCRC中联合PD-1、BRAFi和MEKi进行的一项概念验证试验揭示了两种途径之间存在协同机制,并报道了较高的ORR,克服了mCRC中BRAFi+MEKi的历史。虽然BRAFi+MEKi对mCRC患者并不理想,但这些数据提示,在增强这些治疗之间的协同作用和可能预防早期耐药方面,联合应用而不是抗PD-1和MAPKi的顺序应用可能更有益。
与pMMR/MSS患者相比,dMMR/MSI-H患者的治疗耐受性更差,有更高的G3/4 AEs发生率和停药率。这可能与dMMR/MSI-H患者年龄较大、既往治疗线数较多有关;在治疗这些患者时,可采取密切监测和预防性或支持性措施。
本研究的局限性在于其回顾性性质,以及dMMR/MSI-H患者数量有限,这反映出该亚组在mCRC中的罕见性,以及在较早的治疗线中,免疫治疗可能对疾病产生长期控制。此外,比较的两个队列在特征和治疗顺序上是异质的,可能会引入统计偏倚。由于dMMR/MSI-H患者数量较少,本研究结果应谨慎解读,并需要更大样本的验证。
然而,这是迄今报道的最大的BRAFm dMMR/MSI-H mCRC患者队列,这些患者在对ICIs治疗进展后从BRAFi+EGFRi+/-MEKi中获益,与pMMR/MSS mCRC患者相似。研究报告的疗效和安全性与BEACON注册试验的结果一致,BEACON试验将康奈非尼和西妥昔单抗用于至少接受过一线治疗的BRAFm mCRC患者。本研究结果也与真实世界中使用康奈非尼+西妥昔单抗+ /-比美替尼治疗BRAFm mCRC患者(无论其MSI状态如何)的数据一致。因此,研究者认为,这些结果具有临床意义,可以证明在接受ICIs治疗期间发生进展的BRAFm dMMR/MSI-H mCRC患者中使用BRAFi+EGFRi+/-MEKi是合理的。
参考文献:
Ambrosini M, Tougeron D, Modest D, et al. BRAF + EGFR +/- MEK inhibitors after immune checkpoint inhibitors in BRAF V600E mutated and deficient mismatch repair or microsatellite instability high metastatic colorectal cancer. Eur J Cancer. 2024;210:114290. doi:10.1016/j.ejca.2024.114290
