病史介绍
女性,33岁,5月前因“检查发现盆腔包块1+年,阴道不规则流血2+月”入院,行手术治疗,确诊(子宫)低级别子宫内膜间质肉瘤。本次因“检查发现左侧乳腺肿块”入院。
辅助检查
双侧乳腺彩超显示:
左侧乳腺约4点钟方位距乳头约25mm处探及大小约30×18mm混合回声结节,边界清,以液性为主,透声欠佳,后方回声增强,未见明显血流信号。
组织病理活检
大体观:
灰红组织3*2.5*2cm,切面灰白,质中,包膜完整,局部可见出血。
镜下观:(图1-图5)
低倍镜下,乳腺实质内见一结节性肿瘤,边界尚清,肿瘤细胞体积较小,主要呈卵圆形或胖梭形,胞浆较少,排列密集,细胞彼此之间大小相对一致。核染色质均匀,异型性较小,核分裂象少见。
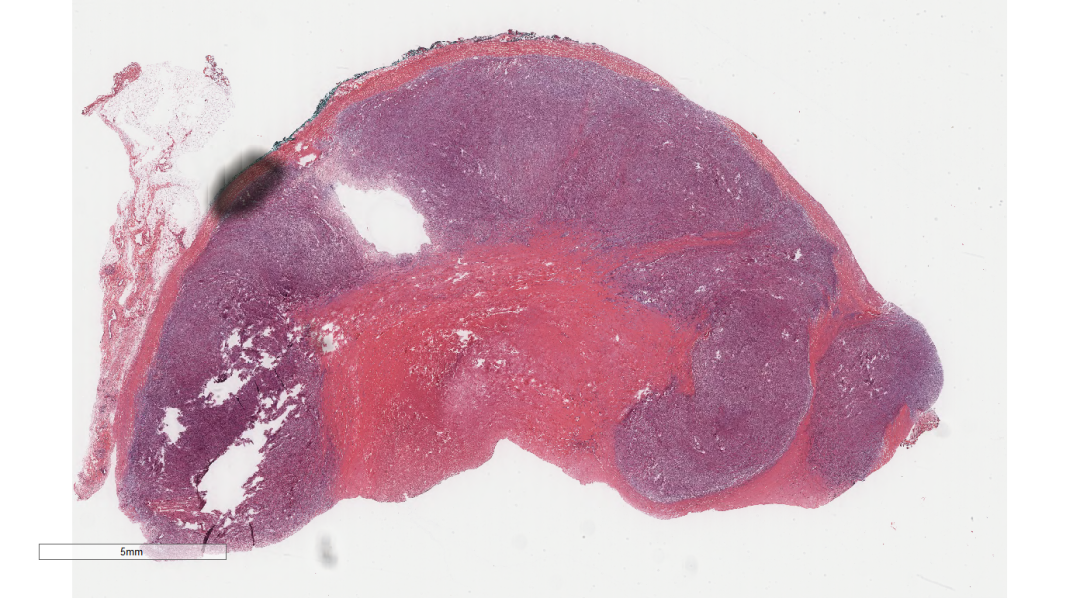
图1 低倍镜下,乳腺实质内见结节性肿瘤,边界尚清.
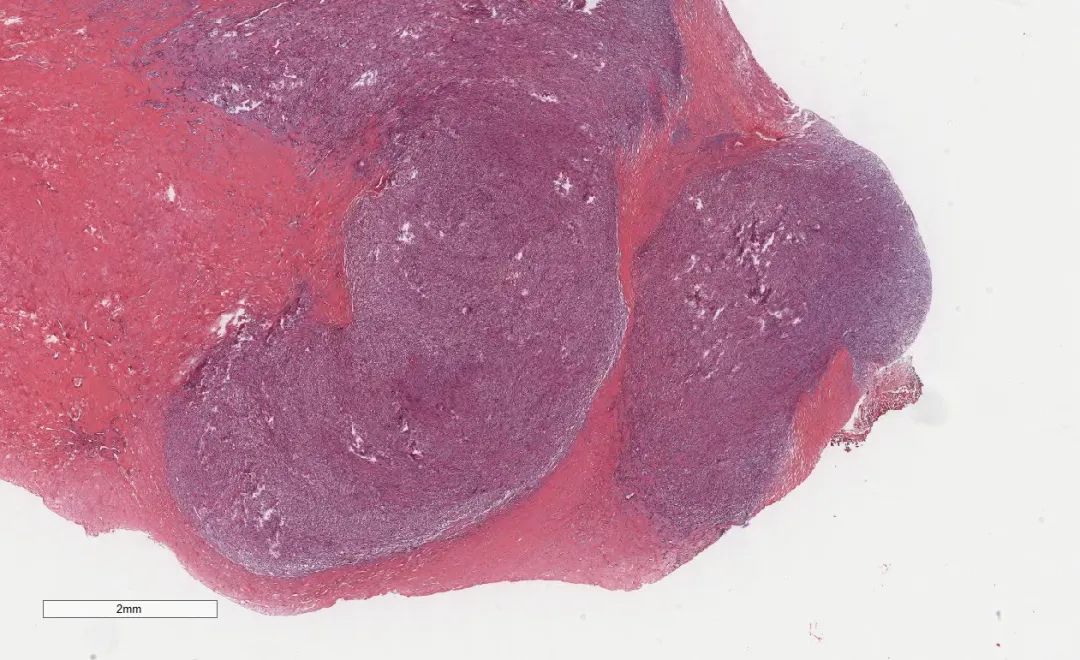
图2 低倍镜下,乳腺实质内见一结节性肿瘤,边界尚清.
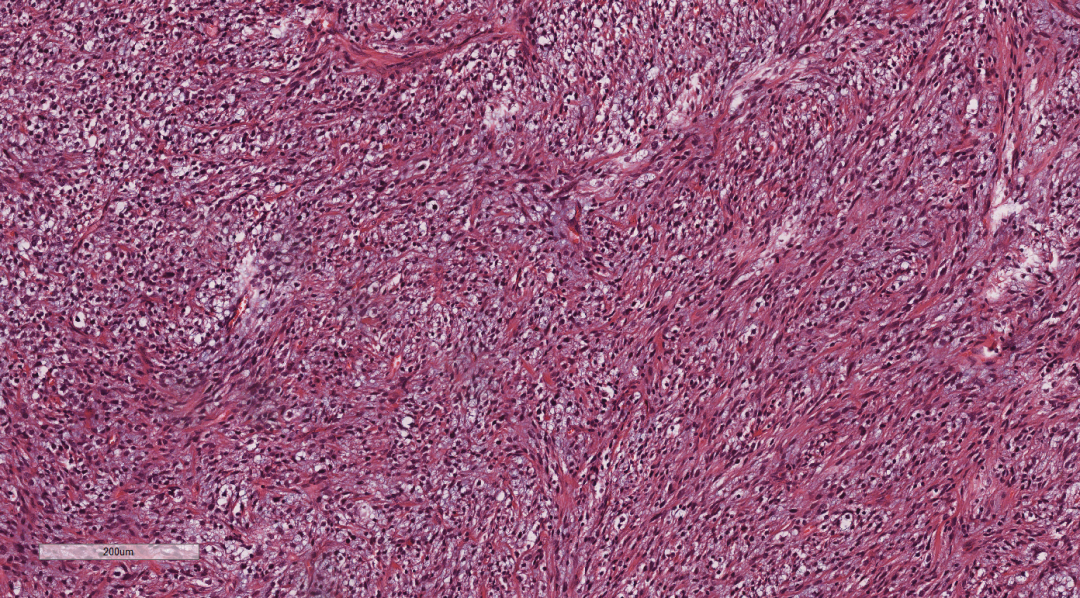
图3 中倍镜下肿瘤细胞梭形排列,排列密集,细胞彼此之间大小相对一致。

图4 高倍镜下核染色质均匀,异型性较小,核分裂象少见。

图5 高倍镜下核呈梭形,染色质均匀,异型性较小,核分裂象少见,间质黏液样变。
免疫组化
免疫组化示肿瘤细胞Vimentin(++)、CD10(+++)(图6)、CyclinD1(+)(图7)、CK(局部散在少数+)、S100(散在少数弱+)、SMA(散在极少数+/-)、PR(部分区域散在少数+/-)、CD117(局部区域散在少数+/-)、Ki-67(约40%+)、ER(-)、H-Caldesmon(-)、CD163(-)、CD34(-)、CK5/6(-)、Desmin(-)、HMB45(-)、p63(-)、STAT6(-)。
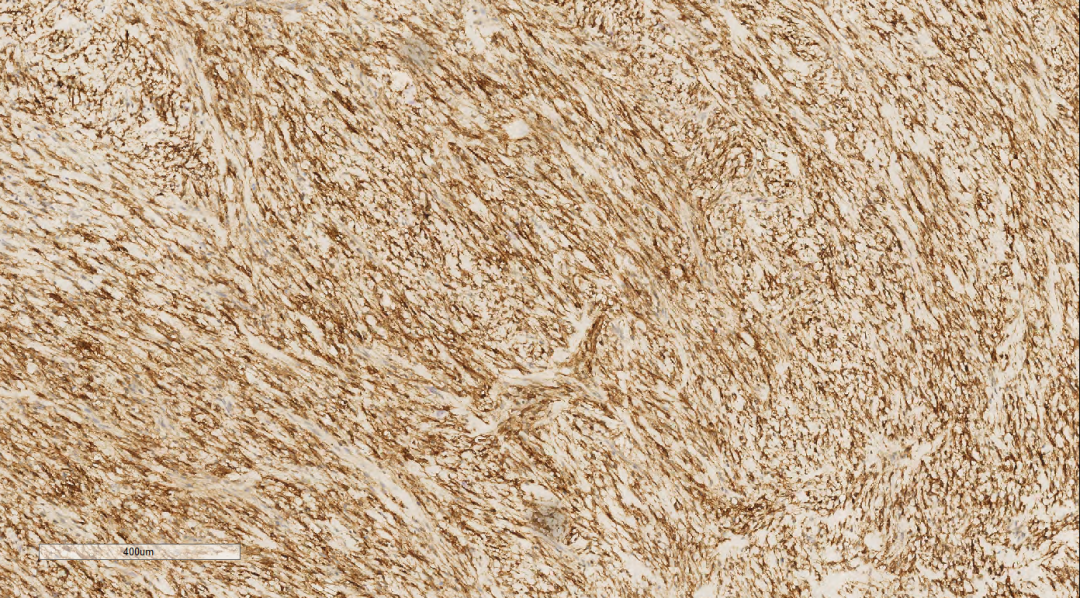
图6 免疫组化示肿瘤细胞CD10(+++)。
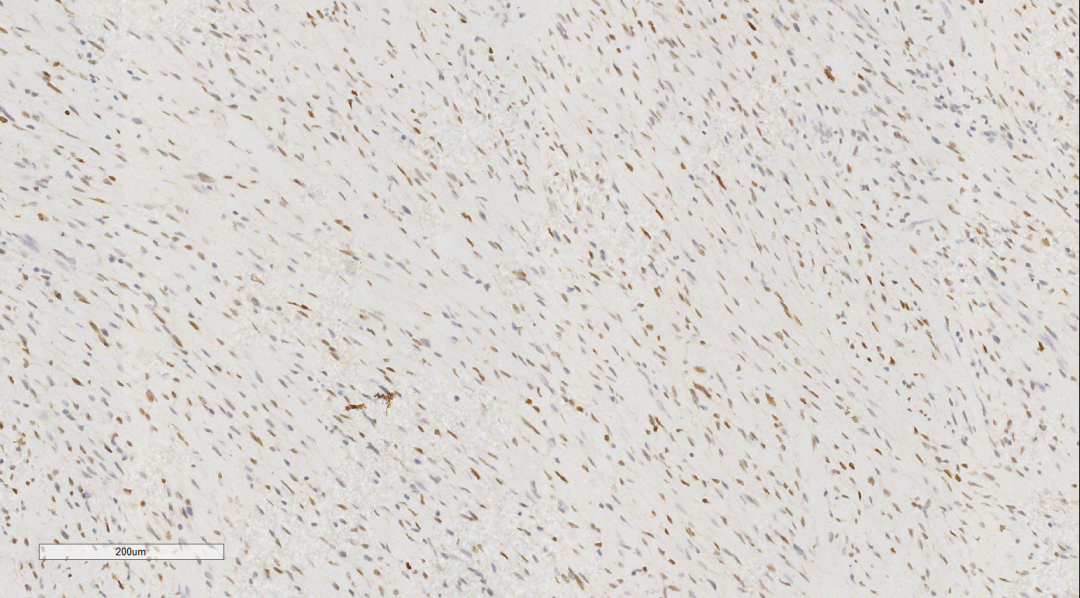
图7 免疫组化示肿瘤细胞CyclinD1(+)。
病理诊断
(左侧)乳腺转移性子宫内膜间质肉瘤。
讨论
概述:
子宫内膜间质肉瘤(ESS)是子宫恶性肿瘤中的一种少见病理类型,仅占子宫原发恶性肿瘤的0.2%,占子宫肉瘤的15%,通常分为低级别子宫内膜间质肉瘤(LG-ESS)、高级别子宫内膜间质肉瘤(HG-ESS)。低级别子宫内膜间质肉瘤是一种由类似增殖期子宫内膜间质的细胞构成的恶性肿瘤,常伴有肌壁和/或淋巴管浸润。LG-ESS为低度恶性,发生转移较少,通常为肺转移多见,乳腺转移更是极为罕见,在临床诊断和治疗中存在极大的挑战。
乳腺转移性ESS的临床病理特征:
1.临床特点
乳腺转移性ESS均为女性,平均年龄48.75岁,平均直径2.22cm,左右侧比例相同。患者均有ESS既往病史,体检或无意中触及乳腺肿块,无痛,边界尚清,呈圆形、不规则形、分叶状。转移时间上,在乳腺转移性ESS中,有的在诊断ESS后几个月就可转移到乳腺,有的长达17年才发现转移。
2.影像学
转移性乳腺癌通常为外上象限单个或多个边缘清楚的圆形或椭圆形低回声结节,无毛刺、无钙化或无继发性皮肤或乳头改变等恶性征象,仅卵巢癌、肝细胞癌和胃肠道癌乳房转移灶可有微钙化,因此,无微钙化可作为超声在鉴别乳腺癌是原发或转移时具有非常重要的价值。
3.病理学特征
镜下观:
LG-ESS镜下由大小和形态不规则的瘤细胞岛广泛浸润乳腺间质,边缘呈“ 舌状”生长,无间质反应,高倍镜下肿瘤细胞胞体小,胞质稀少,核一致,卵圆形至纺锤形,细胞无或轻微非典型性,核分裂象低(一般〈5/10HPF) 。
HG-ESS肿瘤可显示膨胀性、渗透性或浸润性生长,并且可以看到一种以上的浸润模式。通常表现出淋巴管浸润、活跃的核分裂计数和坏死。肿瘤细胞中到高度异型,核大,深染,核分裂象多见,少见坏死,也不常伴恶性腺上皮成分。
免疫表型:
在乳腺转移性LG-ESS中,Vimentin(++)、cyclinD1(+)、CD10(+++)、CK(局部散在少数+)、PR(部分区域散在少数+/-)、ER(-)、Ki-67(约40%+)、H-Caldesmon(-)、CD163(-)、CD34(-)、CK5/6(-)、Desmin(-)、HMB45(-)、p63(-)、STAT6(-)。
在乳腺转移性HG-ESS中,肿瘤细胞CD10和CyclinD1显示弥漫阳性染色,AE1/AE3(弥漫性+)、CAM 5.2(局灶性+)和p63(局灶性+)染色呈阳性,ER、PR、S100、CD34、desmin和ERG均阴性表达。desmin、MSA、AE1/AE3、CK5/6、CD34、HMB45、ERG均为阴性。
由此可见,CyclinD1和CD10仍然是转移性ESS较为可靠的抗体标记,而CK、PR、S100、p63可阳性或阴性表达。
分子遗传学:
在既往文献报道中,高级别子宫内膜间质肉瘤常包含YWHAE-NUTM2A/B融合、ZC3H7B-BCOR融合或BCOR ITD,EPC1 -BCOR、AZF1-BCORL1和BRD8-PHF1融合很少见。而LG-ESS约有半数低级别子宫内膜间质肉瘤有JAZF1-SUZ12基因融合,另外少数病例伴有其他分子改变,包括JAZF1-PHF1、EPC1-PHF1、MEAF6-PHF1等。
鉴别诊断:
发生在乳腺转移性ESS极为罕见,且组织形态特征与多种良恶性软组织肿瘤具有相似性,在临床病理诊断中,如没有既往ESS病史,极易忽略此疾病,给诊断医师带来巨大困难。常需与以下肿瘤鉴别:
(1)乳腺叶状肿瘤:
乳腺转移性ESS也常呈分叶状结构,间质细胞丰富,低级别ESS易与交界性叶状肿瘤形态学相似,两者的鉴别点在于叶状肿瘤除了间质细胞增生呈明显分叶状,间质细胞分布异质性,还有叶状结构周围的腺上皮增生,免疫组化两者均可表达CD10,但叶状肿瘤一般可表达CD34、bcl2,不表达cyclinD1。
(2)黏液样平滑肌肉瘤:
需与低级别或高级别子宫内膜间质肉瘤相鉴别,主要在形态学上上相似,需用免疫组化进行鉴别,平滑肌肉瘤常表达H-Caldesmon、SMA。
(3)黏液样变孤立性纤维性肿瘤(SFT):
SFT的瘤细胞丰富区与稀疏区交替分布,部分可见典型的血管外皮瘤样改变,且瘤内几乎不含成熟脂肪细胞;免疫表型上,SFT中STAT6、β-catenin和CD99均阳性。必要时可行分子检测SFT中较为特异的NAB2-STAT6融合基因予以鉴别。
(4)其他间叶源性肿瘤:
包括炎性肌纤维母细胞瘤、胃肠道间质瘤、恶性黑色瘤、腺肉瘤、恶性苗勒管混合瘤等,同样是间叶源性肿瘤,部分形态学重叠,需进行免疫组化鉴别,CyclinD1和CD10在子宫内膜间质肉瘤表达,必要时行基因检测即可。
治疗和预后:
ESS当发生远处转移时,采用国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)制定的分期标准归到IVb期,2016年NCCN子宫肿瘤临床实践指南指出,LG-ESS ⅣB期患者可行激素治疗±姑息性放疗; HG-ESS Ⅳb期行化疗±姑息性放疗。推荐使用的激素治疗药物包括甲地孕酮、甲羟孕酮和芳香化酶抑制剂, GnRH 类似物也可作为一种选择。低级别患者的术后辅助治疗需根据患者术后常规病理结果及免疫组化结果中ER/PR、CD10的表达采取个体化治疗。文献中报道,类固醇受体和芳香化酶在低级别子宫内膜间质肉瘤的表达表明,使用孕激素、GnRH类似物或芳香化酶抑制剂进行辅助治疗应该是有效的。然而,这些内分泌治疗的益处并没有得到毫无疑问的证实,因为现在仍无大量临床数据证实,没有足够令人信服的证据证实激素治疗是子宫内膜间质肉瘤术后肺转移患者的最佳治疗方案。总之,子宫内膜间质肉瘤术后乳腺转移的治疗仍需大样本数据的探究,以及术后患者乳腺转移的预防都是亟待解决的问题。
参考文献:
1.Brenton JD EL, Gilks CB, et al. : Female Genital Tumours, 5th ed. World Health Organization 2020.
2.Kostov S, Kornovski Y, Ivanova V, Dzhenkov D, Metodiev D, Watrowski R, Ivanova Y, Slavchev S, Mitev D, Yordanov A: New Aspects of Sarcomas of Uterine Corpus-A Brief Narrative Review. Clinics and practice 2021, 11(4):878-900.
3.Dos Santos LA, Garg K, Diaz JP, Soslow RA, Hensley ML, Alektiar KM, Barakat RR, Leitao MM, Jr.: Incidence of lymph node and adnexal metastasis in endometrial stromal sarcoma. Gynecologic oncology 2011, 121(2):319-322.
4.Mindiola-Romero AE, Liu X, Dillon JL, Talarico M, Smith G, Zhang L, Linos K: Metastatic low-grade endometrial stromal sarcoma after 24 years: A case report and review of recent molecular genetics. Diagnostic cytopathology 2021, 49(3):E99-e105.
5.Günhan-Bilgen I, Memis A, Ustün EE, Ozdemir N: Breast metastasis from low-grade endometrial stromal sarcoma after a 17-year period. European radiology 2002, 12(12):3023-3025.
6.Namjoshi A, Wong DD, Gill J: A rare case of metastatic endometrial stromal sarcoma mimicking primary breast carcinoma: a diagnostic pitfall. Pathology 2023, 55(3):414-416.
7.Fong A, Offman S: Breast metastasis in high-grade endometrial stromal sarcoma (HG-ESS) with BCOR rearrangement: a case report of a novel metastatic site. Diagnostic pathology 2023, 18(1):34.
8.Velden J, Buist MR: Endometrial stromal sarcoma: treatment and patterns of recurrence. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society 2009, 19(5):989.
9.Chu MC, Mor G, Lim C, Zheng W, Parkash V, Schwartz PE: Low-grade endometrial stromal sarcoma: hormonal aspects. Gynecologic oncology 2003, 90(1):170-176.