引言
近年来,免疫治疗以其激活人体免疫系统对抗癌症的创新机制,掀起了肿瘤治疗的革命性浪潮。其中,针对程序性死亡蛋白1(PD-1)和其配体PD-L1的免疫检查点抑制剂成为了多种癌症的一线治疗方案。然而,尽管它们取得了令人瞩目的成效,但疗效有限的问题仍难以忽视:许多患者无法产生应答,或者在初期应答后很快复发。这种对免疫检查点抑制剂的耐药性已成为全球肿瘤治疗研究的主要挑战之一。
在破解这一难题的探索中,生长分化因子15(GDF-15)这一细胞因子逐渐引起了大家的关注。研究发现,GDF-15不仅在肿瘤微环境中高表达,还能通过多种机制抑制T细胞的活性和迁移,从而使肿瘤细胞逃避免疫系统的杀伤作用。GDF-15的这种“免疫隐身”能力,可能是许多患者无法对免疫治疗产生应答的重要原因。
针对这一现象,12月11日Nature的研究报道“Neutralizing GDF-15 can overcome anti-PD-1 and anti-PD-L1 resistance in solid tumours”,尝试通过中和GDF-15来恢复T细胞的抗肿瘤活性。该研究采用了一种名为visugromab的中和抗体,结合免疫检查点抑制剂nivolumab,对多种晚期实体瘤患者进行了试验。结果显示,这种联合疗法在一部分此前对PD-1或PD-L1治疗无效的患者中,实现了显著的肿瘤缩小甚至完全缓解。更重要的是,研究发现,中和GDF-15不仅提高了T细胞的肿瘤浸润水平,还激活了与免疫相关的多条信号通路,进一步证实了其在免疫治疗中不可忽视的潜在作用。
这一发现标志着肿瘤免疫治疗的新突破,也为解决免疫耐药问题提供了一条崭新的研究路径。通过深入剖析GDF-15的功能与治疗潜力,有望为无法从现有免疫治疗中获益的患者群体带来新的希望。

肿瘤免疫治疗的“瓶颈”:为什么有些人无效?
过去十年间,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)彻底改变了癌症治疗的格局。这些药物通过阻断程序性死亡蛋白1(PD-1)或其配体PD-L1的作用,释放被肿瘤“禁锢”的T细胞,让它们能够重新识别并杀死癌细胞。这一疗法为多种癌症患者带来了前所未有的生存希望,被称为“免疫治疗时代的奇迹”。然而,数据表明,这种疗法并非适用于所有患者。即使在治疗最为成功的非小细胞肺癌(NSCLC)和尿路上皮癌(UC)中,ICIs的总体有效率仅为15%-50%,多数患者要么对治疗完全无反应,要么在短暂应答后快速复发。
为什么如此有效的疗法会失败?研究揭示,这背后隐藏着复杂的肿瘤免疫逃逸机制。肿瘤微环境(tumor microenvironment, TME)中充满了能够抑制免疫反应的因子,例如转化生长因子-β(TGF-β)和近年备受关注的生长分化因子15(GDF-15)。GDF-15是一种由肿瘤细胞大量分泌的细胞因子,它通过干扰T细胞的迁移和活性,使肿瘤成功“躲避”免疫系统的攻击。研究发现,在超过10,000份肿瘤样本的分析中,高水平的GDF-15表达与T细胞浸润减少和患者生存率下降密切相关。
更复杂的是,许多患者在初始免疫治疗阶段的肿瘤有所缩小,但随后出现耐药性。这种现象被称为继发性免疫耐药,其机制尚未完全被阐明,但GDF-15可能是其中的关键角色之一。它不仅阻止T细胞进入肿瘤,还会削弱T细胞的杀伤功能,让肿瘤逐步建立起更强大的免疫屏障。
对于癌症患者来说,免疫治疗的失败并非治疗的终点。破解这一“瓶颈”的关键在于如何针对这些免疫抑制因子,恢复免疫系统的功能。GDF-15的发现正为这一领域提供了新的希望——它不仅是一种“肿瘤隐身术”的重要操控者,更可能成为未来肿瘤免疫治疗的核心突破口。
GDF-15:肿瘤“隐身”的幕后黑手
在免疫系统与癌细胞的持续“攻防战”中,肿瘤细胞并非被动挨打,而是掌握了多种“伪装术”,其中生长分化因子15(Growth Differentiation Factor 15, GDF-15)成为一种颇具威胁的“免疫屏蔽”。作为TGF-β家族的成员,GDF-15的作用不仅仅局限于调节细胞分化,还成为肿瘤微环境中抑制免疫反应的重要分子。
研究发现,GDF-15在许多实体瘤中大量表达,这种高水平分泌显著改变了肿瘤微环境中的免疫生态。首先,它通过抑制LFA-1(淋巴功能相关抗原1)与ICAM-1(细胞间黏附分子1)的相互作用,直接干扰T细胞的迁移能力。数据显示,在GDF-15高表达的肿瘤中,CD8+ T细胞和CD4+ T细胞的浸润水平显著下降,肿瘤组织几乎成了“免疫孤岛”。此外,GDF-15还通过减少T细胞的增殖与颗粒酶B(Granzyme B)等效应分子的表达,削弱T细胞的杀伤功能,让它们即使进入肿瘤也难以发挥作用。
更进一步的数据表明,GDF-15的高表达与多种肿瘤的不良预后密切相关。在针对约10,000例肿瘤样本的基因组分析中,GDF-15的高表达与非鳞状非小细胞肺癌(non-squamous NSCLC)和尿路上皮癌(UC)患者T细胞浸润减少高度相关。同时,这些肿瘤往往表现出免疫反应低下以及对免疫检查点抑制剂(ICIs)耐药的特征。这种免疫逃逸机制,让GDF-15成为肿瘤“隐身”的关键操控者。
值得注意的是,GDF-15的表达并非一成不变。研究发现,肿瘤在接受治疗后的应激反应可能进一步诱导其分泌,强化肿瘤微环境的免疫抑制作用。这解释了为什么一些患者在初始免疫治疗有效后会迅速发展为继发性耐药。
总的来说,GDF-15以其抑制T细胞浸润和活性的双重作用,帮助肿瘤成功逃避免疫系统的监视和攻击。破解这一“隐身术”的关键在于找到能够阻断GDF-15功能的有效策略。
破解耐药的新希望:中和GDF-15的策略
面对肿瘤免疫治疗耐药这一难题,研究人员提出了一种全新的解决策略——通过中和这一细胞因子的活性,恢复T细胞的杀伤能力。这一突破性思路催生了visugromab(CTL-002)中和抗体的研发,它为破解耐药带来了新的曙光。
visugromab是一种特异性靶向GDF-15的单克隆抗体,旨在通过阻断GDF-15的功能,逆转其对T细胞活性和迁移的抑制作用。GDF-15在肿瘤微环境中的作用类似于“免疫屏障”,它通过削弱T细胞的迁移能力和抗肿瘤功能,使肿瘤细胞得以逃避免疫追杀。研究发现,在抑制GDF-15后,T细胞不仅能够更高效地渗入肿瘤组织,还表现出更强的增殖能力和细胞毒性作用。尤其是颗粒酶B(Granzyme B)和干扰素-γ(Interferon-γ)等关键免疫效应因子的表达显著增加,表明免疫系统被重新激活。
在visugromab的临床前研究中,小鼠模型显示,与单独使用PD-1抑制剂相比,联合使用visugromab显著提高了抗肿瘤疗效,肿瘤体积减少更明显。基于这一发现,研究人员设计了GDFATHER-1/2a临床试验,在患有晚期实体瘤且对免疫检查点抑制剂无反应的患者中测试这一疗法的效果。
初期临床试验的结果令人振奋。在接受visugromab联合nivolumab(PD-1抑制剂)治疗的患者中,部分原本对PD-1治疗无效的患者实现了持久且深度的肿瘤缓解,甚至出现完全缓解的案例。此外,试验数据显示,visugromab显著增强了T细胞在肿瘤中的浸润水平和增殖能力,同时未引起严重的毒副作用。这表明,通过中和GDF-15,能够有效克服耐药问题,并在免疫治疗领域开辟新天地。
visugromab的研发不仅为免疫治疗耐药提供了一种全新的解决方案,也为未来开发更多靶向GDF-15的疗法提供了基础。
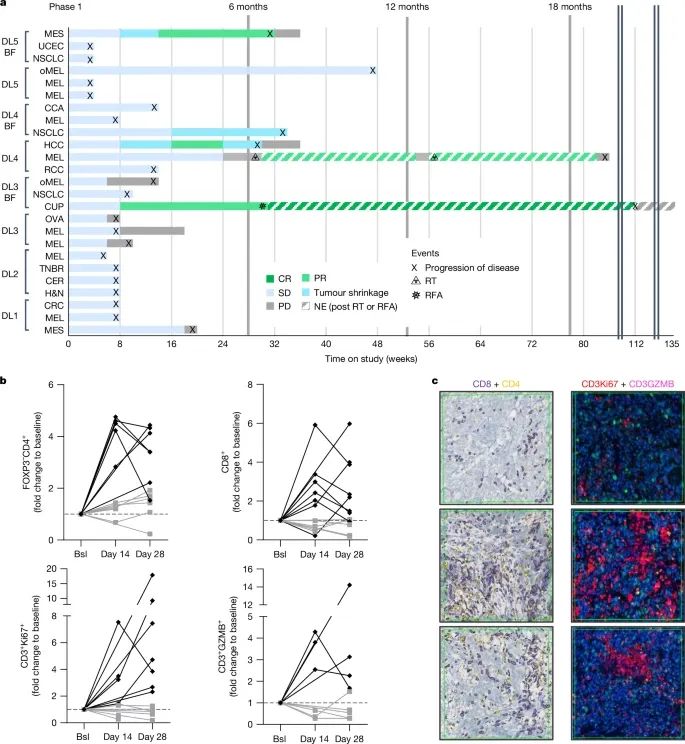
visugromab联合nivolumab在第一阶段剂量递增试验中的治疗效果和免疫学反应(Credit: Nature)
a. Swim plot患者治疗效果概览:
以Swim plot的形式展示了25名患有不同实体瘤的晚期患者(包括间皮瘤、子宫内膜癌、眼部黑色素瘤、胆管癌、卵巢癌等)接受visugromab与nivolumab联合治疗的反应情况。患者按照递增剂量(0.3、1.0、3.0、10.0和20.0 mg/kg,每两周一次)分组。试验结果显示:
蓝色标记:部分患者的肿瘤体积缩小超过5%。浅绿色标记:3名患者达到部分缓解(PR),基于RECIST 1.1标准评估。稳定疾病(SD):部分患者病情稳定,未观察到显著肿瘤进展。破折线(NE):表示因接受放射治疗或其他干预,患者在后续评估中不具备可评估性。总体趋势:疗效集中于中高剂量组(3.0至20.0 mg/kg),表现出剂量依赖性。
b. T细胞变化的倍数增加:
以柱状图显示了治疗前(基线)与治疗后不同时间点(第14天和第28天)患者肿瘤样本中T细胞的变化,包括:CD4+FOXP3− T细胞:基线后14天内大部分患者的CD4+ T细胞数量增加超过2倍。CD8+ T细胞:在大多数患者中数量显著上升,特别是在第28天时。增殖标志物Ki67+的T细胞(CD3+Ki67+):从基线到第28天显著增加。颗粒酶B阳性T细胞(CD3+GZMB+):说明T细胞的杀伤能力被激活。
结果表明,中和GDF-15不仅显著提升了T细胞的肿瘤浸润能力,还增强了T细胞的增殖和杀伤功能。
c. 肿瘤组织免疫组化和荧光成像:
以免疫组化和免疫荧光图像展示了不同时间点(基线、第14天、第28天)肿瘤样本中T细胞的分布和功能变化:CD8+和CD4+ T细胞:治疗后数量显著增加(分别为8例和7例患者)。CD3+Ki67+ T细胞:第28天时,增殖的T细胞明显增多。颗粒酶B(GZMB)合成:5例患者显示T细胞功能增强,进一步验证T细胞杀伤活性的恢复。
从实验室到临床:第一阶段试验的突破性进展
作为首个专门针对GDF-15的中和抗体,visugromab的安全性和初步疗效在第一阶段临床试验中得到了验证,为未来的肿瘤免疫治疗提供了重要数据支持。
第一阶段试验(GDFATHER-1)采用经典的“3+3”剂量递增设计,旨在评估visugromab的安全性、耐受性和初步疗效。试验招募了25名患有晚期实体瘤的患者,这些患者均经历过多线治疗,且对至少一种免疫检查点抑制剂(如PD-1或PD-L1抑制剂)产生了耐药。患者在试验中接受了0.3至20 mg/kg五个剂量梯度的visugromab治疗,并与nivolumab(PD-1抑制剂)联合使用。
试验结果令人鼓舞。首先,在所有剂量水平上,visugromab的耐受性表现优异,无剂量限制性毒性(DLT)事件发生,仅有一例4级非治疗相关的不良事件(急性呼吸衰竭)。48%的患者出现了3级不良事件,主要为实验室指标异常,但这些事件的发生率和严重程度均在可接受范围内。这些结果表明,visugromab联合nivolumab的治疗方案是安全的。
疗效方面,尽管参与者均为晚期耐药患者,仍有5位患者表现出明确的临床获益,其中3位患者实现了部分缓解(PR),包括一例癌症原发部位不明的患者在治疗8个月后达到了完全缓解(CR)。此外,还有两位患者的疾病稳定期(SD)超过6个月。更为重要的是,免疫组化分析显示,在治疗后肿瘤组织中T细胞浸润显著增加,CD4+和CD8+ T细胞数量增长超过2倍,提示visugromab成功激活了抗肿瘤免疫反应。
这些结果验证了visugromab的机制假设,即通过中和GDF-15,能够重塑肿瘤微环境,改善免疫治疗的效果。
临床数据解读:哪些患者从中受益最大?
在中和GDF-15的临床研究中,不同肿瘤类型和患者特征对治疗反应的差异性,为识别潜在的获益人群提供了重要线索。第一阶段试验和随后的2a阶段数据显示,visugromab联合PD-1抑制剂nivolumab的疗效在某些特定患者群体中表现尤为突出。
研究发现,非鳞状非小细胞肺癌(non-squamous NSCLC)和尿路上皮癌(UC)患者对这种联合疗法反应显著。具体而言,在NSCLC患者中,接受治疗的27位患者中有4位(14.8%)实现了明确的肿瘤缓解,其中包括两例完全缓解(CR)。更重要的是,这些应答均出现在非鳞状亚型中,非鳞状患者的客观缓解率(ORR)高达19%。此外,UC患者的疗效也令人鼓舞,27位患者中有5位(18.5%)实现了肿瘤缓解,其中一例完全缓解持续超过20个月。这些数据表明,非鳞状NSCLC和UC患者可能是该疗法的最佳获益人群。
进一步的免疫学分析揭示了潜在的应答机制。治疗前,部分患者的肿瘤组织中已经存在一定程度的T细胞浸润,这些患者对疗法的反应更为显著。同时,治疗后,肿瘤中的CD8+ T细胞数量显著增加,颗粒酶B(Granzyme B)和干扰素-γ(IFN-γ)等关键免疫因子的表达水平也显著提高。这表明,中和GDF-15能够显著增强已有的抗肿瘤免疫反应,尤其在肿瘤免疫微环境中尚具备一定免疫活性的患者中效果最佳。
此外,患者的既往治疗经历也与疗效密切相关。数据显示,那些对之前PD-1或PD-L1抑制剂短期获益的患者,在联合疗法中表现出更高的应答率。反之,那些对免疫治疗完全无应答的患者,其反应率则相对较低。这表明,中和GDF-15可能通过增强免疫检查点抑制剂的作用,帮助恢复部分患者的免疫反应。
综合来看,中和GDF-15疗法在非鳞状NSCLC和UC患者中展现出最大的获益潜力,尤其是那些已有一定T细胞浸润或曾短暂获益于免疫治疗的患者。
未来的治疗:GDF-15联合疗法的潜力
当前数据表明,visugromab联合nivolumab在非鳞状非小细胞肺癌(NSCLC)和尿路上皮癌(UC)患者中取得了显著疗效,这两种肿瘤在基因组学分析中被确认为GDF-15高表达的类型。基于这些成功案例,研究人员正在积极拓展GDF-15联合疗法的适应症范围。其他GDF-15相关性较高的癌症类型,例如肝细胞癌(HCC)、胰腺癌和某些亚型的肾细胞癌,也可能从中获益。尤其是对于免疫抑制微环境明显的肿瘤,GDF-15中和疗法有望成为激活免疫反应的关键工具。
此外,联合治疗方案的优化也被寄予厚望。数据显示,中和GDF-15虽然显著增强了T细胞浸润,但其作用主要是解除T细胞迁移和增殖的障碍。通过与其他疗法的组合,例如肿瘤疫苗、溶瘤病毒或其他免疫调节剂,可以进一步激活T细胞的功能,并扩大疗效范围。这种“多重联合”的策略可能为难治性肿瘤提供更长久的控制。
在实际应用中,visugromab的安全性和耐受性表现令人欣慰,这为其推广至更广泛的患者群体提供了基础。此外,生物标志物的开发也将加速这一疗法的普及。通过检测肿瘤组织或血清中的GDF-15水平,未来可以更精确地筛选出可能受益的患者,从而实现个体化治疗。
未来,GDF-15联合疗法的潜力远不止于治疗晚期耐药性肿瘤。若能在疾病的早期阶段引入这一疗法,或许能够预防耐药性的发生,提升免疫治疗的总体成功率。
改变游戏规则:从突破性疗法到实际应用的距离
visugromab作为一项突破性的中和GDF-15疗法,展现了显著的抗肿瘤潜力,尤其是在免疫检查点抑制剂(ICIs)耐药的患者群体中。然而,从临床试验到广泛应用,这一“游戏规则改变者”仍面临多重技术和临床挑战,只有逐一攻克,才能将这一疗法推向更广阔的医疗实践。
首先,尽管初步试验显示visugromab具有良好的安全性和耐受性,但针对更大规模人群的长期安全性仍需进一步验证。特别是对于高危患者或合并症较多的群体,GDF-15的全身性中和是否会引发其他代谢问题尚不明确。例如,GDF-15已知参与调节食欲和体重,一些试验中高基线GDF-15水平的患者在治疗后体重有所增加,这种代谢变化的长期影响需要更深入研究。
其次,疗效的普适性和可预测性仍是一个亟待解决的问题。虽然数据表明visugromab对非鳞状NSCLC和UC患者疗效显著,但其他GDF-15高表达的肿瘤类型反应仍有待验证。此外,GDF-15水平是否可以作为有效的生物标志物,帮助筛选潜在获益者,以及如何定义最佳治疗窗口,仍是关键的研究方向。
第三,联合治疗策略的进一步优化至关重要。当前研究集中在与PD-1抑制剂的联合使用,但GDF-15中和疗法可能与其他疗法协同增效,例如溶瘤病毒、抗体偶联药物或新型免疫调节剂。这些策略需通过随机对照临床试验系统验证,以明确最佳的治疗组合和剂量方案。
最后,推广这一疗法的另一个重要障碍是生产和经济可行性。单克隆抗体治疗成本较高,对资源有限地区的患者可及性较低。未来需要通过优化生产工艺或开发类似药物(例如小分子抑制剂)来降低成本,提升这一疗法的可负担性。
尽管挑战重重,visugromab已经为GDF-15靶向疗法铺平了道路。未来,随着研究的深入,这一疗法有望突破目前的局限,填补免疫治疗耐药领域的空白,成为改变肿瘤治疗格局的重要武器,为更多患者带来治愈的可能。
参考文献
Melero, I., de Miguel Luken, M., de Velasco, G. et al. Neutralizing GDF-15 can overcome anti-PD-1 and anti-PD-L1 resistance in solid tumours. Nature (2024). https://doi.org/10.1038/s41586-024-08305-z