导读
代谢相关脂肪性肝病(Metabolic dysfunction-associated steatotic liver disease, MASLD)的全球发病率逐年上升,给全球卫生系统造成极大负担。尽管代谢异常在MASLD的病程中发挥关键作用,但是越来越多的研究表明:长链非编码RNA(lncRNA)通过调控关键的分子机制也在这一过程中发挥了重要作用。为此eGastroenterology特邀来自英国贝尔法斯特女王大学的Qiaozhu Su教授及团队撰写题为“Mechanistic role of long non-coding RNAs in the pathogenesis of metabolic dysfunction-associated steatotic liver disease and fibrosis”的综述,系统介绍lncRNA在MASLD发病机制中的研究进展,并讨论了其治疗和诊断潜力。

前言
MASLD是一种代谢相关肝脏疾病,主要表现为肝脏脂质代谢紊乱、脂肪堆积和肝细胞变性。在全球范围内,MASLD的发病率随着肥胖、糖尿病等代谢疾病的增加而快速上升,并且会进展为代谢功能障碍相关脂肪性肝炎(Metabolic dysfunction-associated steatohepatitis,MASH),进一步导致肝纤维化、肝硬化及肝细胞癌。肥胖和胰岛素抵抗是MASLD的两大致病风险因素:(1)在肥胖患者中,尤其是接受减肥手术的患者,MASLD的发病率超过95%。(2)胰岛素抵抗与脂质代谢紊乱和肝细胞损伤密切相关。胰岛素抵抗会促进肝细胞的脂质合成,抑制脂肪酸β氧化,诱发脂毒性和氧化应激,进而引发肝纤维化。除此之外,在MASLD的病程中,肝细胞、肝星状细胞(HSCs)和Kupffer细胞的代谢功能和信号通路发生显著变化,而lncRNA通过调控关键的分子机制影响相关细胞的功能,并进一步在MASLD中发挥了重要作用。
LncRNA的定义、功能与分类
LncRNA是指长度超过200个核苷酸的RNA分子,尽管其不编码蛋白质,却对基因表达的多层次调控发挥重要作用。近年来,lncRNA被认为是调控复杂细胞和组织功能的重要非编码分子,并在代谢相关疾病中展示出显著的病理作用。LncRNA在细胞中的功能复杂多样,其机制主要包括:
-
信号分子:某些lncRNA通过表达变化反映细胞信号通路的激活状态。例如,H19在肝脂肪变性中充当mTOR信号的关键调节因子。
-
分子海绵:通过吸附miRNA,减少后者对靶基因的抑制作用。例如,Gas5海绵化miR-29a以影响Notch信号。
-
结构支架:如HOTAIR通过结合多种蛋白质充当支架,形成复合物以调控基因表达。
-
表观遗传调控:通过改变组蛋白甲基化状态,如DNMT1调控的DNA甲基化。
根据其基因组位置和结构特点,lncRNA可分为以下几类:
-
间隔lncRNA(Long intergenic noncoding RNAs, lincRNAs):位于蛋白编码基因之间的独立转录单元,是研究最广泛的lncRNA类型。
-
正义链lncRNA:与蛋白编码基因位于同一条DNA链上并共线。
-
反义链lncRNA:与蛋白编码基因反向排列,通常通过反义机制调控基因表达。
-
双向lncRNA:从蛋白编码基因启动子附近的反向位置转录。
-
内含子lncRNA:从蛋白编码基因的内含子中转录而来。
小知识1:何为“分子海绵”?
“分子海绵”通常指的是一类能够吸附或结合特定生物分子的RNA分子,特别是长链非编码RNA(lncRNA)和环状RNA(circRNA)。这些RNA分子通过与microRNA(miRNA)结合,影响miRNA的功能,从而调控基因表达。这种机制被称为“分子海绵”机制或竞争性内源RNA(ceRNA)机制:(1)lncRNA作为miRNA的分子海绵:研究发现,lncRNA可以作为miRNA的分子海绵,通过吸附miRNA来调控各种生命活动,特别是在肿瘤发生与发展过程中发挥重要作用。(2)circRNA作为miRNA的分子海绵:circRNA由于其高稳定性和组织特异表达的特征,被认为是比线性RNA更好的分子海绵。它们可以通过吸附miRNA来调控靶基因的表达,从而参与多种生物学过程,包括肌肉发育、癌症发生等。
LncRNA在MASLD和肝纤维化中的作用机制
MASLD及其相关的肝纤维化病理机制复杂,lncRNA通过多种信号通路和代谢调控网络对这些病理变化发挥重要作用。以下将针对几种代表性lncRNA展开详细讨论:
-
H19(脂肪代谢和纤维化的双重调控):(1)脂质代谢:H19通过mTOR/SREBP信号通路促进脂质合成,其高表达与肝脏脂质积累显著相关。具体机制包括:H19通过hnRNPA1蛋白促进SREBP1前体裂解,使其活性形式转入细胞核;SREBP1的靶基因(如ACC和FAS)上调,增强脂肪酸合成。(2)纤维化:H19通过与ZEB1的互作,抑制EpCAM表达调控纤维化基因活性。
-
Gas5(调控Notch信号):(1)抑制miR-29a:Gas5与miR-29a互作,减少其对Notch2信号的抑制,进而增加肝细胞脂肪酸合成相关基因的表达。(2)改善胰岛素抵抗:Gas5敲低实验显示其能显著降低脂肪变和炎症反应。
-
NEAT1(脂质代谢和纤维化的协同调控者):NEAT1通过以下途径加剧MASLD:(1)代谢调控:NEAT1与miR-139-5p互作,减弱后者对脂质合成信号的抑制作用。(2)纤维化信号增强:NEAT1通过miR-122/KLF6轴促进HSCs活化。
-
HOTAIR(DNA甲基化和表观遗传调控):HOTAIR通过DNMT1介导的DNA甲基化增强纤维化基因表达,其主要机制包括:(1)与miR-29b竞争结合,削弱其对PTEN信号的调控,从而激活HSCs。(2)通过组蛋白修饰增强HSCs的增殖和迁移能力。
-
MALAT1(炎症和脂质代谢的关键因子):(1)促进炎症:通过miR-181a和TLR4/NF-κB通路,加剧肝脏炎症反应。(2)调控脂肪酸代谢:MALAT1通过CD36调控肝内脂质堆积。
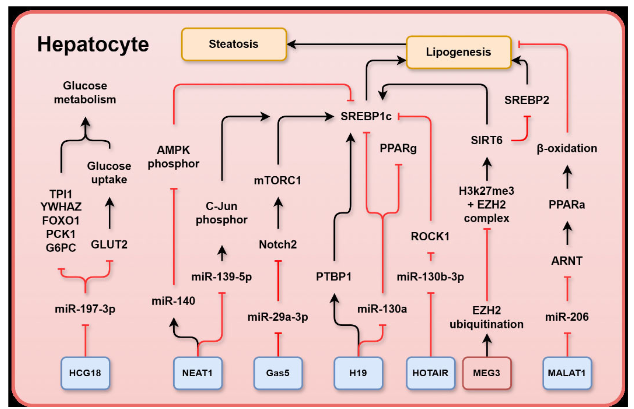
图1:展示了与MASLD相关的lncRNA及其在肝细胞内的靶点和功能机制。该图重点强调了MASLD中不同lncRNA的上调或下调表达以及它们对脂质代谢、葡萄糖代谢和纤维化信号通路的影响。(1)上调的lncRNA(蓝色框内):包括H19、NEAT1、Gas5、MALAT1和HCG18等,这些lncRNA在MASLD中发挥了致病作用。(2)下调的lncRNA(红色框内):如MEG3,通过保护性的方式减少MASLD相关损伤。
核心通路包括:(1)脂质代谢:LncRNA通过影响AMPK、mTORC1、SREBP1c/SREBP2等信号通路调节脂肪酸合成和脂质堆积。(2)葡萄糖代谢:通过调控FOXO1、PCK1和GLUT2等分子,影响葡萄糖的代谢与转运。(3)纤维化信号:LncRNA还通过调节p53、WNT/β-catenin和HH信号通路促进或抑制纤维化。
肝星状细胞(HSCs)中的lncRNA调控
HSCs是肝纤维化的主要效应细胞。在肝损伤过程中,HSCs从静止状态转变为活化状态,分泌大量细胞外基质(ECM)成分,导致纤维化的形成。多种lncRNA通过调控HSCs的活化、增殖和凋亡来介导纤维化的进程。
-
PVT1:PVT1通过分子海绵作用抑制miR-152的功能,从而减弱miR-152对DNA甲基转移酶1(DNMT1)的抑制作用。DNMT1进一步促进了补丁基因1(PTCH1)的甲基化,从而激活Hedgehog(HH)信号通路,导致HSCs的活化和纤维化的加剧。在CCl4诱导的肝纤维化小鼠模型中,PVT1表达上调14倍。PVT1的敲低能够显著降低α平滑肌肌动蛋白(αSMA)和胶原蛋白I型(COL1A1)的表达,从而减轻纤维化。
-
SNHG7:SNHG7通过竞争性结合miR-378a-3p,减弱后者对DVL2的抑制作用,从而增强了WNT/β-catenin信号通路的活性,这一信号通路被广泛认为是HSCs活化的关键调控机制。在SNHG7敲低的小鼠模型中,WNT/β-catenin相关蛋白水平显著降低,纤维化程度也显著减轻。
-
HOTAIR:HOTAIR通过与miR-29b竞争性结合,减少miR-29b对PTEN表达的调控作用,进而抑制HSCs的凋亡并促进其增殖。此外,HOTAIR还能通过DNMT1介导的甲基化抑制抗纤维化基因MEG3的表达,导致纤维化加重。HOTAIR在肝纤维化患者和模型中高表达,其敲低能有效抑制HSCs活化并减轻纤维化相关基因的表达。
Kupffer细胞中的lncRNA调控
Kupffer细胞是肝脏中唯一的常驻巨噬细胞,负责调控局部和全身的炎症反应。LncRNA在Kupffer细胞中的作用机制主要表现在调控炎症信号通路和细胞极化状态。
-
FTX:FTX通过调控Kupffer细胞的极化状态(M1型和M2型),在MASLD的炎症反应中起双重作用。其中M1型Kupffer细胞促进促炎因子(如TNF-α)的产生,而M2型则倾向于抗炎和修复功能,而FTX的表达上调会增强M1型极化,同时抑制M2型极化,导致炎症的加重和肝纤维化的进展。
-
ZFAS1:ZFAS1通过吸附miR-144-5p,减少后者对TLR2的抑制作用,从而激活TLR2/NF-κB信号通路,促进促炎因子的表达(如TNF-α和IFN-γ)。在高脂饮食诱导的MASLD小鼠模型中,ZFAS1表达显著上升,其敲低能够有效降低Kupffer细胞的促炎反应。
LncRNA的诊断与治疗潜力
随着对lncRNA研究的深入,其在MASLD和肝纤维化中的诊断和治疗潜力逐渐显现。LncRNA的组织特异性、疾病相关表达模式以及动态调控能力使其成为潜在的非侵入性诊断标志物和治疗靶点。
-
LncRNA的表达模式与MASLD及其病程严重程度紧密相关,可作为理想的生物标志物用于疾病的早期检测和进展监测:(1)NEAT1:研究发现,NEAT1在MASLD患者血液中的表达水平显著上升,且与肝纤维化程度呈正相关。NEAT1的检测可作为一种非侵入性方法,用于评估肝纤维化的严重程度。(2)HOTAIR:HOTAIR的表达在纤维化患者的肝组织中显著增加,提示其可能成为肝纤维化的组织标志物。此外,其在血液中的表达水平与患者的肝功能指标密切相关。(3)MALAT1:MALAT1的血清水平与炎症因子(如TNF-α、IL-6)显著相关,表明其不仅可作为纤维化标志物,还可反映患者的炎症状态。(4)循环lncRNA:某些lncRNA(如Gas5和H19)可分泌进入血液循环,因此可通过简单的血液测试检测其表达水平,这种非侵入性方法为MASLD的早期诊断和疗效监测提供了可能性。
-
LncRNA的靶向治疗是MASLD和肝纤维化治疗的新兴领域,以下是几种关键策略:(1)基因沉默技术:通过设计针对特定lncRNA的siRNA分子,阻断其表达。例如,针对H19和NEAT1的siRNA在实验模型中已显示出显著的抗纤维化效果。反义寡核苷酸(ASO)可结合目标lncRNA,导致其降解或功能失活。例如,靶向MALAT1的ASO能够显著降低纤维化相关基因的表达。(2)药物靶向:开发针对lncRNA的结合蛋白或其下游信号的小分子抑制剂。例如,mTOR抑制剂可阻断H19的下游信号通路,减轻脂肪变性和纤维化。或者通过补充受lncRNA影响的miRNA(如miR-122和miR-29b),恢复其对纤维化信号的抑制作用。(3)纳米载体递送:纳米技术可用于高效递送lncRNA靶向药物或siRNA,确保其特异性作用于肝组织,减少副作用。例如,靶向HOTAIR的siRNA纳米颗粒已在动物模型中展示了显著的治疗潜力。(4)基于lncRNA的疫苗开发:某些lncRNA可诱导免疫反应,未来或可开发成治疗MASLD的疫苗。
小知识1:何为lncRNA疫苗?
LncRNA疫苗将编码某种抗原蛋白的外源基因(DNA或RNA)直接导入动物体细胞内,并通过宿主细胞的表达系统合成抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,以达到预防和治疗疾病的目的。与传统的疫苗相比,lncRNA疫苗具有更高的稳定性和表达效率。其中lncRNA疫苗结构具有更高的稳定性和更长的半衰期,有利于抗原蛋白的稳定表达。LncRNA疫苗因其独特的优势,在癌症免疫治疗和传染病预防等领域具有广阔的应用前景。随着对lncRNA功能的深入研究和技术的不断进步,lncRNA疫苗有望成为未来疫苗领域的重要发展方向。尽管lncRNA疫苗具有很好的应用前景,但目前仍面临一些挑战。例如,如何确定有效的抗原靶点、如何提高疫苗的免疫原性和安全性等问题仍需要进一步研究和解决。
未来研究应重点解决以下问题
-
跨物种模型的适用性:进一步优化lncRNA研究的动物模型。
-
多学科研究的整合:结合生物信息学和功能基因组学,挖掘更多关键lncRNA。
-
临床试验的开展:加快lncRNA相关药物和诊断技术的临床验证。综上,lncRNA的研究揭示了其在MASLD及相关疾病中的复杂网络调控作用。这为理解代谢性肝病的病理生理机制及开发新的治疗策略提供了广阔前景。
引证本文
Wade H, Pan K, Zhang B, et al. Mechanistic role of long non-coding RNAs in the pathogenesis of metabolic dysfunction-associated steatotic liver disease and fibrosis. eGastroenterology 2024;2:e100115.
https://doi.org/10.1136/egastro-2024-100115