基于线粒体损伤的肿瘤治疗策略已成为一种新兴趋势。然而,溶酶体隔离和保护性线粒体自噬激活引起的药物递送效率低,严重限制了治疗效果。
2024年12月9日,哈尔滨医科大学徐万海,Wang Lu,中国科学院乔增莹共同通讯在Advanced Science 在线发表题为“In Situ Transformable Nanoparticle Effectively Suppresses Bladder Cancer by Damaging Mitochondria and Blocking Mitochondrial Autophagy Flux”的研究论文。该研究开发了一种名为 KCKT 的原位可转化纳米颗粒,以促进溶酶体逃逸并直接损伤线粒体,同时阻断线粒体自噬。
KCKT 表现出酸反应性,可精确自组装成癌细胞溶酶体内的纳米纤维。在声动力学疗法下,纳米纤维的大量积累和活性氧 (ROS) 的过量产生协同诱导溶酶体损伤。这有助于纳米纤维从溶酶体隔离中逃逸,从而增强药物递送。随后,逃逸的纳米纤维特异性聚集在线粒体周围进行长期保留,并在超声照射下产生 ROS 以诱导线粒体损伤。值得注意的是,由于溶酶体功能障碍,受损的线粒体不能通过自噬清除,进一步加剧了氧化损伤。研究结果表明,KCKT 通过阻断保护性自噬有效改善药物递送和线粒体靶向治疗效率。这些发现具有推进线粒体靶向治疗领域的巨大潜力。

线粒体是细胞的能量工厂,调节细胞环境稳态和能量代谢。恶性肿瘤中线粒体活性的损害可以抑制肿瘤增殖、迁移和耐药性。基于线粒体损伤的治疗策略已成为重点。几项临床试验正在研究抑制线粒体功能作为一种新型肿瘤疗法的潜力。然而,肿瘤已经进化出适应周围环境挑战条件的机制。例如,当线粒体损伤发生时,肿瘤细胞会自发激活线粒体自噬以响应细胞损伤。在此过程中,受损的线粒体被自噬体选择性包膜,然后与溶酶体合并。这种融合事件促进了线粒体的全面降解,确保了细胞环境稳态的保存。因此,保护性线粒体自噬可以显著降低线粒体损伤的治疗效果。此外,尽管自噬抑制剂和抗肿瘤药物的联合治疗显示出有希望的结果,但自噬抑制剂的缺点,如肿瘤分布差、细胞通透性有限和严重的副作用,限制了它们的进一步应用。因此,开发一种新的治疗方法来抑制线粒体自噬并克服上述缺点非常重要。
在癌症治疗中,纳米颗粒具有低毒性和高效率的特点。它们可以特异性地靶向癌细胞,并通过其可控的特性和大小优势有效地穿过细胞膜。然而,大多数进入细胞的纳米颗粒会被溶酶体捕获,随后被溶酶体酶破坏。溶酶体显著影响药物递送效率并促进耐药性。因此,低细胞内递送效率仍然是纳米医学的一个主要问题。然而,溶酶体中大惰性物质的积累和活性氧 (ROS) 的过量产生会导致溶酶体损伤,从而影响其功能并促进纳米颗粒从溶酶体中逃逸。在这种情况下,利用自组装策略提供了一种很有前景的方法来解决该问题。自组装是一个自发的过程,其中小分子结构在没有人工干预的情况下组装成有序的结构。具有自组装特性的纳米颗粒可以有效增加肿瘤细胞毒性,减少毒副作用,并有助于纳米颗粒在肿瘤部位的长期保留。值得注意的是,自组装纳米颗粒可以影响周围环境的稳态,这对于促进溶酶体逃逸至关重要。然而,操纵细胞内特异性和可控组装仍然具有挑战性。
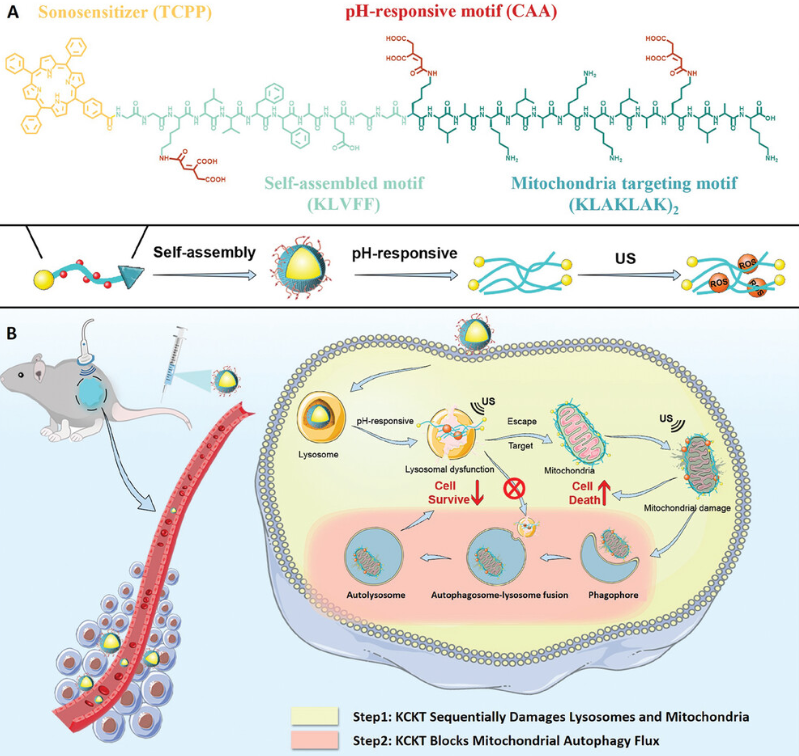
KCKT抑制肿瘤进展的示意图(图源自Advanced Science )
研究开发了一种名为 KCKT 的具有 pH 响应和纳米纤维可转化能力的原位可转化纳米颗粒,它包括四个部分:i) 线粒体靶向基序 (KLAKLAK)2用于靶向线粒体;ii) 顺式-乌头酸酐 (CAA),作为 pH 响应开关,在酸性环境中触发自组装肽的转化;iii) KLVFF (Lys-Leu-Val-Phe-Phe, Aβ16-20),一种源自 β-淀粉样蛋白的自组装基序,在刺激下形成纳米纤维结构;iv) 5-(4-羧基苯基)-10,15,20-三苯基卟啉 (TCPP),一种用于声动力学治疗 (SDT) 的声敏剂。值得注意的是,CAA 与 RGD (Arg-Gly-Asp) 肽具有相同的天冬氨酸残基结构,与已知在膀胱癌中过表达的整合素αvβ3具有相似的靶向能力。
因此,KCKT可以特异性靶向膀胱癌细胞并被内化到溶酶体中。随后,CAA 因酸性环境而水解,在原位触发自组装行为并形成纳米纤维结构。同时,纳米纤维会破坏溶酶体功能并促进它们从溶酶体中逃逸。然后,在超声 (US) 下生成的 ROS 进一步促进了这一过程。随后,逃逸的纳米纤维靶向线粒体并长期保留它们,从而破坏线粒体稳态并产生 ROS,最终诱导细胞凋亡。更重要的是,由于溶酶体的功能损伤,癌细胞中的保护性线粒体自噬受到显著抑制,导致线粒体受损,无法及时降解。因此,受损的线粒体不能有效地产生三磷酸腺苷 (ATP),导致超氧化物的过度产生,并进一步导致氧化还原稳态失衡。总之,研究通过破坏溶酶体功能提高药物递送效率,并使用自组装策略结合 SDT 在阻断线粒体自噬的同时直接损伤线粒体,这为药物递送和线粒体靶向治疗提供了一条新的途径。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202409425