引言
近年来,随着全球肥胖和代谢综合征的流行,代谢功能障碍相关脂肪肝病(Metabolic dysfunction-associated steatotic liver disease,MASLD)正日益成为威胁公众健康的重要问题。这种疾病以肝脏内脂质,主要是甘油三酯的过量堆积为特征,并常伴随代谢综合征的其他表现,如内脏脂肪过多、胰岛素抵抗和高血压。MASLD不仅可能发展为肝硬化和肝癌,还与心血管疾病和肾脏疾病等全身性健康风险密切相关。值得注意的是,心血管疾病已成为MASLD患者的主要死亡原因,而肝脏相关死亡则相对较少。然而,临床上也观察到,即便代谢指标较轻微,一些患者仍会快速发展为严重的肝病,这提示MASLD可能存在复杂的致病机制。
为了揭示这一疾病的异质性,12月9日Nature Medicine的研究报道“Partitioned polygenic risk scores identify distinct types of metabolic dysfunction-associated steatotic liver disease”,在全球范围内对数万个病例样本进行了深入的遗传学分析。通过基因组广泛关联研究(GWAS),研究团队首次鉴定出了多种与MASLD相关的新基因位点,并借助分区多基因风险评分(Partitioned Polygenic Risk Scores, pPRSs)成功区分了MASLD的两种主要亚型:一种是局限于肝脏的肝脏特异性亚型,表现为更严重的肝病风险;另一种则为系统性亚型,与更高的心血管疾病风险密切相关。这一发现不仅揭示了MASLD的病因学复杂性,还为精准医疗提供了新的思路。

代谢性脂肪肝:全球健康的新威胁
近年来,代谢功能障碍相关脂肪肝病(Metabolic dysfunction-associated steatotic liver disease,MASLD)正在迅速成为全球健康领域的新挑战。这种疾病以肝脏中脂质(主要是甘油三酯)异常积累为特征,并与代谢综合征的其他表现如内脏脂肪过多、胰岛素抵抗、高血压等密切相关。MASLD的发病机制复杂,病程进展多样,最严重时可导致肝硬化、肝癌,甚至危及生命。
根据研究数据显示,MASLD的全球发病率正与肥胖和代谢疾病的流行趋势同步攀升。研究人员指出,MASLD的危害远不局限于肝脏,其与心血管疾病的关联尤其值得关注。事实上,心血管疾病已成为MASLD患者的主要死亡原因,而因肝病导致的死亡相对较少。这一现象表明,MASLD不仅仅是肝脏的局部问题,更是全身代谢失调的标志。
尽管MASLD对健康的影响如此广泛,其诊断和治疗却面临诸多挑战。一方面,MASLD的临床表现具有异质性,部分患者即使代谢指标相对正常,也可能快速发展为严重肝病。另一方面,MASLD还表现出复杂的遗传背景。基因组广泛关联研究(GWAS)已发现多种与MASLD相关的遗传位点,但这些位点却与心血管疾病的风险没有直接关联,这提示MASLD的致病机制可能存在独立性和多样性。
为何脂肪肝不再只是“肝脏问题”?
MASLD在传统观念中常被视为一种局限于肝脏的代谢疾病。然而,随着研究的深入,人们逐渐认识到,MASLD不仅仅影响肝脏功能,还与全身性代谢障碍和心血管疾病密切相关,这使其成为一种复杂的系统性疾病。
研究显示,MASLD患者往往伴随代谢综合征的其他特征,如内脏脂肪过多、胰岛素抵抗、高血压和血脂异常。这些代谢异常不仅会进一步加重肝脏的脂肪堆积和炎症反应,还会显著增加心血管疾病的风险。例如,心力衰竭、高血压和动脉粥样硬化等心血管事件在MASLD患者中的发生率显著升高。
特别值得关注的是,虽然MASLD与心血管疾病之间存在密切的流行病学关联,但这一联系的机制却异常复杂。一些基因研究发现,某些导致肝脏脂肪异常积累的遗传变异(如PNPLA3和TM6SF2基因突变)不仅不会增加心血管疾病风险,甚至可能对心血管健康具有保护作用。这表明,MASLD与全身性代谢失调之间的关系可能并非简单的因果关系,而更可能是通过复杂的生物学通路交互作用的结果。
此外,MASLD对其他全身性疾病的影响也不容忽视。例如,MASLD患者的肾脏疾病风险显著升高,这可能与肝脏脂肪堆积导致的全身性炎症反应有关。更令人担忧的是,这些全身性健康风险往往在MASLD的早期阶段就已经显现。
正是由于这些复杂的关联,MASLD不再只是“肝脏的问题”,而是涉及多个系统的全身性代谢紊乱。
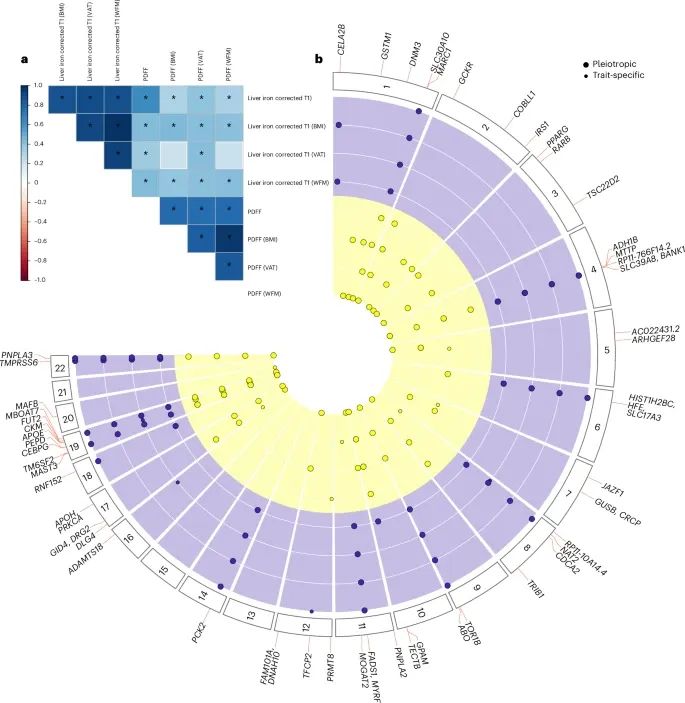
多种脂肪指数调整后,与肝脏甘油三酯含量(PDFF)和肝铁校正T1(cT1)相关的基因位点及其统计分析结果(Credit: Nature Medicine)
a. 不同脂肪指数调整后的遗传相关性
遗传相关性的计算:使用LD评分回归(LD score regression)方法,评估了不同脂肪指数调整下PDFF和cT1之间的遗传相关性。显著性标记:带有星号的相关性值表示经过Benjamini-Hochberg方法校正的假发现率(FDR)小于0.05。可视化表示:图中的颜色条表示遗传相关性值的大小,具体数值和详细统计结果列于补充表3中。主要发现:不同脂肪调整方法(如BMI、全身脂肪质量WFM和内脏脂肪量VAT)对PDFF和cT1的遗传相关性产生显著影响,突出了脂肪分布对遗传研究的重要性。
b. 圆形曼哈顿图展示关键遗传位点
分析方法:使用REGENIE工具进行关联分析,调整了脂肪指数、年龄、性别及其交互项(例如年龄×性别、年龄平方×性别等),同时考虑了前十个基因组主成分和实验批次。数据点含义:每个点代表一个独立的基因位点,颜色标识了该位点的特异性关联:黄色:与肝脏甘油三酯(PDFF)相关的位点。紫色:与肝铁校正T1(cT1)相关的位点。多效性位点:较大的数据点表示具有多效性的位点,这些位点在两种或以上的脂肪指数调整中均与PDFF或cT1相关。显著位点:圆形曼哈顿图中加粗的基因位点表示这些位点在所有脂肪调整模型中均与PDFF和cT1显著相关。统计显著性:仅显示基因组范围内显著(P < 5 × 10⁻⁸)的位点,且P值未进行多模型测试校正。
基因密码揭示:MASLD的遗传奥秘
MASLD的发病不仅受到环境和生活方式因素的影响,还深深烙印着基因的痕迹。近年来,基因组广泛关联研究(Genome-Wide Association Studies, GWAS)成为揭示MASLD遗传机制的重要工具,为我们解码这一复杂疾病的遗传密码打开了新视角。
在该GWAS研究中,研究人员对超过36,000名欧洲裔参与者的遗传数据进行了分析,鉴定出了27个与MASLD显著相关的新基因位点,其中6个位点在独立队列中得到了验证。这些新发现的基因位点涉及多个与脂肪代谢、炎症反应和肝脏纤维化相关的生物学通路。例如,PNPLA3和TM6SF2基因变异被认为是最显著的风险因素,它们不仅会导致肝脏内脂质堆积,还可能加速病程进展至更严重的肝病状态。
有趣的是,这些基因位点对全身性健康的影响并不均一。例如,与MASLD显著相关的PNPLA3基因突变虽然会显著增加肝脏脂肪堆积,但却未增加甚至可能降低心血管疾病的风险。这种特性表明,MASLD的致病机制具有异质性,可能存在不同的疾病亚型。
通过整合这些遗传信息,研究人员进一步生成了分区多基因风险评分(Partitioned Polygenic Risk Scores, pPRS),区分出MASLD的两种主要亚型:肝脏特异性亚型和全身性代谢紊乱亚型。这一发现不仅加深了我们对MASLD遗传基础的理解,还为预测疾病风险和制定个性化治疗策略提供了重要依据。
分区多基因风险评分:预测MASLD的未来工具
在研究MASLD时,研究人员面临的一个关键挑战是如何识别不同亚型的患者以及预测其疾病进展风险。为此,分区多基因风险评分(Partitioned Polygenic Risk Scores, pPRS)作为一种新兴工具,展现了巨大潜力。它不仅能够整合多种遗传变异的信息,还能揭示MASLD的异质性,为疾病分类和精准医疗奠定基础。
在该大规模的遗传学研究中,研究人员通过对已知和新发现的MASLD相关遗传位点进行分析,构建了两个独立的pPRS。这些评分分别基于与肝脏脂质滞留相关的基因变异和全身脂质代谢紊乱相关的基因变异。结果显示,这两个pPRS能够区分MASLD的两种主要亚型:一种是肝脏特异性亚型,患者主要表现为肝脏脂肪堆积,且易发展为严重肝病,如肝硬化或肝癌;另一种是系统性代谢紊乱亚型,患者不仅存在肝脏问题,还伴有显著的心血管疾病和代谢综合征风险。
更重要的是,这两个pPRS在预测MASLD患者的长期健康风险方面具有显著优势。例如,肝脏特异性pPRS与肝脏相关疾病(如肝癌)的风险强烈相关,而系统性代谢紊乱pPRS则更多地与心血管疾病、糖尿病等全身性疾病的发生密切关联。这一分类方式不仅为临床医生提供了更细致的疾病风险评估工具,也为制定个性化的治疗策略提供了科学依据。
肝脏特异性与系统性亚型:谁是更大的健康威胁?
MASLD并非单一的疾病,而是一个由不同亚型组成的异质性综合体。通过分区多基因风险评分(Partitioned Polygenic Risk Scores, pPRS),研究人员识别出了MASLD的两种主要亚型:肝脏特异性亚型和系统性代谢紊乱亚型。这两种亚型在致病机制和健康风险上具有显著差异,为我们重新审视MASLD的健康威胁提供了重要视角。
肝脏特异性亚型的特点是肝脏脂质的过量堆积,主要由PNPLA3和TM6SF2等基因突变引起。这些突变导致脂肪在肝细胞内滞留,而非进入血液循环。因此,这类患者往往表现为严重的肝脏病变,包括肝纤维化、肝硬化和肝癌。然而,令人惊讶的是,由于脂质滞留在肝脏中,该亚型患者的血液脂质水平相对较低,从而降低了心血管疾病的风险。
相比之下,系统性代谢紊乱亚型的特征是全身性的脂质代谢异常。该亚型由影响脂肪合成和氧化的基因变异驱动,如FADS1和ABO基因突变。患者不仅肝脏内脂肪堆积,还伴有高血脂、胰岛素抵抗和高血压等显著的代谢综合征表现。这类患者面临更高的心血管疾病、糖尿病和肾功能衰竭风险。尽管肝脏相关疾病的进展较慢,但系统性代谢紊乱对患者的全身健康构成了更大的威胁。
这两种亚型的差异还体现在潜在的干预策略上。针对肝脏特异性亚型的治疗可能需要关注改善肝脏脂质代谢,而系统性亚型的管理则需要更全面的代谢综合征控制。这一发现为MASLD的精准分类和治疗提供了重要依据,也提醒我们,识别亚型差异是制定有效治疗方案的关键。
MASLD患者的个性化干预
随着对MASLD遗传机制的深入研究,精准医疗的曙光正逐渐照亮这一复杂疾病的治疗和预防之路。通过基因组广泛关联研究(GWAS)和分区多基因风险评分(pPRS)的应用,MASLD的两种主要亚型:肝脏特异性亚型和系统性代谢紊乱亚型的明确识别为个性化干预策略提供了重要依据。
针对肝脏特异性亚型,研究发现PNPLA3和TM6SF2基因突变是关键风险因素,这些变异会导致肝脏脂质滞留和病变加剧。基于这一机制,治疗策略应重点关注改善肝脏脂质代谢,例如开发抑制PNPLA3功能的药物或促进脂质分解的疗法。此外,因该亚型患者的心血管疾病风险相对较低,干预重点可以聚焦于阻止肝病的进一步恶化,降低肝癌的发生率。
相比之下,系统性代谢紊乱亚型患者的治疗更为复杂。这一亚型的患者不仅需要解决肝脏脂肪堆积问题,还需应对全身性的代谢紊乱,包括高血脂、糖尿病和高血压等风险。因此,综合管理策略显得尤为重要,例如使用降脂药物、调节胰岛素敏感性的药物,以及控制血压的干预措施。此外,由于这一亚型的患者心血管疾病风险显著增加,早期的心血管筛查和干预显得尤为重要。
除了治疗上的差异化,MASLD的个性化预防策略也开始显现。通过遗传风险评分,医生可以更早地识别高风险个体,并针对不同亚型提出针对性的生活方式调整建议,例如控制体重、减少酒精摄入以及优化饮食结构。对于高风险人群,基因检测和早期影像学监测有望成为常规手段,为疾病的早发现、早干预奠定基础。
精准医疗的核心在于“因人而异”,而MASLD研究的最新进展正是这一理念的生动实践。通过整合遗传学数据和临床信息,我们离MASLD的个性化管理越来越近。这不仅为患者带来了更多治疗选择,也为全球范围内遏制MASLD流行带来了希望。
战胜MASLD的下一步
尽管在MASLD研究方面取得了令人瞩目的进展,这一领域依然面临诸多挑战,许多问题尚待解决。
当前研究的一大局限性在于样本人群的局限性。大多数基因组广泛关联研究(GWAS)主要集中在欧洲裔人群,缺乏对其他族群的充分研究。这种单一化的样本限制了研究结果的普适性,可能导致非欧洲裔人群的遗传风险被低估。未来的研究还需要纳入更具多样性的人群,以确保发现的基因位点和分区多基因风险评分(pPRS)能适用于全球范围的MASLD患者。
另一个挑战在于MASLD的病理机制复杂性。虽然研究揭示了多种与肝脏脂质代谢相关的基因位点,但这些基因变异如何与环境因素(如饮食、运动、酒精摄入等)交互作用仍不明确。此外,虽然分区多基因风险评分为疾病分类提供了工具,但如何将其与临床指标(如影像学数据或生物标志物)结合,提升预测和诊断的准确性仍需进一步探索。
从临床角度来看,将遗传研究成果转化为有效的干预措施也面临困难。例如,针对PNPLA3或TM6SF2基因突变开发的药物尚处于早期阶段,其长期效果和安全性尚未明确。此外,MASLD的异质性决定了“一刀切”的治疗策略可能难以奏效,未来需要更多基于亚型的个性化干预方案。
尽管如此,MASLD研究的未来仍充满希望。随着多组学技术(如转录组学、代谢组学)和人工智能的广泛应用,我们有望更全面地解析MASLD的分子机制。同时,全球范围内协作的大规模研究将为MASLD的诊断和治疗提供更有力的数据支持。
未来的MASLD研究将不仅限于揭示疾病本身,而是聚焦于早期预防和精准干预。这不仅为战胜MASLD带来了曙光,也为全球代谢性疾病的研究和管理提供了重要范式。
参考文献
Jamialahmadi, O., De Vincentis, A., Tavaglione, F. et al. Partitioned polygenic risk scores identify distinct types of metabolic dysfunction-associated steatotic liver disease. Nat Med (2024). https://doi.org/10.1038/s41591-024-03284-0