铜死亡是一种铜诱导的细胞死亡,主要影响依赖线粒体代谢的细胞。虽然p53调节糖酵解代谢,但其在铜代谢中的作用尚不清楚。
2024年12月4日,复旦大学周祥、郝茜、南昌大学熊建萍共同通讯在Molecular Cell在线发表题为“p53 induces circFRMD4A to suppress cancer development through glycolytic reprogramming and cuproptosis”的研究论文,该研究发现环状RNA circFRMD4A对p53介导的代谢重编程和铜死亡至关重要。
CircFRMD4A起源于FRMD4A的转录本,FRMD4A被p53转录激活,CircFRMD4A的形成由RNA结合蛋白EWSR1促进。CircFRMD4A作为一种肿瘤抑制因子发挥作用,并增强癌细胞对elesclomol诱导的铜死亡的敏感性。机制分析表明,circFRMD4A与丙酮酸激酶PKM2相互作用并使其失活,导致乳酸生成减少,糖酵解通量向三羧酸循环方向转移。最后,在异种移植小鼠模型中,p53激动剂和elesclomol协同抑制肿瘤的生长。总之,该研究发现p53通过circFRMD4A促进糖酵解重编程和铜死亡,并提出了一种与野生型p53联合治疗癌症的潜在策略。

肿瘤抑制因子p53通过转录调节参与细胞周期和DNA损伤修复调控的基因表达,维持基因组完整性并防止肿瘤发生。然而,当细胞经历不可逆的损伤时,p53可以触发各种形式的调节细胞死亡(RCD)来消灭这些细胞。铜死亡是一种铜依赖性细胞死亡形式,优先发生在依赖线粒体代谢产生能量的细胞中。一些假说提出了p53在铜死亡的调控中可能起的作用。首先,p53是一种重要的糖酵解调节因子,它抑制糖酵解,但促进三羧酸(TCA)循环和氧化磷酸化。例如,p53抑制两种限速糖酵解酶的活性,即己糖激酶HK220和磷酸果糖激酶PFKM(肌磷酸果糖激酶)或PFKP(血小板磷酸果糖激酶),从而限制癌细胞中的糖酵解。
同时,p53还促进乙酰辅酶A (CoA)或谷氨酸的产生,为TCA循环提供燃料。其次,p53可能促进铁硫团簇的生物发生,而铁硫团簇在铜还原过程中会发生降解。最后,p53控制谷胱甘肽的生物合成,谷胱甘肽不仅是一种有效的抗氧化剂,也是一种天然的铜螯合剂。虽然上述研究提示p53与铜死亡之间可能存在联系,但p53如何控制铜死亡以及参与这一调控的因素仍不清楚。
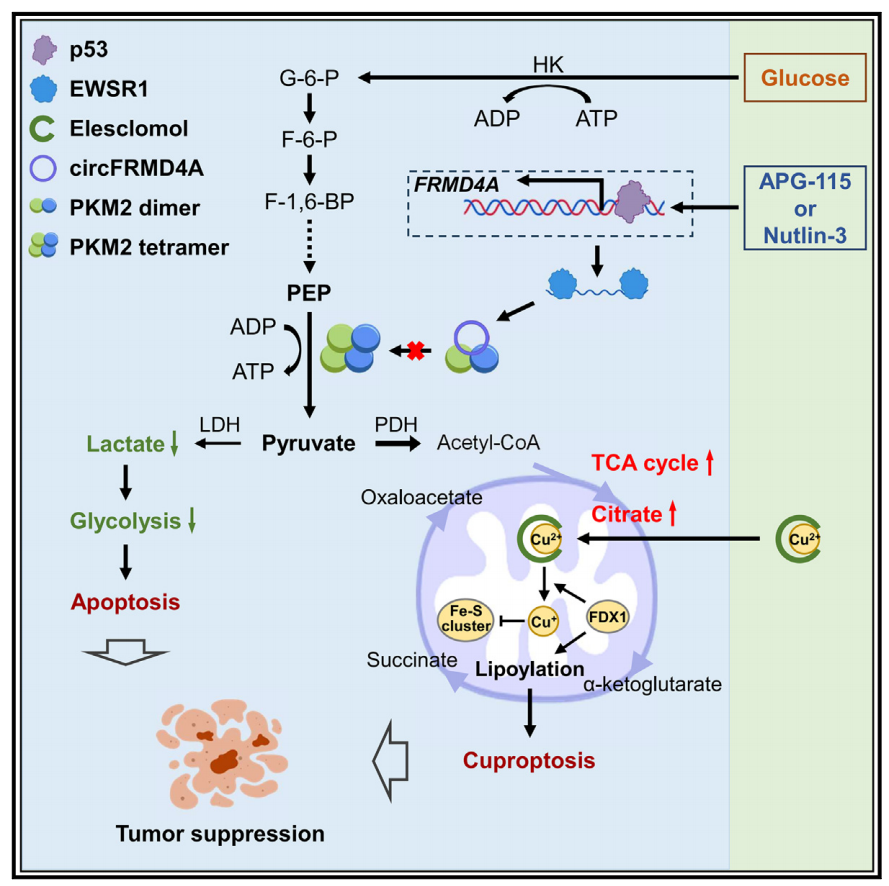
机理模式图(图源自Molecular Cell)
在这项研究中,研究人员鉴定了一个p53调控的环状RNA (circRNA) hsa_circ_0004183,它起源于FRMD4A基因,被命名为circFRMD4A。研究结果显示,circFRMD4A抑制结直肠癌和乳腺癌细胞的生长和进展,较高水平的circFRMD4A表达与较好的预后相关。令人惊讶的是,p53的激活导致癌细胞通过该circRNA对elesclomol诱导的铜死亡敏感。机制分析表明,circFRMD4A与丙酮酸激酶(PK) PKM2相互作用并抑制其活性,从而导致糖酵解抑制和糖酵解通量向TCA循环转移。值得注意的是,p53激动剂APG-115(Alrizomadlin)和nutlin-3与elesclomol联合使用,在体外和体内都能协同抑制癌细胞的生长,这表明了一种可能的联合治疗野生型p53的癌症的方法。
参考消息:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(24)00918-3