肠道疾病的发生发展,如炎症性肠病(IBD)和结直肠癌(CRC),与肠道上皮干细胞(IESC)和祖细胞的稳态失衡密切相关。CDC42作为一种重要的信号通路蛋白,在维持肠道上皮细胞极性和屏障功能中发挥关键作用,但其与肠道疾病的关系仍需进一步探究。
近日,来自美国凯斯西储大学的Xiaonan Han教授研究团队在本刊发表了题为“Monogenic deficiency in murine intestinal Cdc42 leads to mucosal inflammation that induces crypt dysplasia”的研究论文。该研究通过小鼠模型和患者样本,探讨了肠道CDC42在调控IESC稳态、黏膜炎症和肿瘤发生中的作用。
01 CDC42的异常表达与IBD、CRC发病机制相关
研究团队分析了克罗恩病(CD)和溃疡性结肠炎(UC)患者的结肠手术样本,发现CDC42的表达显著低于正常对照组。此外,CDC42在隐窝内的表达降低与UC和CD的组织学疾病活动性呈显著负相关。进一步的研究发现,CDC42在结直肠癌(CRC)组织中的高表达与疾病的严重程度呈正相关,且与CRC患者较低的生存率相关联。这些结果强调了CDC42在IBD和CRC病理进程中的关键作用,并提示其可能作为治疗干预的潜在靶点或预后评估的生物标志物。
02 小鼠肠道Cdc42的持续缺失导致黏膜炎症,进而引发隐窝异型增生
研究团队构建了Cdc42肠上皮细胞特异性敲除的小鼠——VilCre;Cdc42f/f (图1A)。研究发现,这些小鼠出现了绒毛-隐窝结构破坏、黏膜炎症和隐窝异型增生(图1B、C、H)。这些结果表明,肠道Cdc42的持续缺失是导致黏膜炎症和隐窝异型增生的重要因素。
03 肠道Cdc42的诱导性缺失减少Lgr5+ IESC的数量,并增加IEC祖细胞增生和粘膜炎症
研究团队进一步构建了诱导性Cdc42缺失小鼠模型(图1D),发现Cdc42缺失显著减少了Lgr5+ IESC的数量,并导致了IEC祖细胞的过度增生和黏膜炎症,最终导致隐窝异型增生(图1I、J)。这些结果表明,Cdc42在维持IESC/祖细胞稳态中的关键作用,并提示其在肠道炎症和肿瘤发生中的潜在作用。
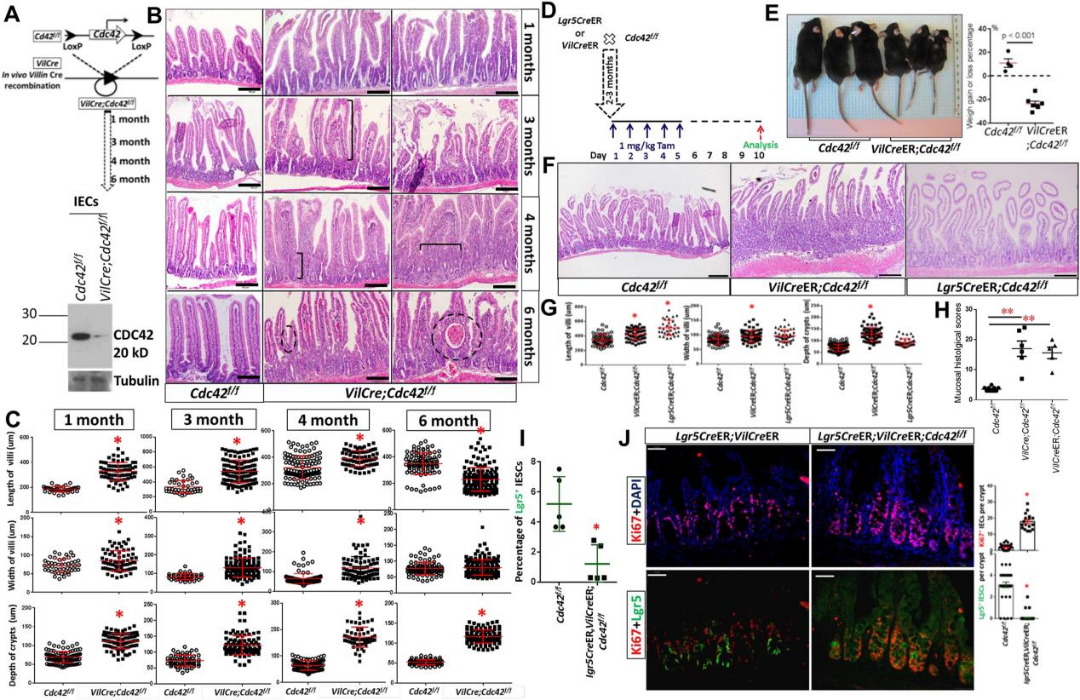
图1 肠道Cdc42的持续缺失导致黏膜炎症,进而引发隐窝异型增生(原文中Figure 3)。
04 Cdc42缺失增加小鼠对辐射诱导的结肠炎的敏感性
通过辐射诱导的损伤模型(图2A),研究团队发现Cdc42缺失的小鼠在辐射后显示出更严重的黏膜损伤和更少的再生隐窝(图2B、C)。此外,潘氏细胞迁移增加,再生隐窝中潘氏细胞的数量降低(图2D、E)。这些结果表明Cdc42在IESC/祖细胞的再生和黏膜愈合中发挥重要作用。
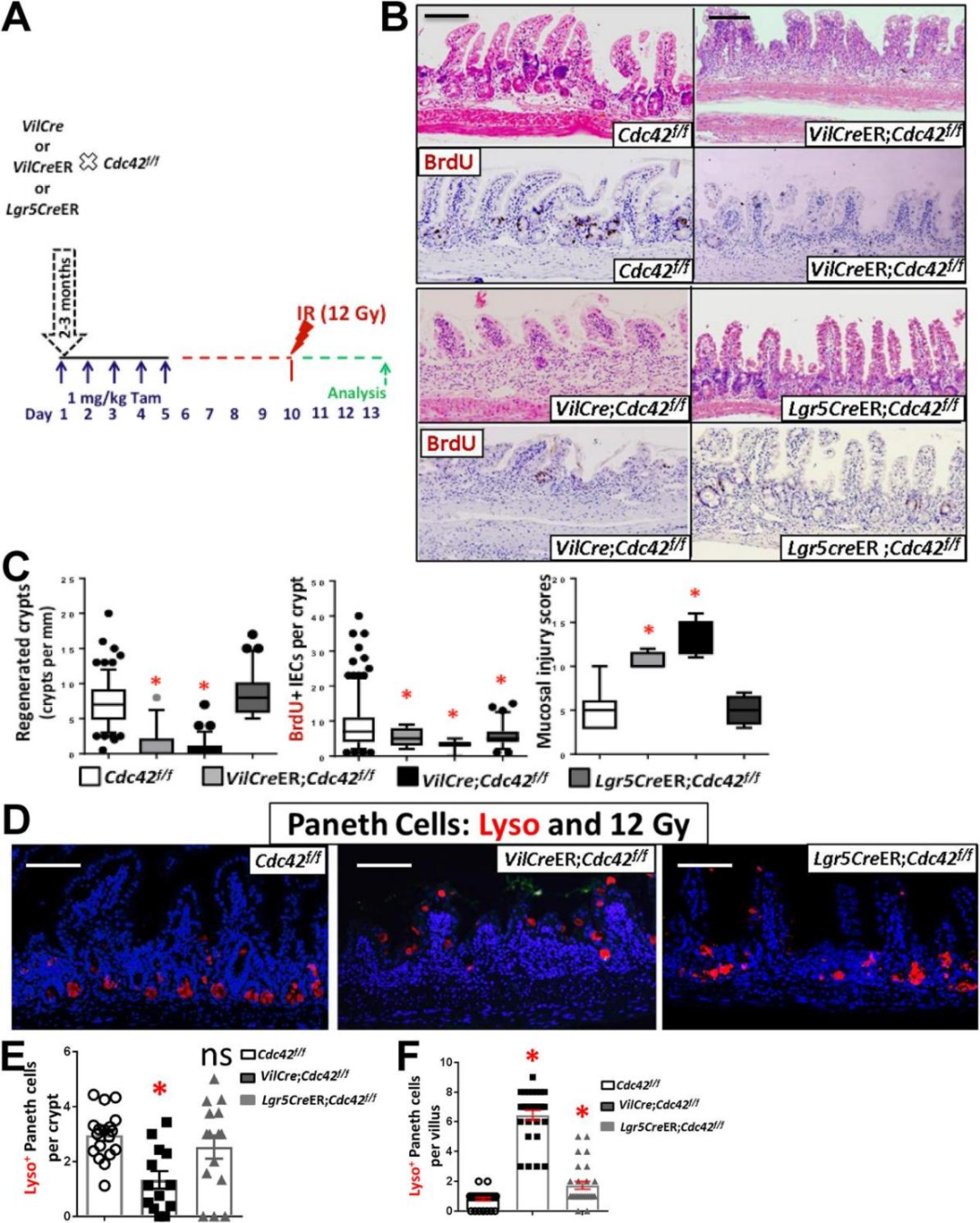
图2 肠道Cdc42诱导缺失增加γ射线引起的损伤(原文中Figure 4)。
05 Cdc42缺失导致结肠IEC的转化和对辐射诱导的结肠炎的敏感性增加
在老年小鼠中,Cdc42的持续缺失导致结肠IEC的过度增生、黏膜炎症和隐窝异型增生(图3B、C)。在Cdc42缺失的结肠细胞中观察到β-catenin在细胞核内的积累,这可能与衰老背景下Lgr5+干细胞的丢失有关。
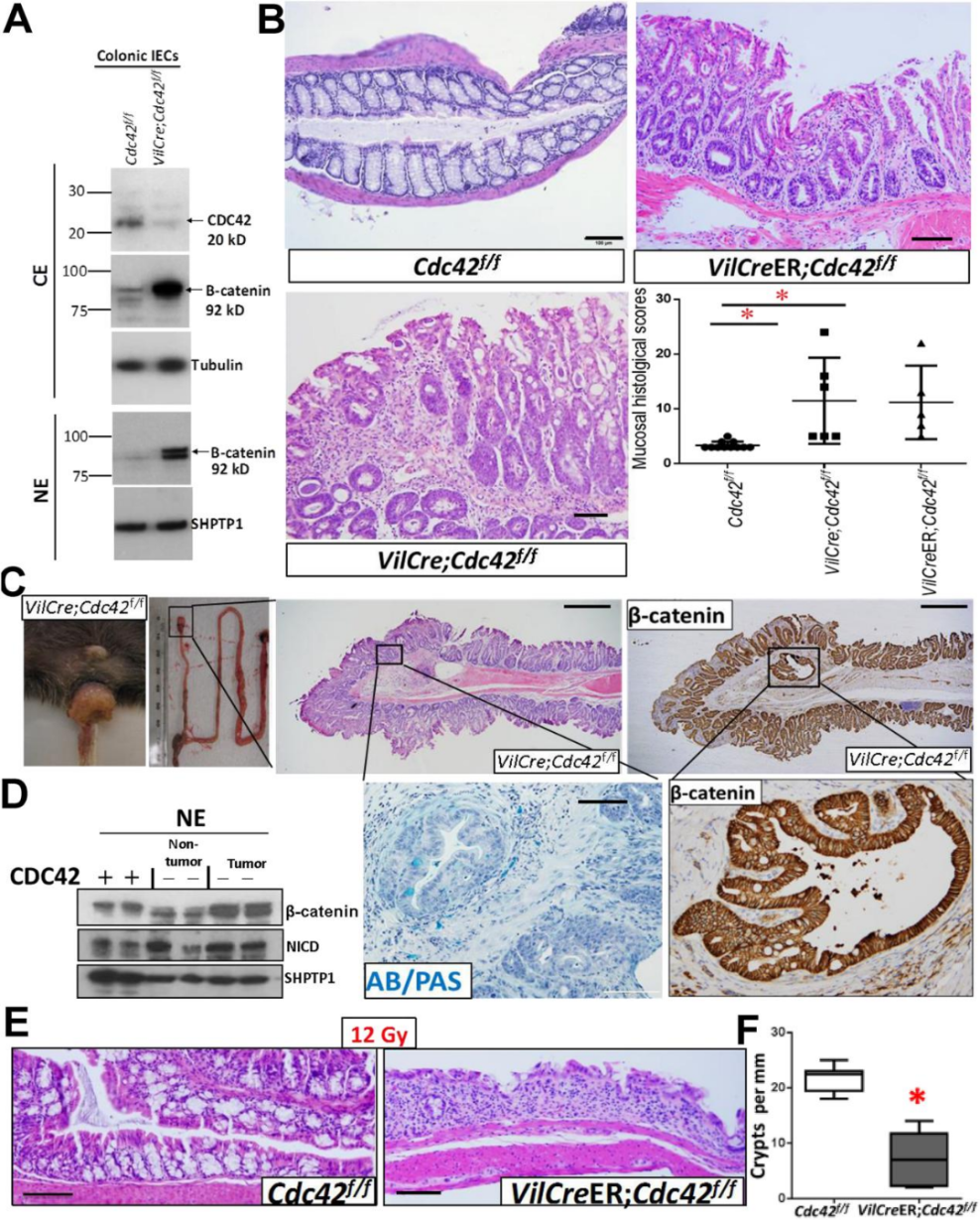
图3 结肠Cdc42的缺失导致结肠IEC发生转化,对辐射诱发的结肠炎更敏感(原文中Figure 5)。
总之,这项研究揭示了肠道CDC42在调控IESC稳态、黏膜炎症和肿瘤发生中的关键作用。Cdc42的缺失不仅导致黏膜炎症和隐窝异型增生,还增加了小鼠对辐射诱导的结肠炎的敏感性。这些发现为理解肠道疾病的发病机制提供了新的视角,并为开发新的治疗策略提供了潜在的靶点。
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304222003300
引用这篇文章:
Dongsheng Z, Wenjuan T, Haitao N, et al. Monogenic deficiency in murine intestinal Cdc42 leads to mucosal inflammation that induces crypt dysplasia. Genes Dis. 2024;11(1): 413-429.