心脏肥厚是导致心力衰竭的关键因素,但其发病机制尚未完全阐明。Mettl1催化的RNA N7-甲基鸟苷(m7G)修饰与缺血性心脏损伤和纤维化有关。
2024年5月29日,哈尔滨医科大学杨宝峰、杜伟杰及Yuan Ye共同通讯在Advanced Science 在线发表题为“The m7G Methyltransferase Mettl1 Drives Cardiac Hypertrophy by Regulating SRSF9-Mediated Splicing of NFATc4”的研究论文,该研究表明m7G甲基转移酶Mettl1通过调节SRSF9介导的NFATc4剪接驱动心肌肥厚。该研究发现,在横断主动脉收缩(TAC)和血管紧张素II (Ang II)输注后,Mettl1在人类衰竭心脏和肥厚小鼠心脏中上调。YY1在心肌肥厚过程中作为Mettl1的转录因子。
Mettl1敲除可减轻TAC或Ang II刺激引起的压力过载时心脏肥厚和功能障碍。相反,心脏特异性的Mettl1过表达会导致心脏重塑。Mettl1通过诱导SRSF9 mRNA的m7G修饰增加SRSF9的表达,促进NFATc4的选择性剪接和稳定,从而促进心脏肥厚。此外,在体内和体外,敲低SRSF9可防止TAC-或Mettl1诱导的心脏肥厚表型。该研究确定Mettl1是心脏肥厚的关键调节因子,为HF提供了新的治疗靶点。

心肌肥厚最初是心肌对各种心脏疾病引起的机械性应激的代偿反应。然而,由持续应激引起的病理性心脏肥大以心脏结构和功能改变为特征,是心力衰竭(HF)发展的独立危险因素。心肌肥厚的发病机制非常复杂,涉及神经激素激活、钙处理障碍、代谢改变、细胞重编程和多种信号通路的调节。尽管在治疗心衰方面取得了重大进展,但从心脏肥厚到心衰转变的机制在很大程度上仍然是难以捉摸的。
RNA表观遗传调控,特别是由m6A介导,涉及心脏疾病,包括心脏损伤、纤维化和肥大。另一种新兴的RNA修饰,N7methylguanosine (m7G),最近被发现,通常存在于mRNA、tRNAs、RNAs和mRNA的5 '帽中。RNA中的m7G修饰是由甲基转移酶复合体催化的,该复合体包括Mettl1和WDR4。研究表明,Mettl1介导的m7G修饰作为一种致癌因素参与了各种癌症的进展。此外,Mettl1与缺血后增强的蛋白质合成和血管生成有关。最近的研究揭示了Mettl1在心肌细胞和成纤维细胞对缺血性损伤的病理生理作用。TMEM11与Mettl1相互作用,促进m7G修饰ATF5 mRNA,从而调节心肌细胞增殖。此外,Mettl1的成纤维细胞特异性缺陷已被证明可减弱心肌梗死后的成纤维细胞活化和纤维化。然而,Mettl1/m7G在非缺血性心肌肥厚和HF中的作用仍未被探索。
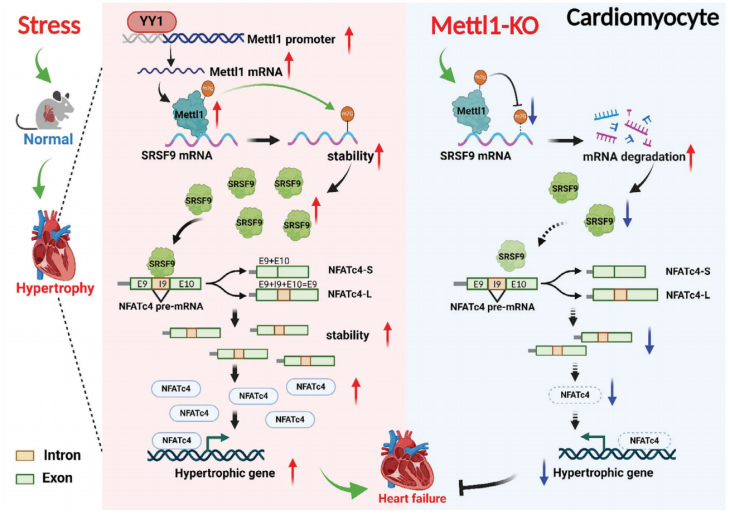
M7G甲基转移酶靶向SRSF9/NFATc4轴调控心肌肥厚(图源自Advanced Science )
该研究探讨了Mettl1介导的m7G RNA修饰在心肌肥厚中的作用和机制。该研究揭示了先前未被认识到的Mettl1作为压力过载下心脏肥大和重塑的核心驱动因素的作用,通过体内和体外进行的增益和损失功能研究证明了这一点。此外,还阐明了Mettl1甲基化SRSF9 mRNA以m7G依赖的方式增强其稳定性,从而促进NFATc4的选择性剪接和稳定,从而促进心脏肥厚生长。这些发现表明,靶向Mettl1可能是治疗心力衰竭的一种有希望的治疗策略。进一步探索Mettl1及其下游效应物可能为心脏肥厚和心力衰竭的新型治疗干预措施的发展提供有价值的见解。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202308769