心肌缺血(MI)是一种严重的病理状态,可引发心肌梗死。其主要特征是心脏血液灌注减少,进而导致供氧减少和心肌能量代谢异常。尽管在血流恢复时,缺血心肌可以重新获得正常灌注,但含氧血液的恢复却可能促使缺血组织逐渐恶化,这一现象被医学界称为缺血/再灌注损伤(I/R)。
近年来,中医药作为防治心血管疾病的重要资源在心肌梗死治疗领域展现出巨大的发展潜力。人参皂苷Rg1(Rg1),作为人参及三七的主要活性成分之一,已证实其对心血管系统具有显著的保护作用。包括对抗心肌缺血再灌注损伤、抑制细胞凋亡以及促进心肌血管生成等。然而,目前关于Rg1在心血管保护机制方面的研究尚不全面,仍需进一步深入探索。
近日,一篇名为“Integration of virtual screening and proteomics reveals potential targets and pathways for ginsenoside Rg1 against myocardial ischemia”的论文揭示了人参皂苷Rg1对抗心肌缺血的相关作用。

图1 论文首页
潜在靶点的富集分析
GO富集分析结果(图2A)表明,BP条目主要涉及细胞对氧化应激和活性氧的响应机制,以及MAP激酶活性的调控等生物过程。CC条目则主要集中在转录因子复合物、血液微粒、膜结构域及膜筏等细胞组分的描述。在MF方面,富集条目涵盖了蛋白丝氨酸/苏氨酸激酶活性、脂肪酸结合、激素结合、单羧酸结合及羧酸结合等多种分子功能。
DO富集分析作为一种从疾病角度对基因进行注释并深入探究疾病发病机理的工具,其结果揭示了交叉基因主要关联于冠状动脉疾病、结缔组织癌、乳腺癌、骨癌等癌症类型,以及肥胖等健康问题(图2B)。此外,排名前10位的KEGG途径主要涉及活性氧的代谢、FoxO信号通路、MAPK信号通路、癌症中的蛋白聚糖以及动脉粥样硬化等关键生物过程(图2C)。
综合GO、KEGG和DO富集分析的结果,可以推测氧化应激、活性氧及MAP激酶活性可能是Rg1对抗心血管疾病(CVD)的重要相关问题。这些要素在基因注释中频繁出现,表明它们可能在Rg1对CVD的作用和机制中扮演关键角色。因此,氧化应激损伤模型可能适用于研究Rg1对CVD的影响及其潜在机制。
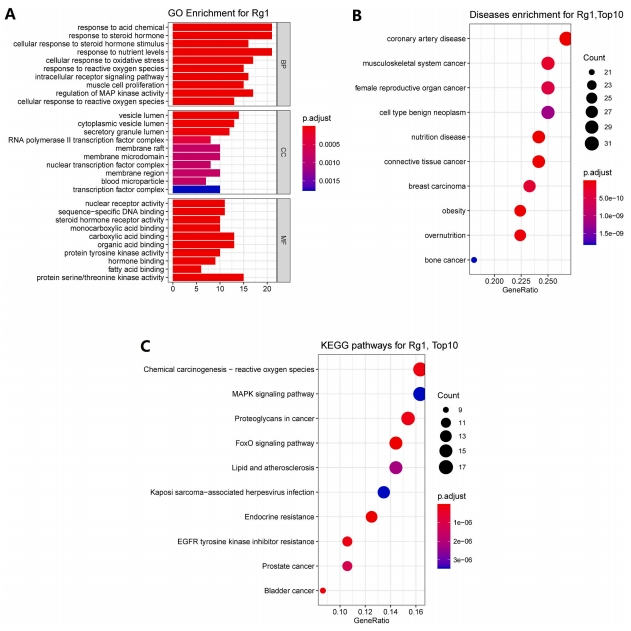
图2 潜在靶点的富集分析
Rg1对H2O2诱导心肌细胞损伤的保护作用
研究将不同浓度的H2O2(分别为100、150、200、250和300μM)作用于正常培养的H9c2细胞持续2.5小时的实验中,发现随着H2O2浓度的递增,细胞活力呈现出逐渐下降的趋势。当H2O2浓度达到150μM时(图3A(a)),相较于正常对照组,细胞活力仍维持在75%以上的较高水平。然而,当H2O2浓度升至200μM时,细胞活力显著下降至约50%,表明成功构建氧化应激损伤模型。因此,研究选择使用200μM H2O2处理细胞2.5小时作为模拟H9c2细胞氧化应激损伤的条件。
为评估Rg1对正常培养的H9c2细胞可能存在的毒性效应,研究进一步开展了分级浓度的Rg1溶液(6.25、12.5、25、50、100和200μM)对细胞的24小时处理实验,并对细胞活力进行了检测(图3A(b))。结果表明,在6.25至200μM的浓度范围内,Rg1对H9c2细胞的生长并未产生任何显著影响。
此外,当使用H2O2对细胞造成损伤时(图3A(c)),加入不同浓度的Rg1(12.5、25和50μM)能够显著提高细胞的存活率,分别至54.42%、55.32%和58.24%,相较于模型组的43.50%有显著提升。这一结果充分表明,Rg1对H2O2诱导的心肌细胞损伤具有显著的保护作用。
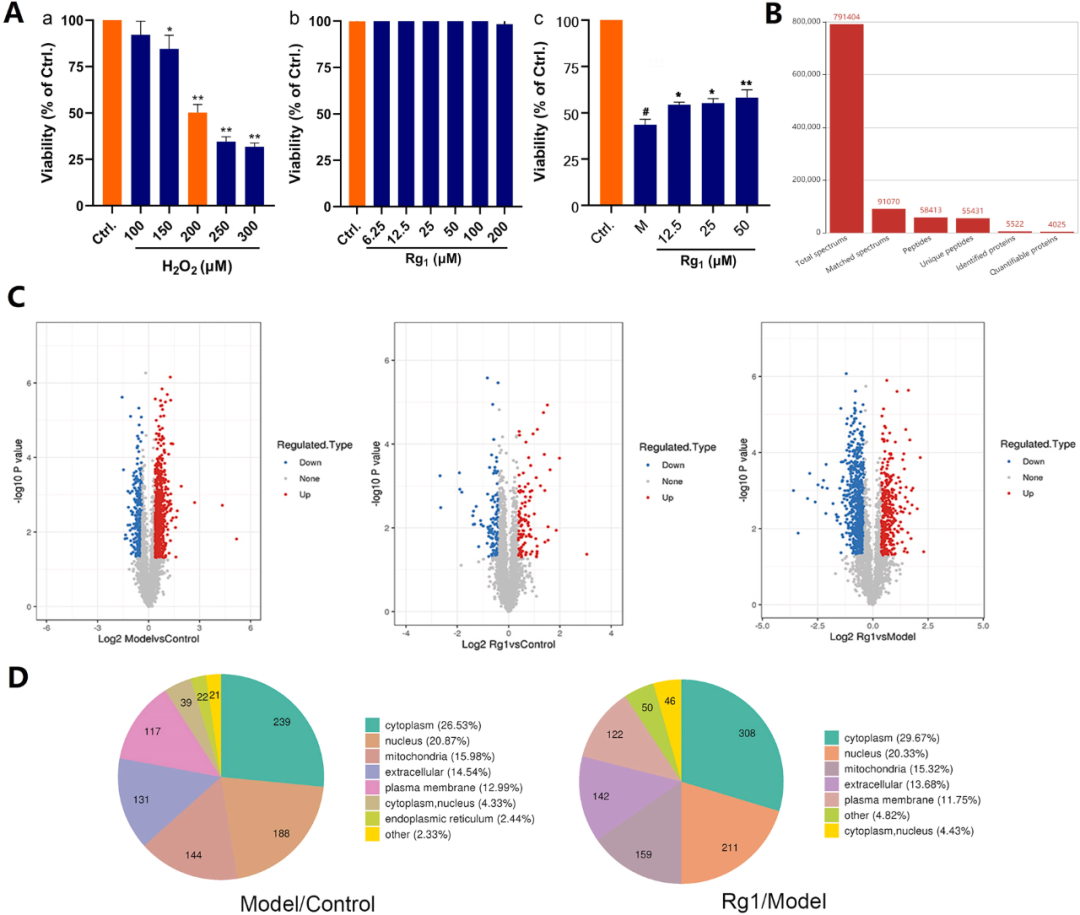
图3 Rg1对心肌细胞损伤的保护作用及质谱分析
Rg1干预H2O2损伤心肌细胞的定量蛋白质组学研究
经过深入分析,研究共鉴定出5522种蛋白质,其中4025种蛋白质可用于定量研究(图3B)。在差异表达分析中,设定了显着上调和显着下调的变化阈值,分别为变化大于1.3和小于1/1.3(p值<0.05)。不同组中差异表达蛋白(DEP)的数量呈现出显著差异(图3C)。相较于对照组,模型组中DEPs数量达到901个,其中587个蛋白质表达上调,314个蛋白质表达下调,表明H2O2损伤后心肌细胞的蛋白质表达水平发生了显著变化,并成功构建了损伤模型。
进一步地,在Rg1干预组中,研究者观察到1038个DEPs,其中346个蛋白质表达上调,692个蛋白质表达下调。表明在Rg1的作用下,H2O2干扰的心肌细胞中蛋白质的表达模式再次发生调整,提示Rg1可能对心肌细胞具有保护作用。
关于DEPs的亚细胞结构定位(图3D)模型组与正常组之间的DEPs主要分布在细胞质(占26.53%)、细胞核(占20.87%)、线粒体(占15.98%)以及细胞外区域(占14.54%)。在Rg1处理组与模型组之间,DEPs的分布模式亦有所变化,其中细胞质占29.67%,细胞核占20.33%,线粒体占15.32%,细胞外区域占13.68%。结果显示,大量蛋白质在细胞质、细胞核和线粒体之间的分布存在差异,进一步暗示了H2O2对心肌细胞的损伤机制以及Rg1对缺血心肌细胞模型的保护机制可能主要涉及这些关键细胞器的功能。
Rg1干预对MAPK关键蛋白及氧化磷酸化通路的影响
实验结果指出(图4-图5),MAPK1可被确立为Rg1抑制H2O2诱导心肌细胞损伤的核心蛋白。在OXPHOS途径中,Rg1显著抑制复合物I(如NDUFS1等)和复合物III亚基(如UQCRC2等)的表达,同时积极促进复合物II(如SDHB等)在减少H2O2诱导的H9c2氧化应激中的功能发挥。据此可以推测,Rg1通过下调复合物I和复合物III的亚基表达,可以有效抑制H2O2诱导的氧化应激反应,进而减少ROS的产生,并促进复合物II的亚基表达,催化琥珀酸氧化成铁氧还蛋白,从而确保电子传递链能够高效产生ATP,防止细胞因能量缺乏而走向凋亡。
此外,证实Rg1是否通过靶向MAPK1来抑制OXPHOS途径,尚需积累更多的实验证据。具体而言,可利用异丙肾上腺素(ISO)诱导的以及左前降支(LAD)结扎诱导的MI小鼠模型,对Rg1在调节MAPK1及其下游蛋白表达和OXPHOS途径方面的作用进行验证。在此基础上,如进一步探究MAPK1与OXPHOS途径的关系,并深入验证Rg1在MAPK1敲低的MI动物模型中对MAPK1和OXPHOS途径的靶向作用,还需要构建相应的基因编辑动物模型,如MAPK1敲低(MAPK1(-/-)小鼠)。
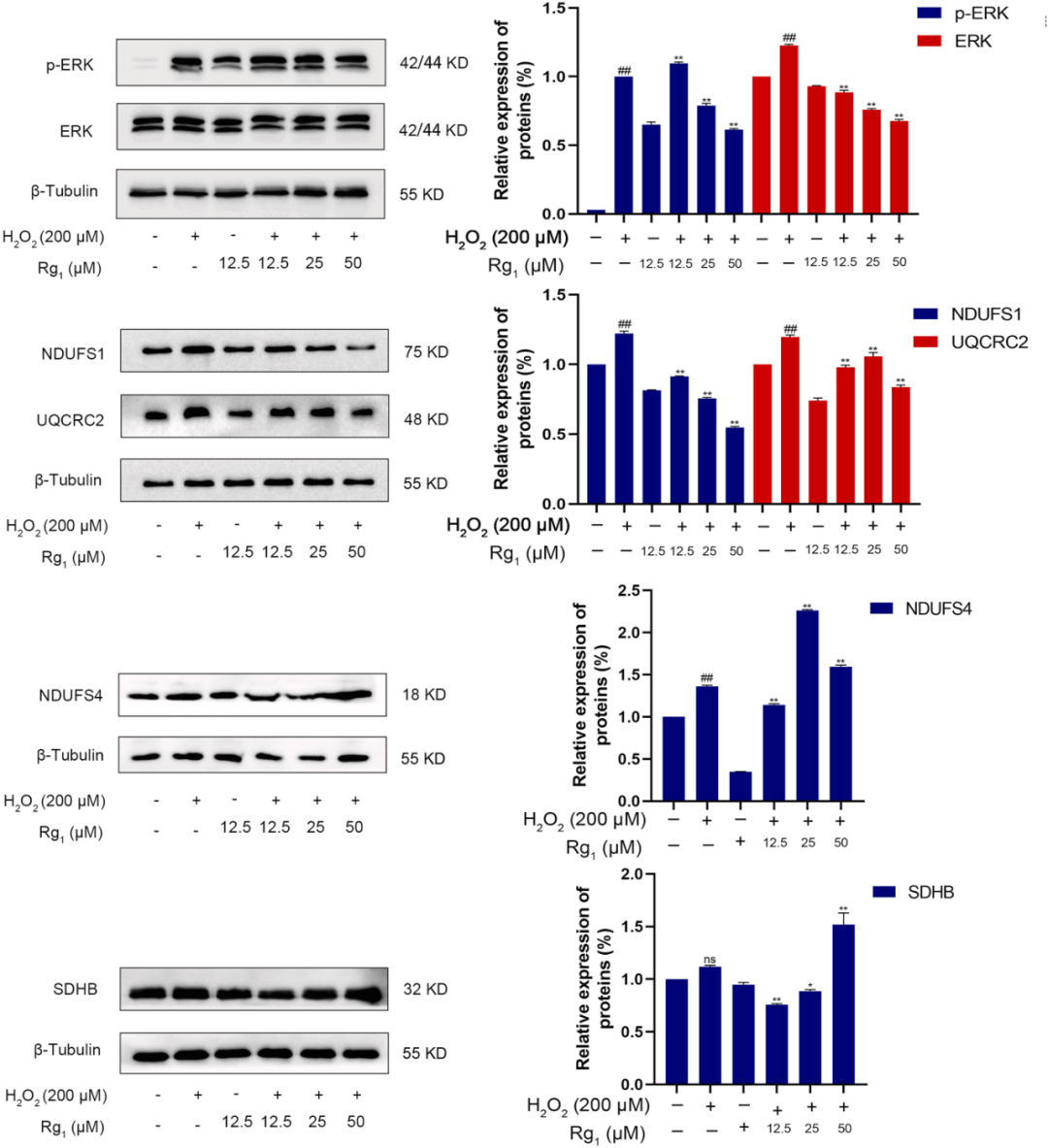
图4 Rg1降低了MAPK和氧化磷酸化途径的磷酸化和活化
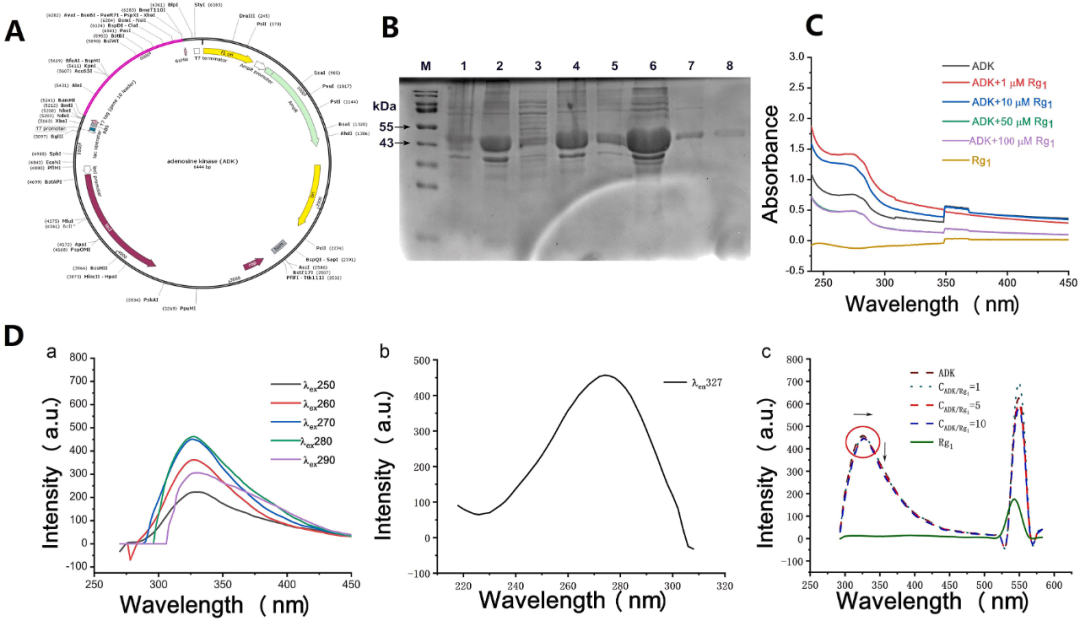
图5 ADK与不同浓度的Rg1之间的相互作用
结论
总之,Rg1在缓解H2O2诱导的H9c2心肌细胞氧化应激方面展现出了显著的效果,该研究不仅为Rg1在临床治疗领域的应用奠定了坚实的科学基础,同时也为探索其他天然活性成分的作用靶点或作用途径提供了宝贵的方法学借鉴与参考。
参考文献:
Rongfang Xie, Chenlu Li, Chenhui Zhong, Zuan Lin, Shaoguang Li, Bing Chen, Youjia Wu, Fen Hu, Peiying Shi, Hong Yao,Integration of virtual screening and proteomics reveals potential targets and pathways for ginsenoside Rg1 against myocardial ischemia,Journal of Ginseng Research.2024.doi.org/10.1016/j.jgr.2024.02.001