脑膜炎由于进展迅速,对健康构成了重大风险,在静脉注射抗生素时,尤其是在跨越血脑屏障时,也遇到了挑战。为了解决这些问题,台湾清华大学宋信文教授和台大医院Wei-Tso Chia等人开发了一种炎症激活的内源性巨噬细胞(MΦ)介导的口服前药递送系统,用于细菌性脑膜炎的靶向治疗干预。该系统由炎症衍生的化学引诱剂引导,并通过炎症诱导的活性氧(ROS)触发药物释放。该系统由天然来源的β-葡聚糖与抗生素头孢噻肟(CTX)通过ROS响应性接头偶联而成,在水溶液中可形成纳米颗粒(β-Glus-CTX NPs)。在肺炎克雷伯菌诱导的脑膜炎小鼠模型中,口服βGlus–CTX NPs经由肠道微折叠细胞穿过肠上皮屏障(IEB),并被固有的内源性MΦ吸收。然后,这些MΦ介导的药物递送载体在其衍生的化学引诱剂的引导下穿过淋巴和循环系统,最终穿过受损的血脑屏障到达发炎的脑组织。在富含ROS的炎症组织环境中,βGlus–CTX NP中的连接体被切割,释放出治疗性CTX。这种口服、内源性MΦ介导的前药递送系统提供了细菌性脑膜炎的靶向抗生素治疗策略,克服了强大的肠脑生物屏障,并有可能提高家庭治疗的有效性。相关工作以“Inflammation-Activated Endogenous Macrophage-Mediated Prodrug Delivery System Overcoming Biological Barriers for Enhanced Oral Meningitis Therapy”为题发表在Advanced Functional Materials。

【文章要点】
MΦ战略性地分布在小肠内,存在于被称为派氏结的特殊淋巴结构中,是将病原体和颗粒等抗原从肠腔输送到派氏结内免疫细胞的重要通道。这些基于小肠的MΦ通过对病原体和抗原的反应,在维持局部免疫平衡方面发挥着至关重要的作用,同时防止可能导致炎症或自身免疫反应的过度免疫反应。利用小肠中丰富的MΦ,本研究介绍了一种炎症激活的内源性MΦ介导的前药递送系统。该系统使用天然来源的多糖,即β-葡聚糖(β-Glus),与抗生素头孢噻肟(CTX)相结合,其中的连接是由ROS响应性硫酮连接体实现的。在水性环境中,前药系统自我组装,最终形成βGlus–CTX NPs(图1)。
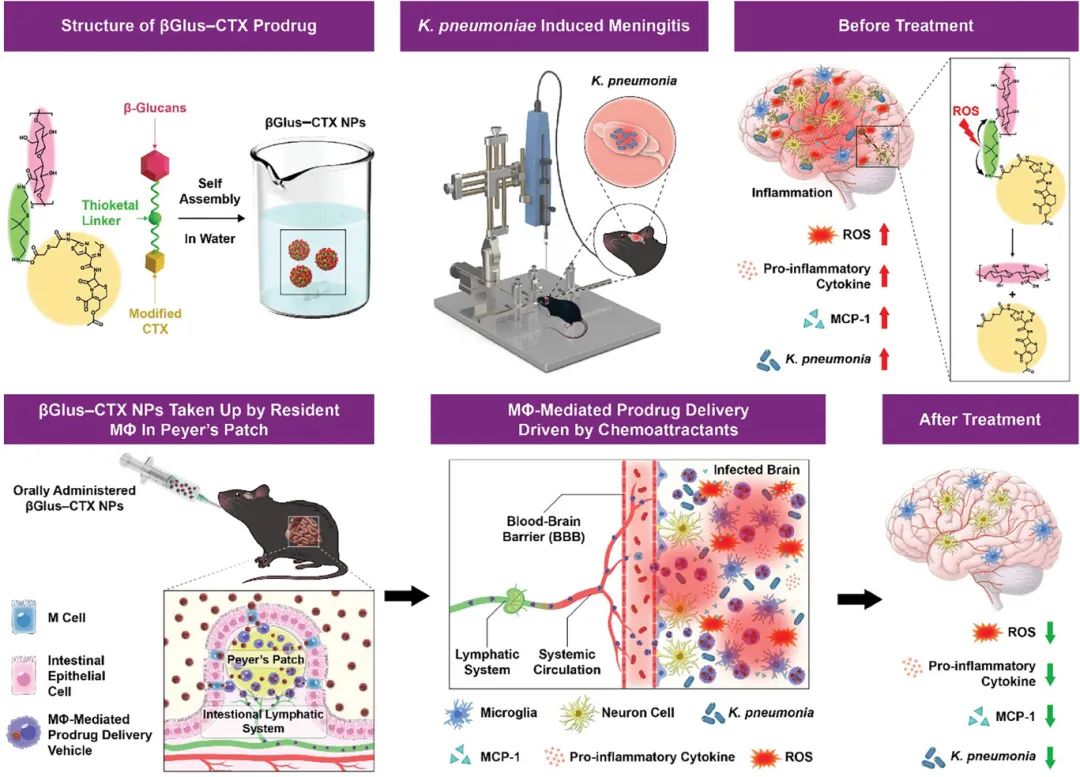
图1 βGlus–CTX NPs及其口服递送途径和治疗机制
在肺炎克雷伯菌(K.肺炎)的细菌性脑膜炎实验小鼠模型中,口服后βGlus–CTX NPs特异性靶向肠道M细胞上的Dectin-1受体,穿过IEB并被派氏结中的内源性MΦ有效地直接吸收。在炎症脑组织释放的MCP-1等化学引诱剂的推动下,由MΦ(MΦ介导的βGlus–CTX NPs)携带的颗粒通过淋巴和循环系统运输,最终穿透被脑膜炎破坏的血脑屏障。此外,炎症脑组织中ROS水平的升高可以触发ROS响应性连接体的分解,释放CTX以启动其治疗效果(图2)。
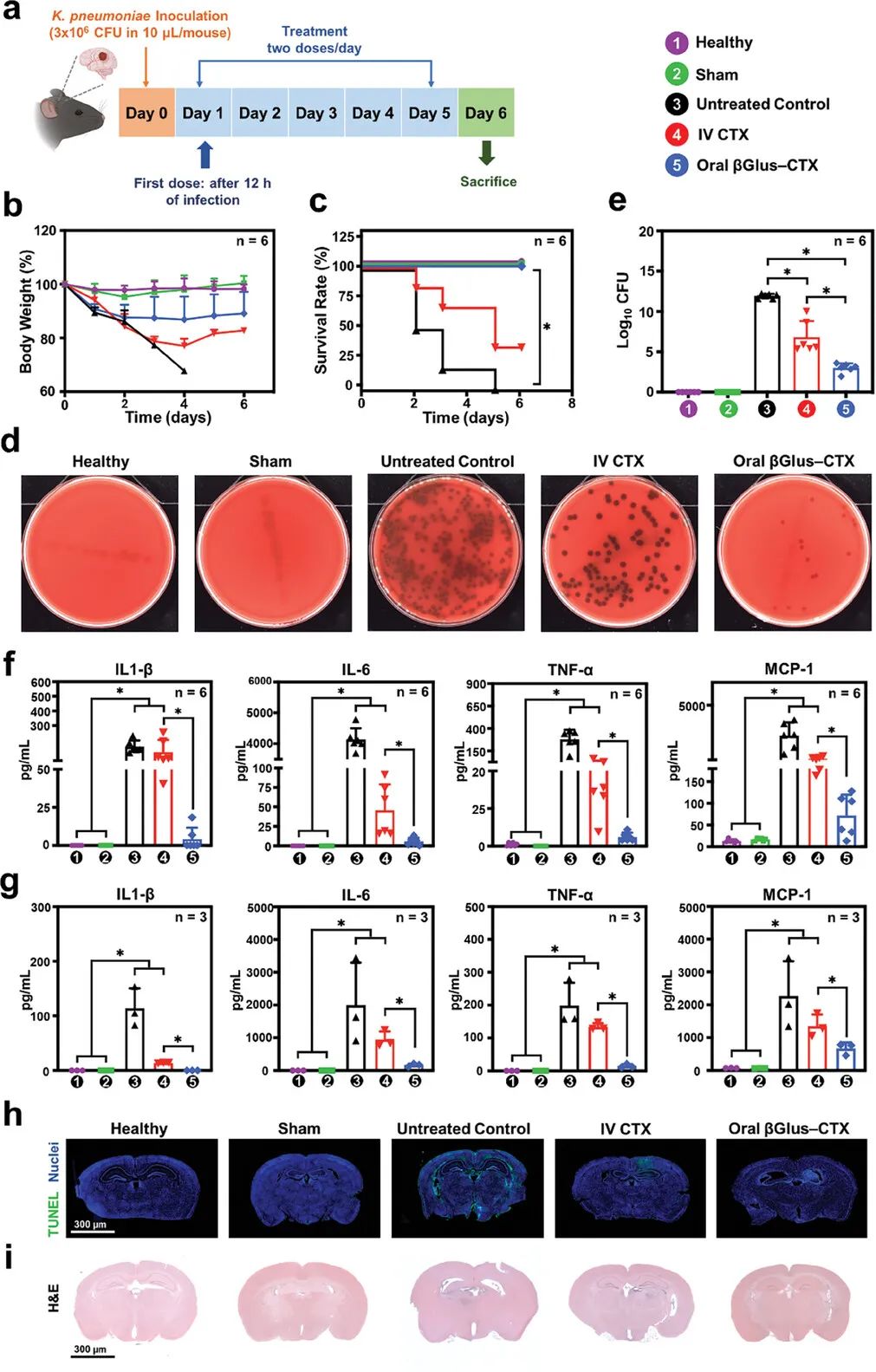
图2 βGlus–CTX NPs在脑膜炎中的抗菌效果
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202401570