套细胞淋巴瘤(MCL)是一种侵袭性B细胞恶性肿瘤,近20年来,治疗创新已经显著改善了患者的预后,目前,含利妥昔单抗的高剂量阿糖胞苷化疗方案后接自体干细胞移植和利妥昔单抗维持治疗是符合移植条件的MCL患者的标准治疗方案,最近的研究显示,在接受移植的患者中,78%的患者在7年时仍然存活且无病,然而,在治疗开始后2年内出现进展性疾病或早期复发的患者(即POD24患者)以及维持治疗后的复发患者,都存在未满足的医疗需求,布鲁顿酪氨酸激酶抑制剂(BTKi)靶向治疗和CAR-T细胞疗法在MCL复发患者中显示了高疗效,将伊布替尼加入标准的一线化疗方案也最近显示出有希望的结果,新兴的靶向治疗和免疫治疗以及CD20抗体维持治疗改变了MCL患者的预后。奥妥珠单抗是一种糖基化工程化、II型抗CD20单克隆抗体,旨在提高抗体依赖的细胞介导的细胞毒性,并已获得批准用于滤泡性淋巴瘤,Lyma-101 II期试验研究了奥妥珠单抗加DHAP(O-DHAP)后接自体干细胞移植和奥妥珠单抗维持治疗的效果,然而,至今尚无前瞻性随机试验比较奥妥珠单抗与利妥昔单抗在MCL中的优劣,该研究通过间接比较一线MCL患者中奥妥珠单抗与利妥昔单抗的效果来探讨这一问题。

方法
研究纳入的对象包括LYMA和LYMA-101临床试验中的患者,LYMA试验(NCT00921414)纳入了299名新诊断未治疗的符合移植条件的MCL患者,随机分为利妥昔单抗维持治疗组(120例)和观察组(120例),LYMA-101试验(NCT02896582)纳入了86名新诊断未治疗的符合移植条件的MCL患者,接受奥妥珠单抗治疗,随后进行自体干细胞移植和奥妥珠单抗维持治疗。该研究首先对LYMA-101试验进行最终分析,使用Kaplan-Meier方法估计生存曲线,并定义了PFS和OS,接着,使用倾向评分匹配(PSM)分析比较了两组患者,以平衡协变量,并比较了两组在诱导治疗结束时的MRD阴性率、PFS和OS,为了比较维持治疗的效果,进行了第二次匹配过程,基于基线特征和诱导治疗结束时的骨髓MRD阴性情况,匹配后进行平衡性检查,使用标准化平均差异(SMD)来检查匹配后各组之间的平衡性。
研究结果
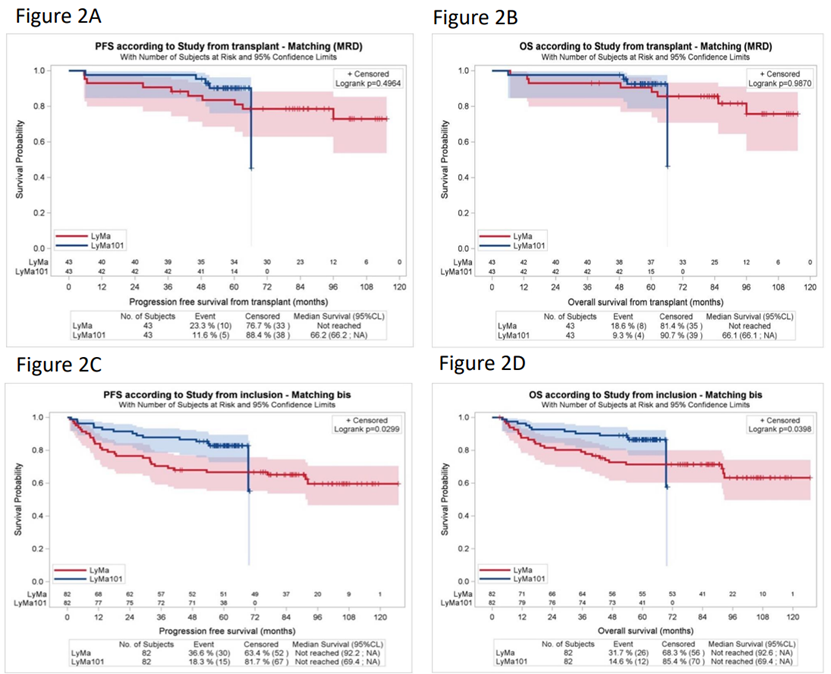
LYMA-101试验的最终分析显示,在接受奥妥珠单抗治疗的MCL患者中,5年PFS和OS的估计值分别为83.4%和86.9%,在诱导治疗结束时,接受奥妥珠单抗治疗的患者骨髓MRD阴性的频率高于接受利妥昔单抗治疗的患者(83.1% vs 63.4%, p=0.007),通过倾向评分匹配,比较了接受奥妥珠单抗维持治疗和利妥昔单抗维持治疗的患者,发现两组在自体干细胞移植后的PFS和OS无差异,从治疗开始时算起,接受奥妥珠单抗治疗的患者估计的5年PFS和OS均优于接受利妥昔单抗治疗的患者(82.8% vs 66.6%, p=0.029; 86.4% vs 71.4%, p=0.039)。
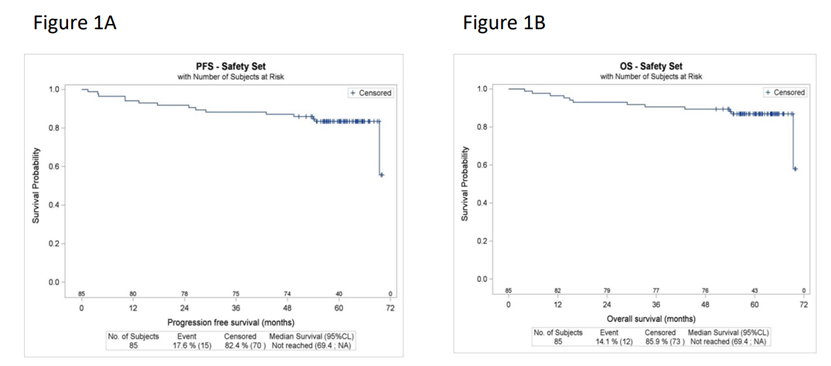
安全性分析
LYMA-101试验中,85名接受治疗的患者中,74名(87.1%)出现了至少1次3级或更高严重不良事件(AE),52.3%的AE发生在诱导期,31%发生在自体干细胞移植期间,16.7%发生在维持期,在维持期,利妥昔单抗组和奥妥珠单抗组的3-4级中性粒细胞减少发生率分别为44.2%和37.6%,两组的3-5级感染发生率相似,分别为12.5%和15.9%,利妥昔单抗组和奥妥珠单抗组的提前停药发生率相同,分别为30.8%,在诱导期,奥妥珠单抗组3-4级输液反应发生率略高于利妥昔单抗组(4.7% vs 0.7%),两组的死亡原因相似,最常见的死因是淋巴瘤,奥妥珠单抗组感染相关死亡率略高于利妥昔单抗组(25% vs 8%),但LYMA-101试验中所有感染相关死亡均与COVID-19有关,而LYMA试验是在大流行前进行的,综上所述,利妥昔单抗和奥妥珠单抗在治疗过程中的安全性相似,尽管奥妥珠单抗组诱导期AE略多,但这并未导致LYMA-101试验中与LYMA试验相比的毒性死亡增加。
结论
奥妥珠单抗在诱导期和维持期均可安全地与化疗联合使用,作为一线治疗方案,与利妥昔单抗相比,奥妥珠单抗可以提供更好的疾病控制,延长PFS和OS,而不增加额外的毒性,LYMA-101试验结果显示,接受奥妥珠单抗治疗的患者5年PFS和OS的估计值分别为83.4%和86.9%,与同类患者人群的其他研究相比,这一结果相当有优势,奥妥珠单抗治疗的患者在诱导治疗结束时骨髓MRD阴性的频率更高(83.1% vs 63.4%)。综上所述,奥妥珠单抗在诱导期和维持期均显示出比利妥昔单抗更好的疗效,是MCL患者一线治疗中首选的CD20抗体,然而,需要进一步的研究来验证这一结论。
原始出处
Clémentine Sarkozy, Mary Bridgid Callanan, Catherine Thieblemont, Lucie Obéric, Barbara Burroni, Krimo Bouabdallah, Ghandi Damaj, Benoit Tessoulin, Vincent Ribrag, Roch Houot, Franck Morschhauser, Samuel Griolet, Clémentine Joubert, Victoria Cacheux, Vincent Delwail, Violaine Safar, Remy Gressin, Morgane Cheminant, Marie-Helene Delfau-Larue, Olivier Hermine, Elizabeth A. Macintyre, Steven Le Gouill; Obinutuzumab versus Rituximab in transplant-eligible Mantle cell lymphoma patients. Blood 2024; blood.2024023944.