聚(ADP-核糖)聚合酶抑制剂(PARPi)耐药是卵巢癌(OC)的重要挑战。虽然DOT1L在癌症和化疗耐药中的作用已得到承认,但其在PARPi耐药中的具体作用尚不清楚。
2024年5月22日,复旦大学陈小军、吴小华及Li Jiajia共同通讯在Molecular Cancer在线发表题为“PARP1-DOT1L transcription axis drives acquired resistance to PARP inhibitor in ovarian cancer”的研究论文,该研究证明,PARP1-DOT1L转录轴驱动卵巢癌对PARP抑制剂获得性耐药。该研究表明,在非BRCA突变的OC细胞中,DOT1L的表达与临床PARPi耐药性之间存在密切的相关性。PARPi耐药组织中DOT1L表达上调与OC患者生存率降低相关。在机制上,PARP1直接与DOT1L基因启动子结合,独立于其酶活性促进转录。
PARPi处理诱导的PARP1诱捕放大了这种结合,增强了DOT1L的转录并促进了耐药性。测序分析显示,DOT1L通过H3K79me2在PLCG2和ABCB1的转录调控中起着至关重要的作用。这证实了PARP1-DOT1L-PLCG2/ABCB1轴是PARPi抗性的关键贡献者。此外,将DOT1L抑制剂与PARPi结合在细胞系来源的异种移植小鼠模型(CDXs)和患者来源的类器官(PDOs)中均显示出协同效应。研究结果表明,DOT1L是OC患者的独立预后指标。PARP1DOT1L/H3K79me2-PLCG2/ABCB1轴被认为是PARPi抗性的关键因素。靶向抑制DOT1L是提高OC患者PARPi治疗效果的一种有希望的治疗策略。

临床中PARPi耐药的机制包括HR修复的恢复、复制叉稳定性的重新建立、复制叉稳定性的保护、PARP1信号通路的恢复以及药物外排的增加。药物外排依赖于ABC转运蛋白 (ABC)转运体,包括ABCB1 (P-糖蛋白,MDR1)。此外,干细胞和转移相关基因的失调也在耐药中起重要作用。PLCG2(磷脂酶C,γ 2)高的癌症表型具有茎样、促转移的特征,这进一步促进了获得性治疗耐药。因此,这些基因之间无序的基因调控谱对PARPi抗性的发展至关重要。
表观遗传过程可以介导对靶向治疗的耐药性,并代表新的治疗靶点,特别是在缺乏明确的耐药遗传机制的肿瘤中。因此,表观遗传调控因子已成为癌症治疗的潜在靶点,FDA已批准或正在进行几种药物的临床试验,包括针对DOT1L/KMT4的抑制剂。DOT1L是一种非SET结构域甲基转移酶,催化H3K79甲基化,参与DNA修复、转录和重组。在白血病和实体肿瘤中,DOT1L已被证明具有肿瘤启动子的细胞功能。值得注意的是,DOT1L是高表达的,在多种癌症的恶性进展中起着至关重要的作用,包括OC。因此,DOT1L是一个很有前景的药物靶点。
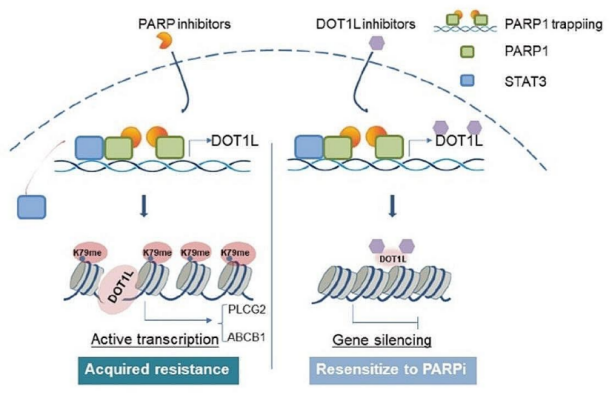
DOT1L在PARPi抗性中作用的工作模型(图源自Molecular Cancer )
此外,DOT1L还参与多种肿瘤化疗耐药的调控。例如,Liu等人观察到C/EBPβ通过重编程DOT1L/H3K79甲基化以维持染色质开放状态来增强卵巢癌细胞的铂耐药,从而增强肿瘤细胞的顺铂耐药。最近的另一项研究表明,DOT1L和menin药物抑制剂共同治疗对化疗敏感和难治性OC细胞的生长抑制具有累加效应。然而,DOT1L在卵巢癌PARPi耐药发展中的作用尚不清楚。该表观遗传修饰子与PARPi治疗方法联合靶向的最佳疗效和具体机制仍有待探索。
该研究确定了DOT1L是PARPi抗性的潜在驱动因素,并发现了DOT1L和PARP1之间的新型串扰,其中PARP1诱导了DOT1L的上调,而不依赖于其催化活性。由于PARPi已被用于治疗癌症患者,这一新发现的活性提出了PARPi诱导的DOT1L活性是否会增加肿瘤进展和耐药性的问题,这可能会减弱PARPi的治疗效果。该研究拓展了PARPi获得性耐药的解释,为临床克服PARPi耐药提供了实验依据。抑制DOT1L联合PARPi在卵巢癌的临床治疗中具有广阔的前景。
原文链接:
https://doi.org/10.1186/s12943-024-02025-8