包括铜(Cu+)/钙(Ca2+)过载在内的离子干扰可激活细胞特异性死亡通道,损伤线粒体并破坏细胞稳态,在抗肿瘤治疗中显示出巨大的潜力。然而,复杂的代谢环境和肿瘤强大的自我保护机制导致了离子干扰治疗的临床失败。而代谢破坏有望成为增强离子干扰的创新策略。
在本研究中,康复大学Jinsheng Shi、Qihui Zhou和青岛农业大学Xiaoying Kong等人制备了CuS-α-CHA&penthiopyrad@CaCO3-RGD纳米颗粒(CCPCR NPs),可在代谢共生破坏策略的辅助下,提供Cu+/Ca2+双过载抗肿瘤治疗,实现肿瘤自我保护的崩溃。此外,在共生代谢的帮助下,被破坏的肿瘤细胞进一步激活M1巨噬细胞的极化以及树突状细胞(DC)的成熟和抗原交叉呈递,从而进一步消灭肿瘤细胞。综上所述,该研究建立了一种代谢共生破坏辅助的放大抗肿瘤双离子干扰策略,对提高离子治疗肿瘤的临床效果具有重要意义。相关工作以“Cu+/Ca2+ Dual-Overload Strategy Assisted by Metabolic-Symbiotic-Destruction for Tumor Apoptosis and Tumor Immune Activation”为题发表在Advanced Functional Materials。

【文章要点】
由于肿瘤组织复杂的代谢环境和肿瘤细胞丰富的自我保护和逃逸机制,单一的Cu+/Ca2+超载还不足以取得理想的临床效果。因此迫切需要防止细胞内超负荷离子流出以辅助Cu+/Ca2+过载,从而对肿瘤细胞造成不可逆的损伤。此外,尽管由于乳酸从肿瘤细胞中流出,肿瘤微环境显示出酸性条件,健康肿瘤细胞的细胞质pH仍然可以保持中性,这主要源自于强大的细胞自我调节机制,因此不利于Cu2+和Ca2+的释放以及Cu+/Ca2+双过载过程中的进一步化学反应。因此,防止细胞内过载离子的流出以及调节肿瘤胞质酸环境成为实现CuS/CaCO3双过载的关键。在本研究中,α-氰基-4-羟基肉桂酸(α-CHA)和五硫吡喃(penthiopyrad)的组合被用于CuS/CaCO3双过载的“代谢共生破坏辅助”策略(图1)。一方面,五硫吡喃作为线粒体三羧酸循环破坏剂,诱导肿瘤中乳酸代谢途径的上调,并促进细胞内乳酸含量的增加。另一方面,α-CHA干扰乳酸外排通道蛋白MCT4的正常生理功能,抑制乳酸外排,并迅速实现肿瘤细胞质的酸化。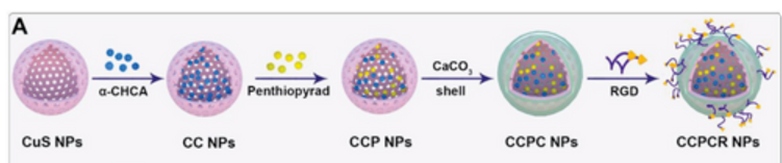
图1 CCPCR NPs
具体而言,在将纳米颗粒被动靶向和主动靶向(RGD靶向肽的修饰)到肿瘤部位后,CCPCR纳米颗粒被内吞到肿瘤细胞中。在少量H+作用下,CaCO3外壳的裂解导致五硫吡喃和α-CHA的释放,从而进一步阻断线粒体TCA循环并激活乳酸代谢途径。乳酸的产生促进和外排阻断加重了细胞内酸中毒,为Cu+的类Fenton反应创造了条件。同时,五硫吡喃和ROS介导的线粒体功能障碍进一步使肿瘤细胞对铜死亡和Ca2+超载敏感。此外,ROS生成、铜死亡信号和Ca2+过载信号通路的上调导致肿瘤部位的免疫激活,最终导致级联和高效的抗肿瘤治疗(图2)。
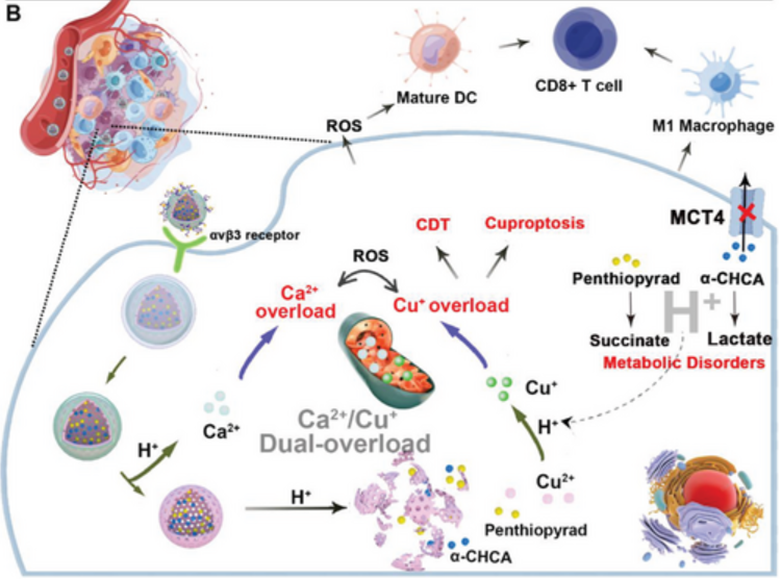
图2 CCPCR NPs的治疗机制
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202403245