近日,Nature 官网发布了北京大学化学与分子工程学院应用化学系刘志博团队题为“Covalent Targeted Radioligands Potentiate Radionuclide Therapy”的研究论文。值得一提的是,这是Nature杂志自1977年以来首次发表核素治疗相关的工作。

该工作基于现代共价药物分子工程发展了一类新型药物形式,即靶向共价放射性药物(Covalent Targeted Radioligand, CTR),并从分子、细胞、小鼠及患者层面验证了该平台技术的有效性,突破了成纤维细胞活化蛋白(FAP,为泛癌种靶点)靶向放射性药物因肿瘤摄取、滞留不足导致疗效不佳的瓶颈。
三大挑战
为了优化靶向放射性核素治疗分子级别的精准放疗效果,以三大问题成为长期挑战:
①让放射性核素精准地找到肿瘤细胞(通过配体-靶点结合),即优异的肿瘤靶向;
②让放射性核素更长久地停留在肿瘤细胞处,以便让治疗放射性核素在有限的衰变时间内对肿瘤细胞进行充分杀伤;
③保证正常器官中的放射性核素尽快地代谢排出,以减小治疗的副作用。
CTR
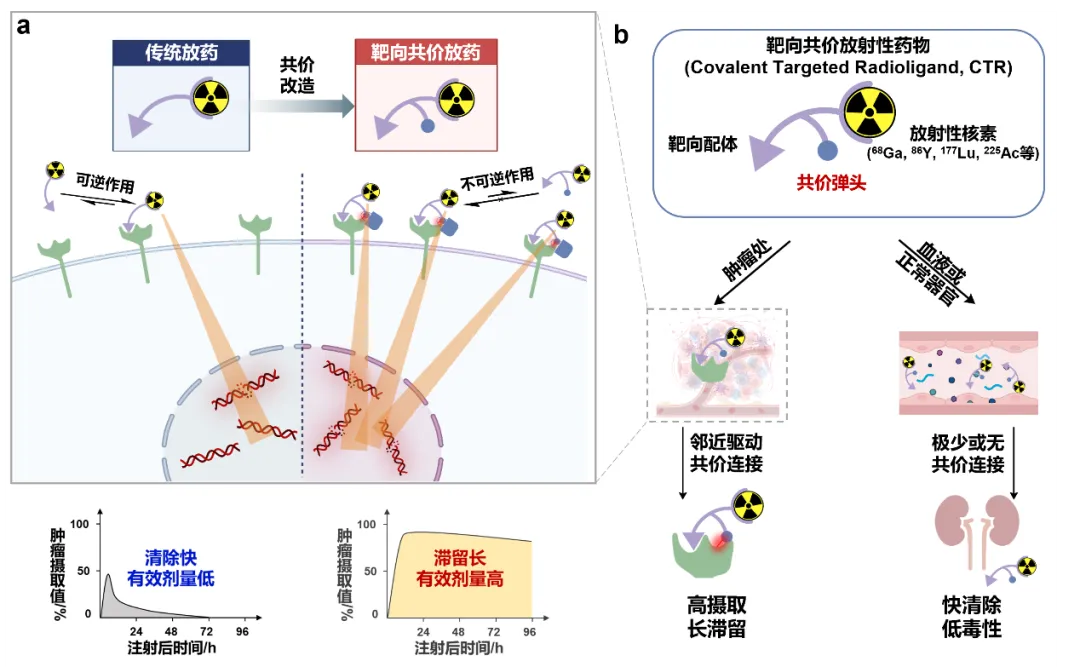
CTR是一个三功能配体,通过在适宜位置和取向上安装基于二代“点击化学”硫(Ⅵ)-氟交换反应(SuFEx)的“潜弹头”(latent warhead),实现配体在不损失亲和力的情况下对靶蛋白的共价连接,从而将携带核素的螯合剂不可逆地修饰到靶蛋白上。当CTR到达肿瘤时,先非共价地结合靶标,后通过邻近效应加速共价连接(不可逆),在可能加强亲和力的同时将肿瘤对药物的清除率降至最低。而其他未结合靶标的自由CTR则被快速排出体内。
该技术增强了放射性配体的肿瘤摄取和保留,并保证其在血液循环或健康组织的低摄取,有望攻克传统核药物安全性与有效性无法兼得的难题。
CTR实现对泛癌种靶点FAP的不可逆地选择性共价连接
关于共价药物的一个普遍担忧是难以预知的脱靶毒性。由于放射配体普遍具有高亲水性且包含多电荷螯合剂,大多数放射配体对细胞膜的被动渗透性有限,因此CTR对胞内蛋白的脱靶作用可能不是问题。研究人员主要考察了CTR-FAPI对FAP同源膜蛋白的选择性,发现其仍能保持104倍的高度FAP选择性。此外,在小鼠血浆和患者尿液中,CTR-FAPI也显示出极低的脱靶反应性。
CTR-FAPI展现更佳的PET成像对比度
研究人员通过对FAP高表达的细胞来源移植小鼠模型(CDX)和患者来源移植小鼠模型(PDX)的验证,发现Ga-68标记的CTR-FAPI(即[68Ga]Ga-FAPI-mFS)显示出比原始FAPI高2倍以上的肿瘤摄取,而健康组织中的摄取迅速清除。在一项初步的肿瘤成像临床研究中,这一策略比其他方法(包括传统FAPI-PET/CT)识别出了更多的甲状腺髓样癌病灶,并通过手术和病理研究确认了这些病灶为真阳性。以上结果说明CTR-FAPI有潜力成为下一代更高灵敏度的FAPI-PET探针。
CTR通过提高滞留增强靶向放射性核素治疗
在通过提高滞留增强靶向放射性核素治疗方面,研究者分别采用β-(Lu-177)和α-放射性治疗核素(Ac-225)标记CTR-FAPI(即FAPI-mFS),在后续治疗中几乎完全抑制了小鼠的FAP高表达皮下肿瘤生长。在另一种靶向前列腺特异性膜抗原(PSMA)的SuFEx工程化放射配体也显示出更强的治疗效果。由于可连接SuFEx弹头的蛋白质较为广泛,这一策略或可用于靶向其他靶点的放射性药物,并为调控其他低分子量偶联类药物的药代动力学提供了新途径。
成果转化
目前,该团队正加快将靶向共价放射性药物发展成为一种平台技术赋能偶联类药物进行功能化改造。据悉,研究者们近期已利用CTR-FAPI在近百名甲状腺髓样癌患者中进行了更为精准的诊断,来指导手术治疗并取得了可观的临床获益。此外,团队正协同北京大学肿瘤医院和中国医学科学院肿瘤医院在肺癌、乳腺癌、前列腺癌、头颈部癌症等大癌种中进行效果验证,优异的临床数据已吸引多家药企寻求合作。