炎症性肠病(IBD)以肠道菌群失调和肠道干细胞(ISCs)功能障碍为特征。然而,IBD微生物因子与ISCs之间的直接相互作用尚未得到描述。
2024年5月23日,中国科学技术大学潘文、朱书及中国科学院分子细胞科学卓越中心宋昕阳共同通讯在Cell Host & Microbe 在线发表题为“Enterococcus-derived tyramine hijacks α2A-adrenergic receptor in intestinal stem cells to exacerbate colitis”的研究论文,该研究发现肠球菌来源的酪胺劫持肠干细胞中的α2A肾上腺素能受体,加重结肠炎。
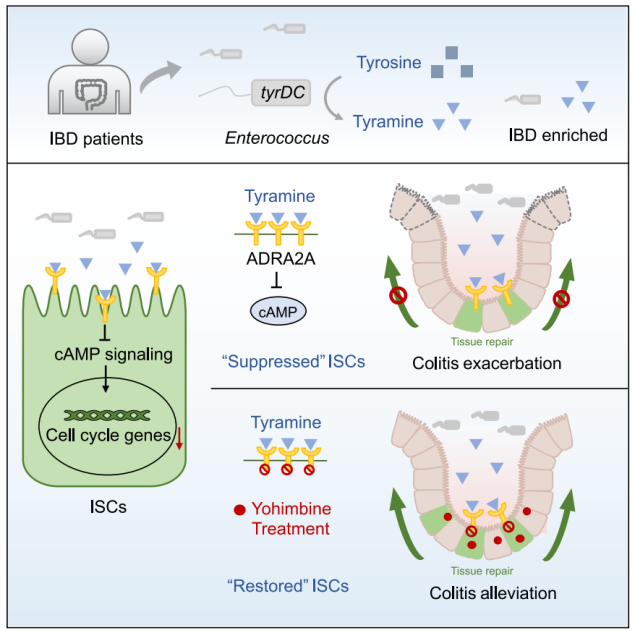
该研究发现α2A-肾上腺素能受体(ADRA2A)是ISCs中高表达的GPCR。通过PRESTO-Tango筛选,证明酪胺主要由肠球菌通过酪氨酸脱羧酶(tyrDC)产生,作为ADRA2A的微生物配体。利用工程化tyrdc缺陷粪肠球菌菌株和肠上皮细胞特异性Adra2a敲除小鼠,发现肠球菌来源的酪胺抑制ISC增殖,从而通过Adra2a损害上皮再生并加剧DSS诱导的结肠炎。重要的是,用ADRA2A拮抗剂育亨宾(yohimbine)阻断该轴,破坏酪胺介导的对ISCs的抑制并减轻结肠炎。

炎症性肠病(IBD)的特征是肠道屏障被破坏,导致微生物和其他抗原易位进入肠壁,从而导致不受控制的免疫激活。IBD需要对肠道进行反复的炎症性损伤,并表现出多层粘膜损伤,这些损伤必须经过一个愈合过程才能恢复正常的屏障功能。Lgr5+肠干细胞(ISCs)的增殖和分化提供了重建上皮屏障和促进损伤后上皮再生所需的细胞池。在疾病状态下,ISC活性紊乱重建上皮屏障导致IBD的发病机制,这在最近的研究中得到了强调。
肠道菌群及其衍生代谢物影响ISC生态位稳态和粘膜完整性的维持。在IBD患者中通常观察到肠道微生物群和代谢物的组成和功能发生重大变化,从而促进疾病状态。有缺陷的微生物群组成和代谢物谱不断接触和挑战屏障表面的ISC生态位。是否可能存在某些IBD相关的微生物代谢物直接调节ISC活性,导致上皮再生改变并促进结肠炎?鉴于微生物代谢物代表了潜在GPCR配体的丰富来源,并且可以在肠道局部发挥作用,研究人员假设ISCs中存在特定的G蛋白偶联受体(GPCR),介导IBD相关代谢物与ISCs之间的直接通信。确定ISCs中未知的配体-受体对将有助于深入了解ISCs的微生物调控,并为促进IBD中ISCs驱动的上皮再生提供潜在的GPCR靶向干预。
机理模式图(图源自Cell Host & Microbe )
该研究确定了富含IBD的肠球菌细菌衍生代谢物(酪胺)直接激活ISC中的α2A-肾上腺素能受体(ADRA2A),抑制ISC增殖(从而抑制上皮再生),并加剧葡聚糖硫酸钠(DSS)诱导的结肠炎。阻断抑制肠球菌-酪胺-ADRA2A轴与ADRA2A拮抗剂育亨宾可促进上皮再生并缓解结肠炎。该研究结果强调了ISCs中的微生物配体-GPCR对,揭示了ISCs的微生物调控与结肠炎恶化之间的因果关系,并提出了一种靶向治疗方法来恢复结肠炎的ISC功能。
原文链接:
https://www.cell.com/cell-host-microbe/abstract/S1931-3128(24)00140-9