复杂区域疼痛综合征(CRPS)是一种继发于创伤或基础疾病后,主要发生于四肢且顽固难治的疼痛综合征,常伴有区域性自主神经功能紊乱、运动功能受损、组织营养不良及微循环变化(水肿、体温调节障碍)等[1-2]。CRPS在人群中的发生率为26.2/10万人年,根据其与交感神经的关系,可分为Ⅰ型(无明确神经损伤)和Ⅱ型(伴明确神经损伤证据),其病理机制尚未明确,临床治疗效果较差[3-4]。
Wnt信号通路在神经发育中对细胞增殖分化起重要作用,不同特异性配体结合 Frizzled(卷曲蛋白)受体和共受体LRPs(低密度脂蛋白受体家族)通过依赖 β-catenin(β连环蛋白)的经典信号通路和非经典信号通路发挥生物学效应,其中关键性Wnt5a配体可通过调控神经损伤修复及炎症反应参与慢性疼痛的发生[5-7]。
基质金属蛋白酶(MMP)不仅可切割水解组织蛋白,还可降解炎症因子、趋化因子以及神经递质受体等[8]。近期研究发现,MMP9在脑损伤、神经退行性疾病、胶质瘤及慢性疼痛进展中发挥重要作用[9-10]。Martin等[11]研究指出,表皮生长因子受体通过激活MMP9及PI3K/AKT/mTOR通路增强伤害性感受。
此外,基于CRPS患者血液组织的蛋白互作网络及富集分析发现差异基因MMP9在炎症反应中扮演重要角色[12]。Rodriguez-Trillo 等[13]研究发现,敲低内源性Wnt5a能够抑制肿瘤坏死因子α(TNF-α)诱导的MMP9水平升高,从而抑制类风湿关节炎中成纤维样滑膜细胞引起的炎症反应。因此,MMP9可能是介导疼痛外周敏化的重要靶点之一。
本研究通过对人永生化角质形成细胞HaCaT进行氧糖剥夺/复氧(OGD/R)处理及建立大鼠患肢缺血再灌注慢性缺血后疼痛(CPIP)模型(模拟CRPS-Ⅰ型),探讨角质形成细胞Wnt5a通过靶向调控MMP9进而参与CRPS外周敏化的机制,旨在为临床治疗CRPS提供指导依据。
1 材料与方法
1.1 实验材料
1.1.1 动物
成年雄性Sprague-Dawley(SD)大鼠购自北京华阜康生物科技股份有限公司。
本研究已通过北京协和医院实验动物福利伦理委员会审批(审批号:XHDW-2022-149)。
1.1.2 材料及主要试剂
HaCaT[由国家生物医学实验细胞资源库(NSTI-BMCR)提供],Box5(Wnt5a抑制剂,P121601,Sel-leck,美国),培养基(MEM) α(112571063, Gibco, 美国), 10%胎牛血清(16000044,Gibco,美国),1%青霉素-链霉素(15140-122,Gibco, 美国),MMP9(ab283575,Abcam,英国),JC-1试剂盒(C2006,碧云天生物公司,中国), 角蛋白keratin(ab8068,Abcam, 英国), 苏木素-伊红染色试剂盒(C0105S,碧云天生物公司,中国), IL-1β酶联免疫吸附测定试剂盒(ZC-36391,茁彩,中国),TNF-α酶联免疫吸附测定试剂盒(ZC-37624,茁彩,中国)。
1.2 分组与干预
1.2.1 体外实验
将生长状态良好的HaCaT细胞取对数生长期接种于6孔板,并随机分为OGD/R组、Box5(20)组、Box5(40)组和对照组。OGD/R损伤模型建立:弃去完全培养基后,PBS润洗3次,添加无糖培养基及厌氧包置于细胞培养箱3 h,之后更换高糖培养基进行复糖复氧。
1.2.2 动物实验
SD大鼠适应性饲养2周后,随机分为CPIP组、Box5(20)组、Box5(40)组和对照组,每组8只。CPIP组、Box5(20)组、Box5(40)组先建立缺血再灌注CPIP模型:采用40 mg/kg(2%)戊巴比妥腹腔注射麻醉,将内径0.56 cm O型环套入大鼠右后肢踝关节处,造成肢端缺血,3 h后剪断O型环,模拟缺血后再灌注过程。参考体外细胞实验给药剂量并稀释药物浓度[14],对照组和CPIP组分别抽取生理盐水100 μL,Box5(20)组和Box5(40)组分别抽取20 μmol/L和40 μmol/L Box5溶液100 μL,于大鼠右后肢足底中间完成皮下注射。
1.3 观察指标及具体方法
OGD/R早期(24 h内)观察角质形成细胞HaCaT线粒体损伤及膜电位变化。通过疼痛行为学测定观察不同处理组2周内不同时间点[第1天(D1),D2,D4,D10,D14]机械痛和热痛阈值变化情况。HE染色观察大鼠皮肤炎症浸润及角化情况,免疫荧光染色观察不同处理组MMP9表达情况,ELISA检测不同处理组背根神经节(DRG)IL-1β及TNF-α水平。
1.3.1 线粒体膜电位测定
向生长状态良好的HaCaT细胞中加入JC-1染色工作液,于细胞培养箱中37 ℃孵育20 min,之后离心3~4 min(600×g, 4 ℃),用JC-1染色缓冲液洗涤沉淀细胞2次,再用适量JC-1染色缓冲液重悬后,用荧光显微镜观察。正常状态下JC-1聚集在线粒体基质中,形成聚合物J-aggregates(红色荧光);当线粒体受损而膜电位下降时,JC-1无法聚集在线粒体基质中而呈现单体状态Monomer(绿色荧光)。使用ImageJ软件计算绿色/红色荧光强度相对比例以分析线粒体膜电位变化情况。
1.3.2 机械痛阈值测定
将大鼠单独放置于可自由活动的透明有机玻璃笼内,底部为金属网底,适应30 min后,用von Frey Filaments垂直刺激大鼠右后足底中部,缓慢用力至出现突然缩足、舔足或扬足反应为阳性。每足至少测量3次,每次至少间隔30 s,取平均值作为机械缩足反射阈值[15]。
1.3.3 热痛阈值测定
将大鼠单独放置于可自由活动的玻璃透明笼中,适应30 min后,用热辐射疼痛刺激仪照射大鼠右后足底, 大鼠产生快速缩足、舔足或扬足反应为阳性,记录照射持续时间。每足至少测量3次,间隔10 min以上,取平均值作为热刺激缩足反射的潜伏期[15]。
1.3.4 免疫荧光染色
取出制作好的皮肤冰冻切片,室温干燥30 min, 用含0.1% Triton X-100的PBS漂洗3次,每次5 min,用含 0.5% Triton X-100的PBS室温孵育30 min, 5%山羊血清抗体封闭液室温封闭1 h, 4 ℃孵育一抗过夜(MMP9 1:100, keratin 1:100)。皮肤切片室温平衡30 min, PBS漂洗3次, 室温下避光孵育二抗90 min[山羊抗鼠 IgG(Alexa Fluor® 488)(1:500)和山羊抗兔 IgG(Alexa Fluor® 594)(1:500)], PBS漂洗3次, 含DAPI的封片剂封片,荧光显微镜下观察拍照。
1.3.5 HE染色
在D14时间点麻醉大鼠并将其处死,快速取患足皮肤。经不同浓度的乙醇溶液进行逐级脱水, 二甲苯澄清, 进行浸蜡、包埋切片制作,HE染色后凝胶密封, 置于显微镜下观察。
1.3.6 ELISA检测
用预冷的PBS冲洗DRG组织,加入相应蛋白酶抑制剂充分混合后,在冰上研磨。将匀浆液5000×g离心5~10 min,取上清检测。标准品孔各加不同浓度的标准品50 μL。样本孔中加入待测组织50 μL。每孔加入辣根过氧化物酶标记的检测抗体100 μL,并用封板膜封孔。37 ℃恒温箱温育60 min后每孔加满洗涤液350 μL并静置1 min,重复洗板5次。每孔加入相应底物并避光孵育15 min。加入终止液50 μL后在450 nm波长处测定各孔的OD值并计算相应组织浓度。
1.4 统计学处理
采用 SPSS 软件(Chicago,IL,USA)进行统计学分析,并用Graphpad prism 9软件作图。痛阈值等符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较选用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 HaCaT细胞OGD/R后MMP9表达变化
对生长状态良好的HaCaT细胞进行缺氧及无糖培养基处理3 h,与对照组相比,OGD/R组MMP9荧光强度显著增加(P<0.001);与OGD/R组相比,Box5(20)组(P=0.002)及Box5(40)组(P<0.001)MMP9相对荧光强度均显著下降,不同浓度Wnt5a抑制剂组间比较差异无统计学意义(P=0.320),见图1。

图1 HaCaT细胞OGD/R后不同处理组角质形成细胞MMP9表达变化(标尺=20 μm, ×20)
2.2 Box5对HaCaT细胞OGD/R后线粒体影响
透射电镜下观察HaCaT细胞OGD/R后早期出现线粒体明显萎缩,线粒体嵴发生形态结构紊乱。JC-1荧光探针检测显示,与对照组相比,OGD/R组绿/红荧光比例显著增加(P=0.027),提示线粒体膜电位下降;与OGD/R组相比,Box5(40)组线粒体膜电位有所上升,差异具有统计学意义(P=0.046),见图2。

图2 Wnt5a抑制剂Box5对HaCaT细胞线粒体影响
A.透射电镜下OGD/R组线粒体萎缩情况(标尺=500 nm);B.JC-1染色检测各组线粒体膜电位变化(标尺=20 μm, ×20)
2.3 大鼠CPIP后行为学改变
与对照组相比,CPIP组大鼠术后各时间点(D1,D2,D4,D10,D14)机械痛阈值和热痛阈值均显著降低(P均<0.05);与CPIP组相比,Box5(40)组在D4和D14时间点机械痛阈值改善具有统计学差异(P<0.05), 在D4,D10和D14时间点热痛阈值明显上升(P<0.05)。Box5(20)组与Box5(40)组在D4和D14时间点机械痛阈值差异具有统计学意义,而热痛阈值在各个时间点均无明显差异,见图3。
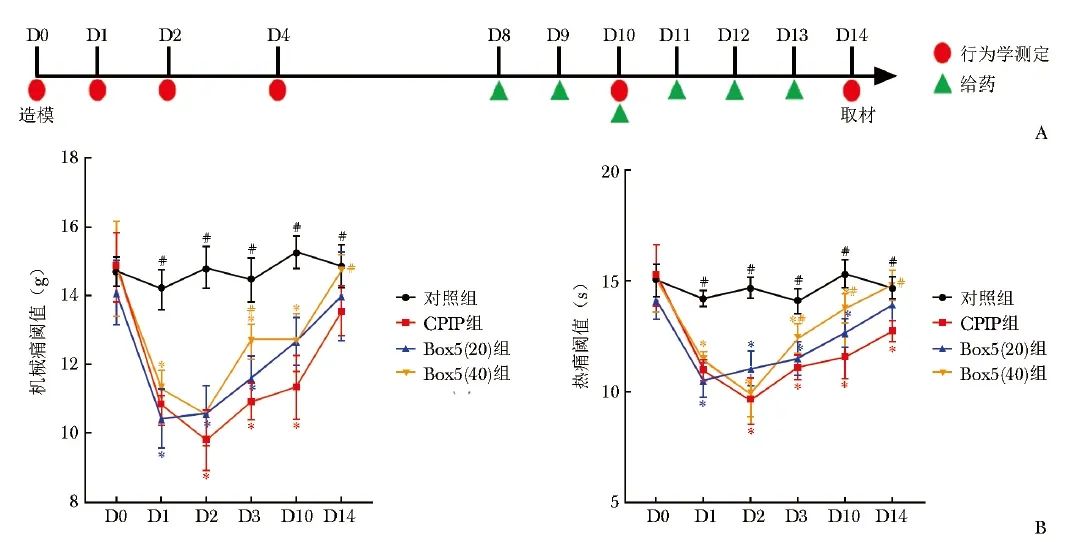
图3 大鼠建模给药流程图(A)及造模后疼痛行为学改变(B)
2.4 CPIP后患足表皮HE染色及免疫荧光染色
D14时间点麻醉后,处死大鼠并取材患足皮肤进行HE染色。与对照组相比,CPIP组大鼠患足真皮层出现大量炎症细胞浸润,表皮出现过度角化,颗粒层及棘层厚度显著增加(P<0.001);与CPIP组相比,Box5(40)组颗粒层及棘层厚度降低明显(P<0.001),见图4A。
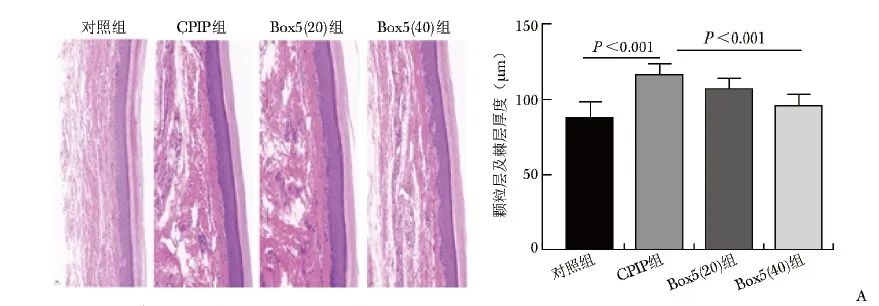
图4A CPIP后患足表皮HE染色及免疫荧光染色结果(×20) A.大鼠患足表皮HE染色
D14时间点麻醉后处死大鼠并取材患足皮肤进行免疫荧光试验。与对照组相比,CPIP组角质形成细胞MMP9荧光强度显著增加(P<0.001);与CPIP组相比,Box5(20)组(P=0.002)和Box5(40)组(P<0.001)MMP9荧光强度均显著下降, 不同浓度组间比较无统计学差异(P=0.480),见图4B。
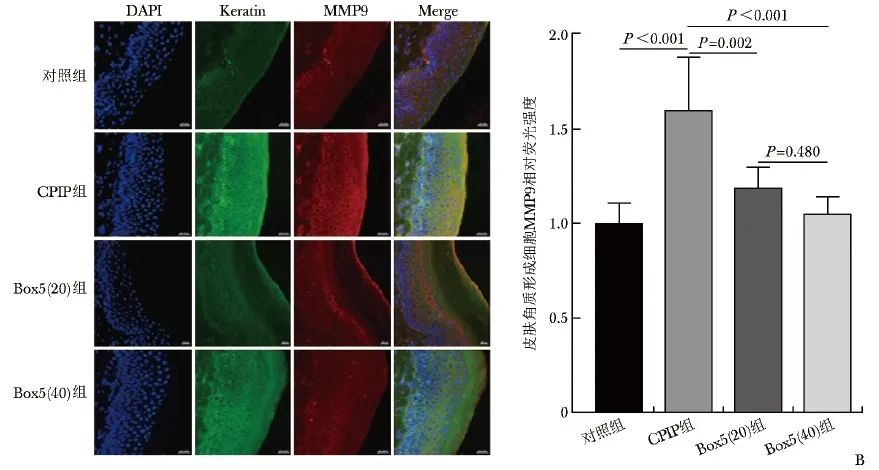
图4B CPIP后患足表皮HE染色及免疫荧光染色结果(×20) B.大鼠患足表皮免疫荧光染色(标尺=20 μm)
2.5 大鼠CPIP后DRG组织炎症因子改变
D14时间点麻醉后处死大鼠取DRG组织,ELISA法检测炎症因子IL-1β及TNF-α浓度。与对照组相比,CPIP组IL-1β(P=0.048)和TNF-α浓度( P=0.002)显著升高; 与CPIP组相比,Box5(40)组IL-1β(P=0.047)和TNF-α浓度( P=0.047)显著下降,见图5。
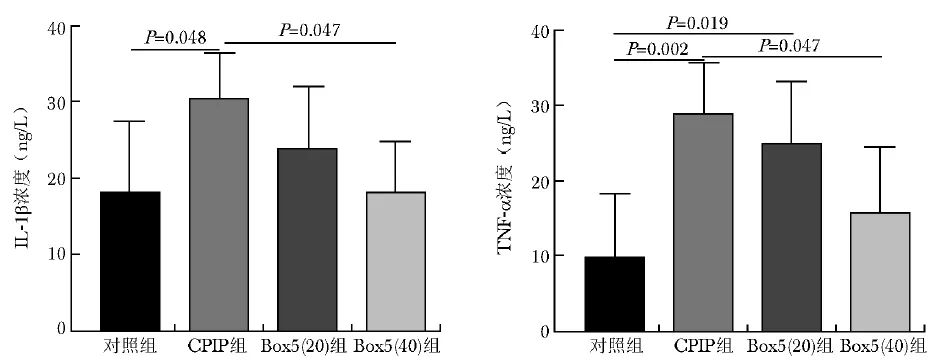
图5 大鼠CPIP后DRG组织IL-1β、TNF-α水平改变
CPIP:同图3
3 讨论
CRPS是重要的慢性疼痛综合征之一,其病理生理机制较为复杂,近年来是疼痛领域的研究热点。目前大量研究证实Wnt信号通路中关键性配体Wnt5a在慢性疼痛机制中发挥重要作用[16-17],但其是否与CRPS的发生相关尚无研究报道。
Ji等[18]研究指出MMP常作为炎性反应的下游产物而在慢性疼痛进展过程中显著升高,其中以MMP9和MMP2升高尤为明显。同样,Pan等[19]研究发现,靶向抑制MMP9的活性可有效抑制坐骨神经损伤引起的神经病理性疼痛。本研究以此为切入点,通过体外、动物双重实验,探究角质形成细胞Wnt5a通过调控MMP9参与CRPS的外周敏化机制。
3.1 Wnt5a参与调控线粒体膜电位
Shan等[20]研究表明,体外培养的星形胶质细胞进行OGD/R处理后MMP9表达显著上升,体内胰高血糖素样肽-1受体激动剂Ex-4能够降低MMP9的表达,进而保护血脑屏障。同样,本研究发现HaCaT细胞OGD/R后MMP9表达明显上升,Wnt5a特异性抑制剂Box5能够显著降低MMP9的荧光强度,然而不同浓度(20 μmol/L和40 μmol/L)间未发现统计学差异,尚需进一步探究。
OGD/R处理早期会产生活性氧(ROS),ROS的过度积累能够导致线粒体膜通透性增加,进而引起线粒体跨膜电位降低,表现为线粒体萎缩及细胞色素C释放,诱导细胞凋亡的发生并激活凋亡蛋白酶caspase,进一步导致炎症和疾病的产生[21-22]。本研究通过透射电镜发现在HaCaT细胞OGD/R早期(24 h内)线粒体出现明显萎缩,线粒体嵴发生形态结构损伤,采用JC-1荧光探针检测线粒体膜电位发现OGD/R组电压显著下降,给予40 μmol/L Box5能够抑制膜电位电压的下降,可能与阻断ROS的过度积累有关。
3.2 Wnt5a抑制剂逆转痛觉敏化
CRPS临床主要表现为自主神经症状(出汗、血管舒缩功能异常)、运动障碍和营养性改变(皮肤、骨骼萎缩、毛发减少、关节挛缩)等[23-24]。慢性缺血后疼痛模型CPIP是目前国际上公认的CRPS动物模型,通过延长缺血时间(3 h),能够完全模拟CRPS-Ⅰ型患者病理生理过程[25-26]。Lu等[7]研究发现,降低小鼠体内Wnt5a水平能够显著抑制SNI小鼠的神经性疼痛和神经炎症,缓解患足的机械超敏反应。
本研究发现,CPIP建模后各时间点(D1, D2, D4, D10, D14)机械痛阈值和热痛阈值均明显下降,通过局部注射Wnt5a抑制剂能有效缓解大鼠的慢性疼痛。HE染色显示,CPIP组大鼠患足真皮层出现大量炎症细胞浸润,建模早期大鼠患足出现明显肿胀,后期表皮出现过度角化,颗粒层及棘层厚度显著增加, 而Box5(40)组角化程度较低。
3.3 Wnt5a调控MMP9参与CRPS外周敏化
目前,MMP9被认为是参与神经炎症的关键因子,在多种动物模型中证实其可以通过对细胞因子等的剪切活化,触发下游信号通路的激活导致神经病理性疼痛的产生[27-29]。
本研究发现,大鼠患足缺血再灌注损伤后角质形成细胞上MMP9表达显著上调,Wnt5a抑制剂能够降低MMP9的表达同时逆转痛觉超敏反应,但未发现降低程度存在剂量依赖性。
MacLauchlan等[30]研究发现,类风湿关节炎小鼠靶向敲除Wnt5a后,MMP2和MMP9的表达显著降低,炎症细胞浸润程度改善,软骨破坏活动受到抑制。
同样,Jang等[31]指出,由脂多糖诱发人支气管上皮细胞BEAS-2B和人脐静脉内皮细胞HUVEC导致的炎症反应可被Wnt拮抗剂DKK-1和LGK974所抑制,炎症因子TNF- α、IL-1β及MMP9随之下降,降低程度与Wnt抑制剂呈剂量依赖性。因此,靶向抑制Wnt5a/MMP9信号通路的激活将有效抑制炎症的持续进展,一定程度缓解CRPS患者的慢性疼痛。
本研究主要关注外周敏化在CRPS病理生理过程中发挥的重要作用,其中Wnt5a/MMP9信号通路的激活及炎症反应发挥重要作用。此外,本研究ELISA结果提示CPIP组大鼠DRG水平IL-1β及TNF-α浓度显著升高,局部外周注射高浓度Wnt5a抑制剂能够有效抑制炎症的持续进展。然而,MMP9通过何种路径被Wnt5a激活,其上行至中枢的具体机制尚需实验进一步探究。
综上,通过体内体外双重实验,本研究初步证实外周局部缺血导致皮肤角质细胞MMP9的过表达,引发持续性外周敏化,导致CRPS-Ⅰ型的发生。局部应用Wnt5a抑制剂可逆转MMP9的过度表达及大鼠疼痛行为,靶向抑制外周Wnt5a/MMP9可为临床治疗该慢性痛提供参考依据。
参考文献
[1]Shim H, Rose J, Halle S, et al. Complex regional pain syndrome: a narrative review for the practising clinician[J]. Br J Anaesth, 2019, 123(2): e424-e433.
[2]Louis M H, Meyer C, Legrain V, et al. Biological and psychological early prognostic factors in complex regional pain syndrome: a systematic review[J]. Eur J Pain, 2023, 27(3): 338-352.
[3]Smart K M, Ferraro M C, Wand B M, et al. Physiotherapy for pain and disability in adults with complex regional pain syndrome (CRPS) types Ⅰ and Ⅱ[J]. Cochrane Database Syst Rev, 2022, 5(5): CD010853.
[4]Sobeeh M G, Hassan K A, Silva A G, et al. Impact of different CRPS phenotypes and diagnostic criteria on quantita-tive sensory testing outcomes: systematic review and meta-analysis[J/OL]. Pain Med: pnad144. https://doi.org/10.1093/pm/pnad144.
[5]Xie Y K, Luo H, Zhang S X, et al. GPR177 in A-fiber sensory neurons drives diabetic neuropathic pain via WNT-mediated TRPV1 activation[J]. Sci Transl Med, 2022, 14(639): eabh2557.
[6]Liu X, Bae C, Liu B L, et al. Development of opioid-induced hyperalgesia depends on reactive astrocytes controlled by Wnt5a signaling[J]. Mol Psychiatry, 2023, 28(2): 767-779.
[7]Lu Y T, Zhang J T, Zeng F N, et al. Human PMSCs-derived small extracellular vesicles alleviate neuropathic pain through miR-26a-5p/Wnt5a in SNI mice model[J]. J Neuroinflammation, 2022, 19(1): 221.
[8]Li J, Ruan S R, Jia J H, et al. Hydrogen attenuates postoperative pain through Trx1/ASK1/MMP9 signaling pathway[J]. J Neuroinflammation, 2023, 20(1): 22.
[9]Deng W D, Ding Z B, Wang Y Y, et al. Dendrobine attenuates osteoclast differentiation through modulating ROS/NFATc1/MMP9 pathway and prevents inflammatory bone destruction[J]. Phytomedicine, 2022, 96: 153838.
[10]Genovese T, Cordaro M, Siracusa R, et al. Molecular and biochemical mechanism of cannabidiol in the management of the inflammatory and oxidative processes associated with endometriosis[J]. Int J Mol Sci, 2022, 23(10): 5427.
[11]Martin L J, Smith S B, Khoutorsky A, et al. Epiregulin and EGFR interactions are involved in pain processing[J]. J Clin Invest, 2017, 127(9): 3353-3366.
[12]Zhu H, Wen B, Xu L, et al. Identification of potential Inflammation-Related genes and key pathways associated with complex regional pain syndrome[J]. Biomolecules, 2023, 13(5): 772.
[13]Rodriguez-Trillo A, Mosquera N, Pena C, et al. Non-canonical WNT5A signaling through RYK contributes to aggressive phenotype of the rheumatoid fibroblast-like synoviocytes[J]. Front Immunol, 2020, 11: 555245.
[14]Jenei V, Sherwood V, Howlin J, et al. A t-butyloxy-carbonyl-modified Wnt5a-derived hexapeptide functions as a potent antagonist of Wnt5a-dependent melanoma cell invasion[J]. Proc Natl Acad Sci U S A, 2009, 106(46): 19473-19478.
[15]Modi A D, Parekh A, Pancholi Y N. Evaluating pain behaviours: widely used mechanical and thermal methods in rodents[J]. Behav Brain Res, 2023, 446: 114417.
[16]Zhu A, Shen L, Xu L, et al. Wnt5a mediates chronic post-thoracotomy pain by regulating non-canonical pathways, nerve regeneration, and inflammation in rats[J]. Cell Signal, 2018, 44: 51-61.
[17]Simonetti M, Kuner R. Spinal Wnt5a plays a key role in spinal dendritic spine remodeling in neuropathic and inflammatory pain models and in the proalgesic effects of peripheral Wnt3a[J]. J Neurosci, 2020, 40(35): 6664-6677.
[18]Ji R R, Xu Z Z, Wang X Y, et al. Matrix metalloprotease regulation of neuropathic pain[J]. Trends Pharmacol Sci, 2009, 30(7): 336-340.
[19]Pan C L, Wang C Y, Zhang L, et al. Procyanidins attenuate neuropathic pain by suppressing matrix metalloproteinase-9/2[J]. J Neuroinflammation, 2018, 15(1): 187.
[20]Shan Y L, Tan S, Lin Y Y, et al. The glucagon-like peptide-1 receptor agonist reduces inflammation and blood-brain barrier breakdown in an astrocyte-dependent manner in experimental stroke[J]. J Neuroinflammation, 2019, 16(1): 242.
[21]Harrington J S, Ryter S W, Plataki M, et al. Mitochondria in health, disease, and aging[J]. Physiol Rev, 2023, 103(4): 2349-2422.
[22]Zeng X, Zhang Y D, Ma R Y, et al. Activated Drp1 regulates p62-mediated autophagic flux and aggravates inflammation in cerebral ischemia-reperfusion via the ROS-RIP1/RIP3-exosome axis[J]. Mil Med Res, 2022, 9(1): 25.
[23]Smart K M, Wand B M, O'Connell N E. Physiotherapy for pain and disability in adults with complex regional pain syndrome (CRPS) types I and II[J]. Cochrane Database Syst Rev, 2016, 2(2): CD010853.
[24]Lloyd E C O, Dempsey B, Romero L. Complex regional pain syndrome[J]. Am Fam Physician, 2021, 104(1): 49-55.
[25]Wang J, Yin C Y, Pan Y S, et al. CXCL13 contributes to chronic pain of a mouse model of CRPS-Ⅰ via CXCR5-mediated NF-κB activation and pro-inflammatory cytokine production in spinal cord dorsal horn[J]. J Neuroinflamma-tion, 2023, 20(1): 109.
[26]Palandi J, Mack J M, De Araújo I L, et al. Animal models of complex regional pain syndrome: a scoping review[J]. Neurosci Biobehav Rev, 2023, 152: 105324.
[27]Huntley G W. Synaptic circuit remodelling by matrix metalloproteinases in health and disease[J]. Nat Rev Neurosci, 2012, 13(11): 743-757.
[28]Page-McCaw A, Ewald A J, Werb Z. Matrix metalloproteinases and the regulation of tissue remodelling[J]. Nat Rev Mol Cell Biol, 2007, 8(3): 221-233.
[29]Wells J M, Gaggar A, Blalock J E. MMP generated matrikines[J]. Matrix Biol, 2015, 44/46: 122-129.
[30]MacLauchlan S, Zuriaga M A, Fuster J J, et al. Genetic deficiency of Wnt5a diminishes disease severity in a murine model of rheumatoid arthritis[J]. Arthritis Res Ther, 2017, 19(1): 166.
[31]Jang J, Jung Y, Kim Y, et al. LPS-induced inflammatory response is suppressed by Wnt inhibitors, Dickkopf-1 and LGK974[J]. Sci Rep, 2017, 7(1): 41612.