胆固醇结石(CGS)乃胆道系统常见之疾病,其患病率高达20%,且有超过20%的患者病情将逐渐演化为无症状或复杂阶段。CGS之风险因素涵盖多种因素,诸如女性、年长、妊娠、肥胖、糖尿病、及高脂肪饮食习惯等。众多风险因素均与代谢紊乱密切相关。此外,不良之肠道微生物群亦被认为与CGS之发生发展有着紧密联系,可影响胆汁酸的组成及胆固醇向胆道系统的分泌。
据了解,通过调节肠道菌群如乳酸菌等以影响FXR信号介导的胆汁酸代谢,可有效缓解CGS之症状。有研究表明,在胆囊与肝脏存在基因突变的CGS患者中,肠道微生物群与代谢平衡出现显著失调。因此,肠道、代谢与基因三者间的相互作用,可能在CGS之形成与发展过程中扮演重要角色。
柴胡疏肝散在临床医学中已被广泛用于治疗多种代谢性胃肠病和肝胆疾病,包括但不限于慢性胃炎、肠易激综合征、肝损伤、肝脏炎症、肝脏脂肪变性以及非酒精性脂肪肝(NAFLD)等。科学家们推测,柴胡疏肝散之所以具有显著的治疗效果,主要归因于其调节肠道微生物群失调和改善代谢紊乱的能力。基于上述研究背景,有研究进一步推测柴胡疏肝散可能通过影响肠道微生物群的组成,调节代谢过程,从而有效预防CGS的形成。换言之,柴胡疏肝散可能通过改善微生物区系失调和代谢紊乱等途径,阻止CGS的发生。
日前,一篇名为“Chaihu Shugan prevents cholesterol gallstone formation by ameliorating the microbiota dysbiosis and metabolic disturbance in mice”的研究使用CGS小鼠模型检测柴胡疏肝散的体内预防效果。

图1 论文首页
柴胡疏肝散可预防致高脂肪及胆固醇饮食诱导的CGS形成
图2A呈现了CGS模型的状况,结果显示CGS组的小鼠中,多数患有III-V级的结石。研究发现柴胡疏肝散对小鼠结石具有剂量依赖性的改善效果,这提示柴胡疏肝散具有预防饮食诱导结石形成的潜力(图2B)。
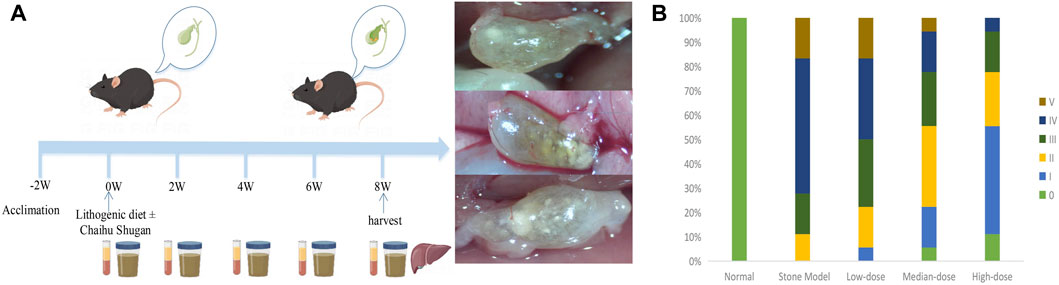
图2 不同剂量的CGS模型及预防效果
柴胡疏肝散对CGS小鼠不同时间肠道微生物群的动态变化及体内平衡的恢复
研究在CGS小鼠模型中,观察到肠道微生物群,拟杆菌门、厚壁菌门、变形菌门和疣微菌门的丰度在CGS形成的不同阶段均有所波动(图3A、B)。此外,α-多样性(以Shannon和Simpson指数衡量)在第八周与第二周之间存在显著差异,但在其他时间点则无显著差异(图3C、D)。为进一步探究不同时间点之间的差异,研究采用了基于加权UniFrac距离的NMDS模型和基于Bray距离的相似性分析(ANOSIM)。结果显示,第2周、第4周、第6周和第8周之间在肠道微生物群结构上存在显著差异(图3E)。
第8周,研究者观察到螺杆菌、短螺菌属和假单胞菌的丰度显著增加,而乳杆菌和阿克曼菌的丰度则有所减少(图3F)。LDA分析进一步证实,螺杆菌和假单胞菌科在第八周时显著富集(图3G)。该研究在CGS小鼠模型中揭示了肠道微生物群在CGS形成过程中的动态变化,并识别了关键微生物类群的丰度变化。这有助于深入理解CGS的发病机制,并为未来的治疗策略提供重要线索。
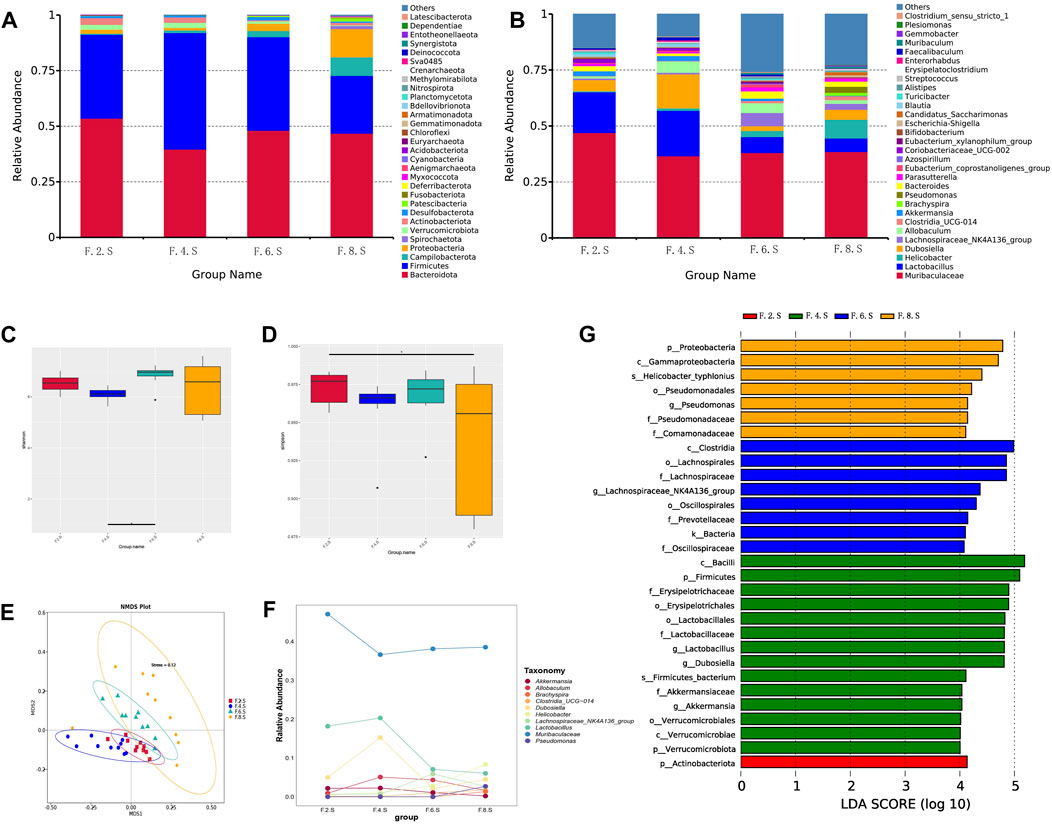
图3 16s RNA测序显示CGS模型中的动态失衡
柴胡舒肝散通过宏基因组功能分析改善脂质/氨基酸代谢并防止CGS形成
研究采用KEGG数据库,根据各分类级别的功能丰度进行了NMDS降维分析,并绘制了图4A。分析结果显示,在第3级上,五组之间的功能丰度存在明显差异,特别是CGS组和对照组之间,以及CGS组和柴胡舒肝散给药组之间的差异显著。基于单基因注释结果,研究发现主要基因主要集中在代谢途径上,尤其是碳水化合物、能量和脂质代谢(图4B)。
为了进一步探究各组之间的差异功能途径,研究者使用了LEfSe(LDA>2)方法,并生成了聚类热图。结果显示,ko00121和ko00120(即次级和初级胆汁酸生物合成)在CGS组中显著富集。而柴胡舒肝散给药组则主要富集在脂质能量和氨基酸代谢,如苯丙氨酸和鞘脂代谢等方面(图4C、D)。
此外,研究还对参与介导鞘脂的酶水平进行了深入分析。通过MetaStat分析(p<0.05),研究者观察到在β-半乳糖苷酶代谢、参与氨基酸代谢合成的氨基转移酶,以及介导胆汁酸释放的胆盐水解酶(BSH)等方面存在显著差异。例如,柴胡舒肝散处理后,BSH水平显著降低,这可能与不同的微生物群,如s_Faecalibaculum rodentium、s_Eubacterium _sp_14_2、s_Lachnospiraceae_bacterium _3_1和s_Lachspiraceae bacterium 28-4等有关。
综上所述,该研究全面揭示了CGS模型中胆汁酸代谢的失调现象。同时,柴胡舒肝散通过改善脂质、能量和氨基酸代谢等途径,有效防止了CGS的形成(图4E、F)。

图4 宏基因组功能分析挖掘柴胡舒肝散CGS逆转功能障碍模型
柴胡舒肝散通过改善肠道微生物群逆转CGS形成过程中的血清动态代谢变化
研究利用LC-MS/MS技术对血清代谢物的动态变化进行了深入研究。通过主成分分析,观察到在不同时间点,代谢物的变化具有显著性,特别是在第八周时变化尤为明显(图5A)。在CGS形成的过程中,研究者运用方差分析(ANOVA)方法,成功识别出400种差异代谢物(图5B、D)。此外,通过K-means聚类分析,揭示了代谢的动态变化,这些变化可划分为9个聚类。尤其是,在第1组中,有39种代谢产物(主要为氨基酸和脂肪酸)在第八周时出现了显著减少。而在簇7和簇9中,分别有109和34种代谢产物在第八周出现了大幅增加,这些代谢物主要包括脂肪酸、甘油磷脂、氨基酸和脂肪酰基(图5C)。因此,研究结果表明,CGS的形成与脂质和氨基酸代谢的紊乱存在密切关联。
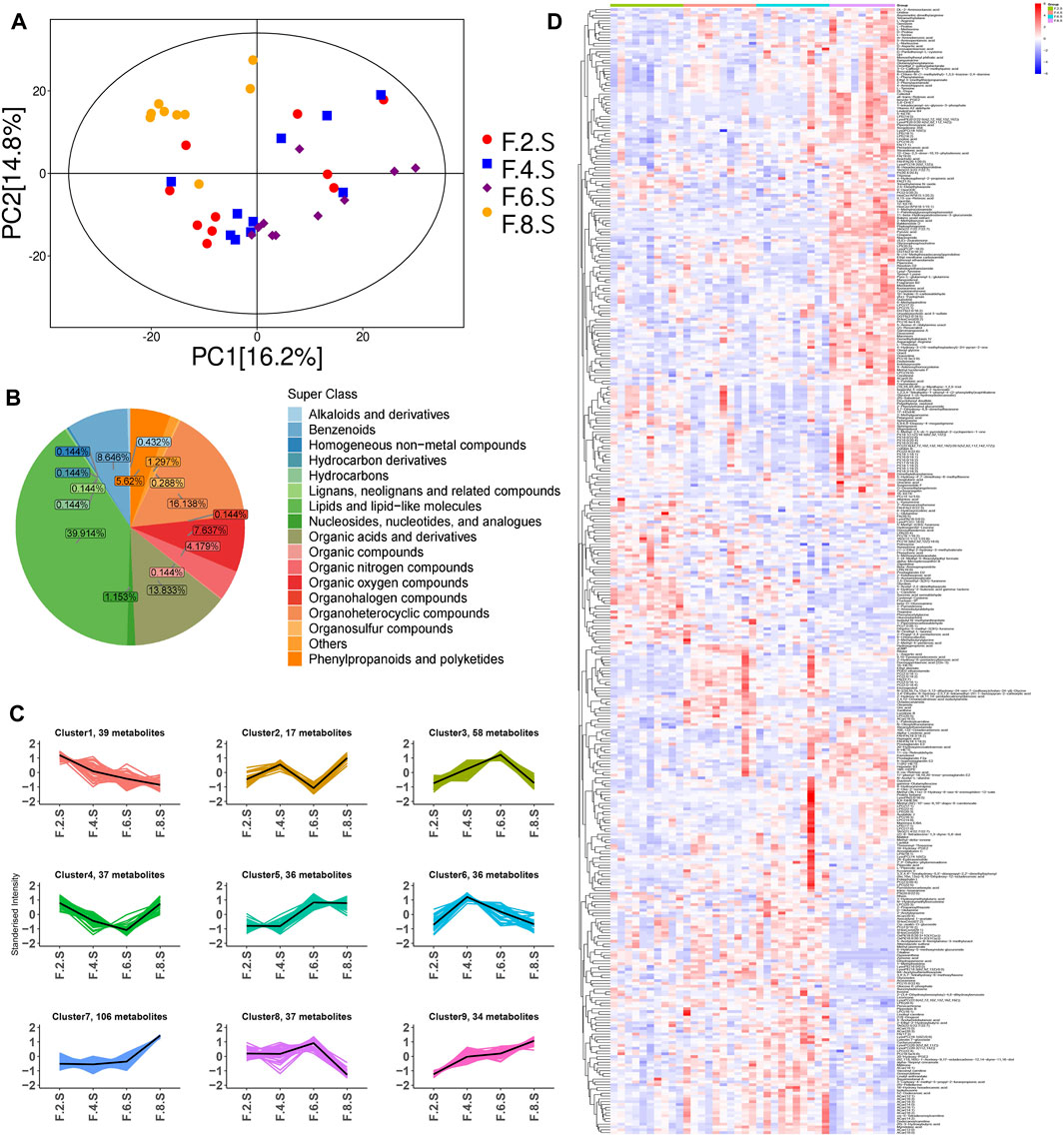
图5 代谢组学揭示了CGS模型中的代谢动力学
整合多维数据构建“中药活性代谢-肠道代谢-基因-表型”网络
经微生物组、代谢组和肝脏转录组数据的深入分析,研究发现CGS形成过程中肠道微生物群和代谢途径存在显著紊乱,表现为有益菌丰度下降以及脂质和氨基酸代谢受损。为进一步探索柴胡舒肝散的活性代谢产物,研究者对其在血液和肝脏组织中的代谢产物进行了细致研究,最终确定黄柏酮为潜在的关键次级代谢产物。结合网络药理学和多组学研究的综合结果,研究者提出假设:柴胡舒肝散通过调控脂质(特别是胆汁酸)和氨基酸代谢,旨在恢复CGS患者肠道微生物群的稳态,从而抑制CGS的发展(图6)。
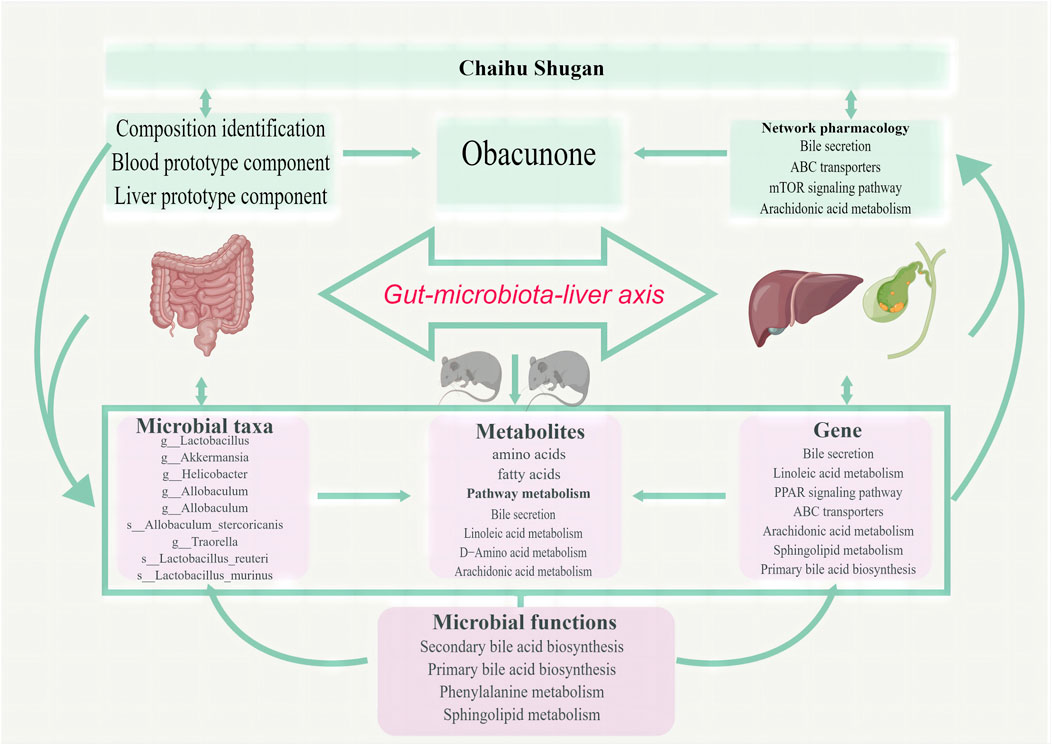
图6 柴胡舒肝散通过改善微生物群失调和代谢紊乱来防止CGS的形成
结论
综上所述,柴胡舒肝散具有预防CGS的潜力,主要通过改善微生物群失调及代谢紊乱实现。
参考文献:
Wang W, Zhang K, Liu B, Zhou T, Tang Y, Li Y. Chaihu Shugan prevents cholesterol gallstone formation by ameliorating the microbiota dysbiosis and metabolic disturbance in mice. Front Pharmacol. 2024 Jan 31;14:1291236. doi: 10.3389/fphar.2023.1291236