DNA甲基化一直以来都是顶级期刊、基金资助、临床研究、药物研发等多方面热点聚焦所在。近几年,无论是国自然中标数目还是文献发表量都居高不下,2023年发文有6382篇,且23年国自然中标率高达157。
DNA甲基化是一种重要的表观遗传修饰,能在不改变DNA序列的前提下改变DNA片段活性,从而影响基因表达。这种修饰,在多种生物学过程中起着至关重要的作用。
研究者利用各种技术方法探讨DNA甲基化的形成机制,功能和作用机制及其在疾病、癌症、遗传进化、胚胎发育、动物群体的社会性行为、植物基因表达调控和遗传育种等多方面的应用。
同时,DNA甲基化也是国自然申请的热点技术——研究者通过实验流程和生信分析深入理解DNA甲基化的形成机制和功能,并与其他技术进行关联分析,探讨其在疾病和癌症领域研究、动物发育、植物研究领域的应用及研究思路。随着研究深入,DNA甲基化有望在疾病治疗诊断、农业生产等领域发挥重要作用。
近日,来自浙江大学、同济大学、牛津大学和爱丁堡大学的研究员团队在Nature出版集团旗下刊物《自然·通讯》发表了题为“Altered DNA methylation within DNMT3A, AHRR, LTA/TNF loci mediates the effect of smoking on inflammatory bowel disease”的研究论文,采用前瞻性队列研究和孟德尔随机化分析,以评估吸烟行为、吸烟相关DNA甲基化与克罗恩病和溃疡性结肠炎风险之间的关联。此外,还通过全基因组甲基化分析和共定位分析,确定了吸烟对炎症性肠病发病的生物学机制和途径。

一、研究背景
炎症性肠病(IBD)是一种慢性肠道炎性疾病,包括溃疡性结肠炎(UC)和克罗恩病(CD)。近年来,IBD的发病率和患病率在全球持续上升。在环境诱因中,吸烟与IBD的发生发展最具关联性,并且吸烟状况(即当前吸烟和既往吸烟)对UC和CD的差异影响是不同的。几十年来科学家通过不同的方法进行了研究,但目前对其深入机制的理解仍然有限。
随着全基因组关联分析(GWAS)和表观基因组关联研究(EWAS)的发展,利用孟德尔随机化(MR)分析发现,吸烟在全表观基因组水平上DNA甲基化的状态变化与IBD的潜在发病机制有关。
二、研究思路方法与结论
研究思路1:探究吸烟与炎症性肠病之间的关联
研究方法:
(1)分层分析完全调整模型中,不同年龄段不同吸烟状况(如既往吸烟和当前吸烟等)与UC和CD的风险比(HR)和95%置信区间(CI)。
(2)通过MR分析和敏感性分析吸烟行为的遗传易感性与CD和UC风险之间存在的关联性,并利用MR-PRESSO方法(检验水平基因多效性)确定吸烟行为和CD风险之间存在的七个异常值。
研究结论:发现吸烟行为的遗传易感性与CD和UC风险之间无任何显著关联。
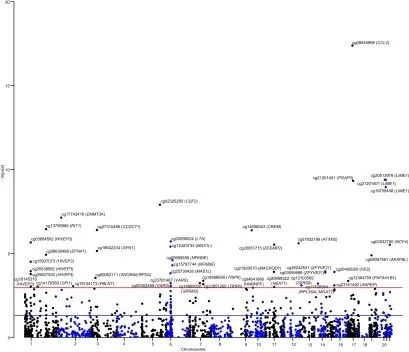
研究思路2:探究吸烟相关基因甲基化调控与炎症性肠病风险的关联
研究方法:通过MR分析吸烟行为相关的2,623个CpG位点与CD和UC相关的多个cis-mQTLs(DNAm数量性状位点)关联性,并通过MR-Egger方法验证其关联性基因。
研究结论:46个吸烟相关的CpG位点甲基化的改变与CD风险显著相关,69个吸烟相关的CpG位点甲基化与UC风险相关。
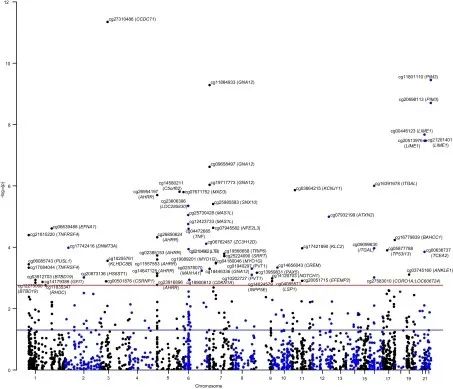
研究思路3:鉴定炎症性肠病风险相关的差异甲基化基因位点
研究方法:
(1)对154名CD患者、161名UC患者、28名未明确IBD患者(平均年龄34)和295名对照者(平均年龄33)进行了全基因组甲基化分析,以验证与吸烟相关基因位点甲基化改变的关联性。
(2)分析差异甲基化基因的CpG位点及其相关位点,并与表观遗传MR分析进行比较。
研究结论:多个基因位点的DNA甲基化改变(受多个吸烟相关DNA甲基化CpG位点调节)与CD、UC风险之间的关联得到了验证。
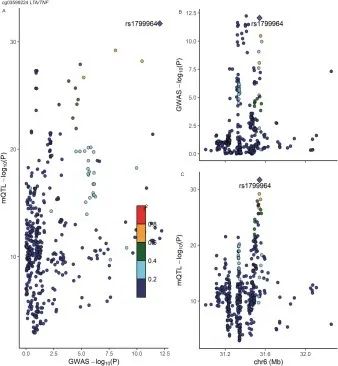
研究思路4:分析特定甲基化位点和炎症性肠病风险的关联性
研究方法:共定位分析与CD风险显著相关的9个CpG位点。
研究结论:发现cg0 3599224处的甲基化(位于HLAIII类基因座内的LTA/TNF附近)具有与CD易感性共享因果变异的100%后验概率。
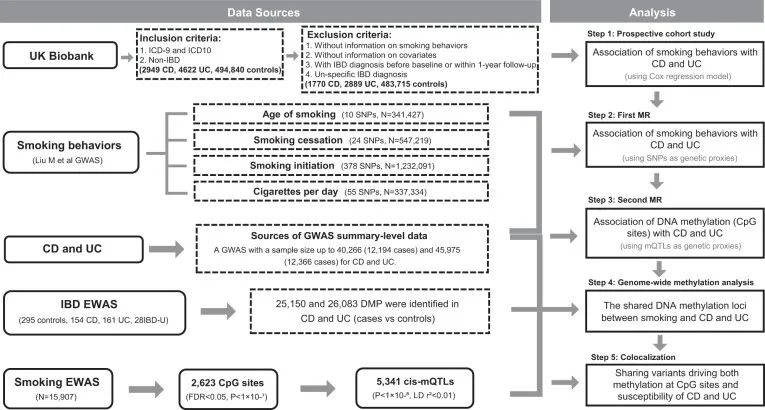
机制图
三、小结
本研究旨在通过英国生物样本库的前瞻性队列研究来评估吸烟与IBD风险之间的关联。接着,进行MR分析评估吸烟行为与吸烟相关基因甲基化与IBD之间的潜在因果关系;最后,通过全基因组甲基化和共定位分析验证这些关联。
该研究表明,DNMT3A、LTA/TNF和AHRR的表观遗传失调可能介导吸烟对IBD发病机制的致病作用,从而为肠道中免疫系统功能和机制的研究提供见解,以探索该致病机制的潜在途径。为开发基于表观遗传机制的新型药物和非药物干预措施以预防和治疗IBD提供了潜在的支撑。
参考来源:
Zhang H, Kalla R, Chen J, et al. Altered DNA methylation within DNMT3A, AHRR, LTA/TNF loci mediates the effect of smoking on inflammatory bowel disease. Nat Commun. 2024 Jan 18;15(1):595.