胆道恶性肿瘤(BTC)是一种起源于胆道的高度侵袭性的恶性肿瘤。它包括肝内胆管癌(ICC)、肝外胆管癌(ECC)以及胆囊癌(GC),在消化道恶性肿瘤中约占3%。尽管在肿瘤学领域取得了显著进展,但由于这些肿瘤发现时多为晚期且具有高度侵袭性,因此预后通常较差。BTC常在早期就出现肿瘤转移,其发病率和死亡率均呈上升趋势。对于那些局部病灶可切除的患者,手术往往能提供最佳的治疗效果。然而,即使接受根治性手术,其术后复发的风险依然很高。因此,BTC患者越来越多地采用多模式的治疗策略,包括手术切除、系统治疗(如分子靶向药物、静脉化学治疗、免疫治疗)以及与局部治疗组合的方案等。鉴于治疗的复杂性和外科诊疗技术的不断进步,本文特别解读了最新实践指南中关于BTC(尤其是ECC和GC)外科治疗的要点以及围手术期治疗的注意事项(表1)。

1BTC的评估要点
1.1 ECC的诊断与分期
ECC按解剖位置分为肝门部胆管癌(pCCA)或远端胆管癌(dCCA),其中起源于肝总管的pCCA亦称Klatskin肿瘤,dCCA则始于胆囊管汇合部以下的胆总管。鉴于ICC和ECC在生物学特性上存在差异,它们应作为独立癌种进行治疗。ECC患者通常因胆道梗阻而表现出腹痛和黄疸。dCCA可通过胰十二指肠切除术治疗,而pCCA则通常需要更大范围的肝切除和肝外胆管切除。
对pCCA患者而言,术前胆道引流有助于恢复肝功能并降低术后并发症的发生率。如果在大范围肝切除术前未进行胆道引流的相关治疗,其术前胆红素水平的升高可能会增加术后并发症的发生率和死亡率。在考虑pCCA行大范围肝切除术时,术前引流对将来保证足够的FLR尤为重要。欧洲肿瘤内科学会(ESMO)指南建议:在引流前需完成影像学诊断,因为支架或引流管可能干扰对病变范围的判断。美国国立综合癌症网络(NCCN)指南建议:当临床医生担心FLR不足或患者需要门静脉栓塞时应进行术前引流。欧洲胃肠内镜学会(ESGE)的临床指南指出:虽然不建议在肝外胆道梗阻的情况下常规进行术前胆道引流,但对于合并胆管炎、症状性黄疸(如瘙痒)、手术延期或新辅助化疗计划中的患者则应考虑使用。美国肝胆胰外科协会(AHPBA)的共识声明还指出:在营养不良、肝功能不全或因胆红素升高导致的肾功能不全以及准备门静脉栓塞的情况下也应进行术前胆道引流。根据三项回顾性研究数据显示:与经皮经胆管穿刺引流相比,通过内镜途径进行的胆道引流能延长患者生存期并减少肝内复发。因此,ESMO和ESGE指南一致认为内镜引流应作为术前胆道引流的首选。通过内镜逆行胰胆管造影(ERCP)可以放置胆道支架用来引流并支撑胆道。在进行ERCP时,应利用内镜超声(EUS)来评估肿块性质并进行活检。然而,若因肿块难以穿过而无法放置胆道支架,可采用经皮经肝的介入放射学技术引流扩张的肝内胆管。
在临床工作中,ECC的诊断和解剖范围的确定往往存在一定的困难,尤其在pCCA中更为明显。医生可以通过ERCP对胆道系统进行冲洗,以及通过EUS引导下的细针穿刺对肿大淋巴结进行活检诊断。此外,SpyGlass胆道镜检查能够更准确地评估病变程度,并为手术规划提供关键信息。器官获取和移植网络(OPTN)指南指出:鉴于肿瘤种植的高风险,如果患者正在考虑进行器官移植则不应接受经皮或经腹腔活检(包括EUS下活检)。在活检组织病理学检查未能明确诊断的情况下,直接进行手术治疗是合适的。
实验室检查应包括肝功能、凝血功能和血常规检查以评估潜在的肝功能损害情况。肿瘤标志物检测应包括CEA和CA19-9。NCCN指南还建议:若怀疑存在自身免疫性胆管炎或胆管疾病则应检测血清IgG4的水平。腹部/盆腔增强CT或MRI以及胸部CT可用于评估疾病的程度和远处转移情况。ESMO指南推荐将MRI结合磁共振胰胆管造影作为首选的诊断工具。在肿瘤不可切除或存在远处转移的情况下应根据NCCN指南进行分子检测,以确定潜在的治疗靶点。
1.2 GC诊断与分期
GC通常表现为胆绞痛或慢性胆囊炎的症状,有时可伴有黄疸的表现。GC在影像学上主要表现为胆囊肿块,或在病理学检查中偶然发现。在多数情况下,GC是在腹腔镜胆囊切除术后的病理检查中发现的。NCCN、ESMO和西班牙医学肿瘤学会的指南建议对GC患者的分期进行检查,包括胸部CT扫描、腹部/盆腔CT或MRI扫描,以及包括肝功能检查和肿瘤标志物CEA和CA19-9在内的实验室检查。若影像学检查发现肿块,NCCN指南建议在最终手术切除前进行腹腔镜探查。在不可切除或合并转移性疾病的情况下,应取活检组织进行分子检测,以确定可进行靶向治疗的基因突变位点。
2临床治疗建议
2.1 ECC手术治疗
对于可切除的ECC患者,如果没有远处转移则建议行手术切除。NCCN和欧洲胆管癌研究网络(ENS-CCA)指南指出,对于ECC通常不需要腹腔镜检查;但在高度怀疑疾病播散的情况下,应在切除手术前考虑行腹腔镜探查。根据AHPBA的共识声明:对于非转移性pCCA患者,如出现双侧节段性胆管病变、单侧肝萎缩伴对侧节段性胆管或血管受累,或单侧节段胆管扩张伴对侧血管受累的情况,则不适宜手术。目前指南普遍认为:无论ECC的位置如何,如存在远处肝脏转移、腹膜转移和肝门以外的淋巴结转移均是手术的禁忌证。
ECC的切除方式取决于其解剖位置。dCCA需要进行Whipple手术。ESMO、NCCN和AHPBA指南建议使用Bismuth-Corlette分期系统并根据胆道受累的程度对pCCA进行分类(图1)。目前pCCA的Bismuth-Corlette分类如下:Ⅰ型肿瘤位于肝管汇合处(HDC)的远端,Ⅱ型肿瘤延伸至并累及HDC,Ⅲ型肿瘤累及HDC以及右(ⅢA型)或左(ⅢB型)肝管的近端,而Ⅳ型肿瘤延伸至双侧肝近端管直至节段胆管。受累侧肝脏的切除及胆道重建是处理胆道汇合处肿瘤的关键。Ⅰ型、Ⅱ型和ⅢA型肿瘤通常需要扩大的右肝切除术,而ⅢB型病变则需要左肝切除术。此外,NCCN指南和AHPBA共识声明建议在处理pCCA时需同时切除尾状叶以增加边缘阴性切除的机会,从而降低术后复发率。在极少数情况下,一些Ⅰ型ECC或胆管中段肿瘤患者可能只需进行单纯的胆管切除术和局部淋巴结清扫术,但这种做法并不常见。

注:Ⅰ型肿瘤位于肝管汇合处(HDC)的远端。Ⅱ型肿瘤延伸至并累及HDC。Ⅲ型肿瘤累及HDC以及右(ⅢA型)或左(ⅢB型)肝管的近端。Ⅳ型肿瘤延伸至双侧肝近端管直至节段胆管。RHD代表右肝管,LHD代表左肝管,HDC为肝管汇合处。
图1 肝门部胆管癌Bismuth-Corlette分型
NCCN和ESMO指南一致认为,手术切除肝门部和远端ECC的目标是实现切缘阴性切除。根据NCCN指南:手术过程中可能需要对术中冷冻边缘进行评估,以确定近端和远端胆管的阴性切缘。如果切缘结果呈阳性并且条件允许的话应进一步切除以达到阴性切缘。此外,该指南还指出:pCCA的标准治疗应包括门静脉周围淋巴结的清扫。对于dCCA也需要进行包括胰头周围淋巴结在内的清扫。
同样根据NCCN指南:对于可耐受手术的患者可以考虑进行肝脏和胰腺联合切除术以清除范围较广的原发肿瘤。然而,由于这种手术的高难度以及术后生存获益较低,因此不推荐进行远处淋巴结的清扫。NCCN指南报告:对于pCCA可能需要切除和重建主要血管系统(如门静脉、肝动脉)以获得边缘阴性切除。然而,AHPBA共识指南并不推荐常规的血管切除术。相反,是否进行血管切除可能需要在手术中根据情况决定。ENS-CCA指南指出:肿瘤基底超过门静脉主干或肝总动脉180°与预后不良相关。即使存在广泛的血管受累且尽可能的切除可能带来益处,手术的风险和获益应在手术前进行综合权衡。
对于无法切除的pCCA患者(局部进展但区域淋巴结阴性),在完成新辅助放化疗后肝移植可能是一种选择。ENS-CCA、NCCN和ESMO指南均推荐对符合选择标准的不可切除的HCC患者进行新辅助放化疗和移植评估。根据OPTN指南:不可切除的HCC患者必须接受新辅助治疗和手术分期评估,以确定是否存在区域淋巴结转移、肝内或肝外的转移。接受移植患者必须符合下列诊断标准,包括恶性狭窄的活检结果阳性,以及在没有胆管炎或直径<3 cm的肝门肿块的情况下CA19-9水平高于100 U/mL且没有进行过经腹膜穿刺或原发肿瘤活检。此外,肝脏移植仅适用于早期pCCA(肿瘤<3 cm,淋巴结阴性)的患者。
2.2 ECC围手术期治疗
根据BILCAP研究的数据,NCCN指南推荐对不同类型的BTC患者均采用卡培他滨作为辅助化疗药物。相较之下,针对ECC患者的辅助治疗数据较为有限。有回顾性研究显示,对ECC患者实施辅助放化疗能有效提高局部控制率和生存率,尤其对于T3/T4期肿瘤、R1切除或淋巴结转移的患者其获益会更加明显。在西南肿瘤组(SWOG)进行的二期S0809试验中,对包括ECC和GC患者在内的T2~4期肿瘤或切除边缘阳性的患者施以吉西他滨和卡培他滨的联合治疗,随后辅以放射治疗(卡培他滨作为增敏剂)。这一方案的耐受性良好,两年生存率达65%,中位总生存期为35个月。然而,第三阶段的数据仍待进一步验证。
2.3 GC手术治疗
NCCN和ESMO指南建议对可切除的GC尽早进行手术。NCCN和AHPBA共识声明指出:黄疸是手术的相对禁忌证,因为这些患者往往伴有较高的淋巴结转移率、肿瘤播散或两者兼而有之,预后较差。NCCN、ESMO和AHPBA的指南都建议:只有在能够实现切缘阴性的情况下才应进行手术。手术通常包括进行根治性胆囊切除并切除肝脏4b/5段。如果先前已经进行过胆囊切除,那么手术仅限于肝脏的4b/5段。更晚期的GC可能需要进行更大范围的切除,如右半肝切除。AHPBA指南还建议术中对胆囊管侵犯情况进行评估。AHPBA和NCCN指南提出:如果胆囊管的冷冻切片评估为阴性,则不推荐常规切除胆管。
对于那些在先前的胆囊切除术中被诊断出意外GC的患者,ESMO指南建议:如果在首次手术中未能完整切除胆囊,或胆囊在手术中穿孔,则应切除胆囊管与胆管汇合部位。相比之下,AHPBA和NCCN指南不建议常规进行腹腔镜穿刺孔周围组织的切除,因为穿刺孔相关复发通常与疾病的扩散相关,切除可能不会改善生存结果。在进行肝切除时,应常规进行至少6枚区域淋巴结的清扫术。手术可以通过微创或开放手术方式进行。NCCN指南根据分期明确了GC的手术处理方法,在胆囊切除术中意外发现的GC应由肝胆病理专家重新检查。
T1a(侵犯固有层)GC不需要额外的手术治疗。对于T1b或更高分期的肿瘤、伴有胆囊管边缘阳性或转移性淋巴结的GC,以及伴有手术边缘阳性的T1a肿瘤患者,应进行额外的分期评估,以判断是否需要额外的手术干预。随着肿瘤分期的提高,患者肝脏和淋巴结存在病灶残留的风险也随之增加,因此应考虑再次行根治性的肿瘤切除手术。关于肝切除的范围(即正式的解剖型4b/5节段与2 cm的非解剖性部分肝切除术)仍存在争议。目前,NCCN、ESMO和AHPBA推荐联合进行肝脏4b/5节段切除与门静脉周围淋巴结清扫术。美国肝外胆道恶性肿瘤协会指出:对于再次切除的最佳时机是在首次胆囊切除术后4至8周内。
在手术中意外发现GC的处理中,应根据能否得到熟练的肝胆外科医生的帮助而有所不同。NCCN指南指出:如果没有肝胆外科医生参与则应完成腹腔镜检查,但鉴于腹腔传播的风险不应进行活检。如果有肝胆外科医生参与,且有充分的临床证据表明肿块为GC,则应进行明确的外科切除。以上关于不同情况下GC的诊断和治疗策略的比较见图2。
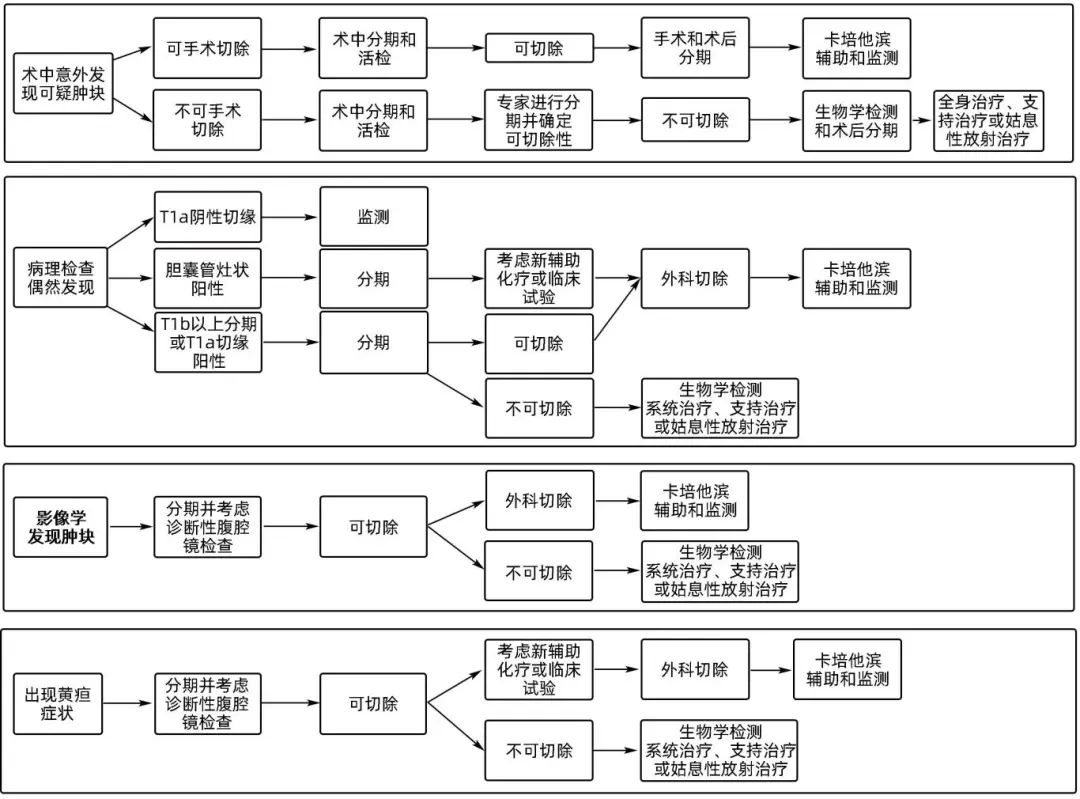
图2 基于NCCN指南的临床表现指导GC的治疗
2.4 GC围手术期治疗
与ECC的治疗类似,对于未出现远处转移的GC患者,外科医生可以在前期切除后使用卡培他滨进行术后辅助治疗。当前正在进行的OPT-IN试验是一项Ⅱ/Ⅱ期的临床试验,旨在评估新辅助治疗中吉西他滨和顺铂对于组织学证实的T2或T3期GC患者的疗效。在这项试验中,患者被随机分配接受新辅助的吉西他滨/顺铂治疗,随后进行再次手术切除,并继续接受吉西他滨/顺铂的辅助治疗(NCT04559139)。
3总结与展望
BTC中的ECC和GC一旦早期确诊通常可以通过根治性手术治疗获益。为了制定最佳的治疗方案,患者应接受多学科团队的会诊并基于肿瘤特性和患者状况讨论治疗计划,同时遵循诊疗实践指南。一些最初被认为不可切除的晚期肿瘤患者可能通过全身或局部治疗来降低疾病分期。在手术前,对患者的整体情况和规划手术后FLR进行评估至关重要。在评估肝癌和胆道癌患者时,正确的患者选择、手术切缘的阴性,以及适当的全身化疗对确保患者长期生存至关重要。尽管目前的实践指南为治疗提供了重要指导,但BTC患者的诊疗仍需要因人而异,并且越来越倾向于采用个体化、精准化的综合诊疗策略。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240407
