慢性疼痛是指持续时间超过3个月的疼痛,不仅会导致患者身体不适,还可引发患者焦虑、抑郁等不良情感和心理问题,甚至造成残疾,给患者的工作与生活均带来极大困扰[1]。
脊髓电刺激(SCS)是将电极置入椎管硬膜外腔,通过电流刺激脊髓以阻断疼痛信号向大脑传递,继而达到管理疼痛的新方法,大量研究证实该镇痛策略治疗慢性疼痛安全有效[2-6]。
近10年来,SCS在中国逐渐被引入慢性疼痛患者的管理中。2021年,中国首部SCS相关应用规范——《脊髓电刺激治疗慢性疼痛专家共识》[7]发布,有效推动了该方法的临床应用,但目前临床实践中对SCS仍存在使用不规范现象。随着多个新临床证据的出现,国内外对SCS的认知不断深入。
为进一步提升SCS在慢性疼痛应用中的科学性、安全性和有效性,同时为国内从事慢性疼痛管理的各级医生提供最新循证医学证据与建议,2024中美SCS管理慢性疼痛共识工作组组织国内外多学科专家,在充分借鉴相关指南及最新诊疗经验的基础上,经多次修订,最终形成《脊髓电刺激管理慢性疼痛中美专家共识(2024)》,以期更好地指导临床实践。
1 共识制订方法
本共识由美国克利夫兰医学中心疼痛科许继军教授牵头,并组织中美疼痛医学领域多位专家成立共识工作组。工作组包含的6位海外成员来自美国不同地区大学或私立医院/诊所,14位国内成员来自国内(含台湾)不同地区大学附属医院。2023年10月16日启动共识制订工作,对SCS在慢性疼痛管理领域的文献进行系统回顾后,以“spinal cord stimulation” “neuromodula-tion” “chronic pain” “neuropathy” “neuralgia”和“neuropathic pain”为关键词检索PubMed、UpToDate、Scopus、Ovid和Google Scholar,检索时间为建库至2023年12月1日。经去重、阅读全文后纳入符合共识主题的文献25篇(指南8篇,系统评价5篇,其他高质量临床试验和队列研究12篇)。
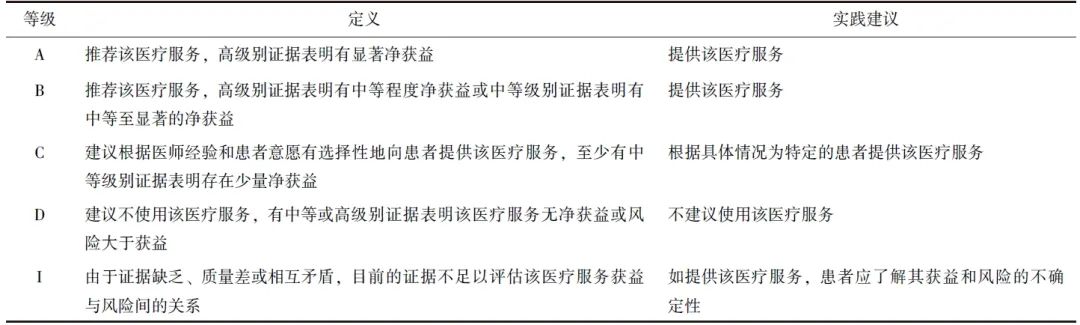
参照国内外共识制订方法[8-9],本共识根据美国预防服务工作组(USPSTF)分级指南[10],将净获益证据分为高、中、低3个等级(表1),将推荐强度分为A、B、C、D、I共5个等级,并给出相应的实践建议(表2)。
表1 净获益证据等级定义%)
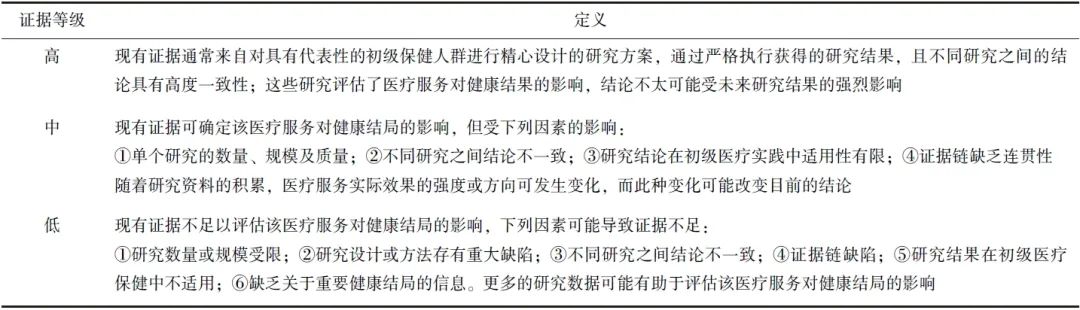
表2 推荐强度定义和实践建议
2023年12月15日完成共识初稿,经2次线上交流会,采用2轮德菲尔法对推荐意见逐条进行修订和完善,2024年1月15日由工作组专家进行无记名投票,赞同人数超过85%表示该意见达成共识,并形成共识终稿。
2 SCS适应证与禁忌证
2.1 适应证
推荐意见1
SCS的适应证包括复杂区域疼痛综合征、持续性脊柱疼痛综合征、脑卒中后疼痛、缺血性下肢疼痛、痛性糖尿病神经病变、难治性非手术性背痛、无法手术的外周血管疾病引起的疼痛(净获益证据等级:中;推荐强度:B)、幻肢痛和慢性难治性心绞痛(净获益证据等级:中;推荐强度:C)、带状疱疹相关神经痛(净获益证据等级:中;推荐强度:C)。
一般来说,保守治疗失败的慢性疼痛患者可考虑SCS治疗。目前,SCS已被美国食品药品监督管理局批准用于治疗躯干和/或四肢的多种慢性顽固性疼痛,如复杂区域疼痛综合征(CRPS)、持续性脊柱疼痛综合征(PSPS)[或称为背部手术失败综合征(FBSS)]、脑卒中后疼痛、缺血性下肢疼痛、痛性糖尿病神经病变(PDN)和难治性非手术性背痛。
在欧洲,无法手术的外周血管疾病引起的疼痛也是SCS的适应证。其他适应证包括幻肢痛和慢性难治性心绞痛,此类疼痛虽较少见但越来越多的证据支持患者可从SCS治疗中获益。与其他神经病理性疼痛综合征相比,采用SCS实现带状疱疹后神经痛(PHN)的长期缓解更具挑战性,但文献显示,SCS是PHN患者合理的选择[11-12],且中国的一些医疗中心已经开始使用短时程SCS治疗严重的带状疱疹急性期神经病理性疼痛[13]。
2.2 禁忌证
2.2.1 绝对禁忌证[14]
1
不具备使用 SCS 装置的能力;
2
FBSS患者存在可造成严重功能损害的神经压迫,以致病情不稳定或有恶化风险,且该压迫适合行外科手术治疗;
3
存在凝血障碍、免疫抑制或其他手术风险;
4
患者需行治疗性透热疗法。
2.2.2 相对禁忌证[14]
1
未治愈的精神疾病;
2
尚未确定的次级获益的可能性;
3
有药物滥用史;
4
病史、疼痛描述、体格检查与临床诊断之间不一致;
5
疼痛评分异常或多次评估结果不一致;
6
以非器质性体征为主(如Waddell征);
7
存在风险效益比与SCS相当的替代疗法可供选择;
8
妊娠状态;
9
存在职业风险(如工作需要爬梯子或操作机械/车辆);
10
局部或全身感染;
11
具有装起搏器的需求;
12
体内植入心律转复除颤器;
13
后续需行MRI检查;
14
合并慢性疼痛综合征(如纤维肌痛综合征);
15
凝血功能障碍,需进行抗凝或抗血小板治疗。
3 患者选择、筛查及宣教
推荐意见2
(1)较为理想的SCS治疗患者的选择,需根据推荐强度及获益情况进行决定,即建议净获益证据等级为“高”,推荐强度为B及以上者行SCS治疗(净获益证据等级:高;推荐强度:B)。
(2)围术期抗凝剂和抗血小板药物的管理应与专科医生协商处理(净获益证据等级:高;推荐强度:B)。
(3)对于金黄色葡萄球菌定植者,建议鼻腔使用莫匹罗星软膏和全身氯己定药浴以消灭菌落(净获益证据等级:高;推荐强度:B)。
(4)严重脊柱椎管狭窄患者应避免行经皮SCS植入术,以降低因电极造成脊髓受压的风险(净获益证据等级:中;推荐强度:C)。
(5)由参与多学科疼痛管理的心理学家或精神病学家进行心理与社会因素筛查(净获益证据等级:中;推荐强度:B);对于存在轻度药物使用障碍者,需采用个体化临床评价的方式决定其是否接受SCS测试(净获益证据等级:中;推荐强度:D)。
(6)应告知超重/肥胖、目前吸烟、服用大剂量阿片类药物的患者存在较高的治疗失败风险及植入SCS后需移除设备的风险(净获益证据等级:中;推荐强度:C)。
(7)在对患者宣教时,测试过程的沟通交流应与永久植入SCS的交流分开进行(净获益证据等级:中;推荐强度:B)。
3.1 患者选择
SCS作为一种治疗方法并非适用于所有慢性疼痛患者,因此患者选择至关重要。在筛选患者时需评估适当的疼痛指征和可预测影响治疗效果的患者因素(心理状态/吸烟/阿片类药物使用情况)[5]。此外,患者对SCS治疗过程、相关风险与获益及长期管理要求的总体理解也是需评估的重要内容。
3.2 患者筛查
3.2.1 凝血功能障碍
SCS测试和永久植入术为高风险操作,可导致脊髓硬膜外血肿和严重脊髓内出血,因此,凝血功能障碍是SCS治疗的绝对禁忌证。此外,围术期抗凝剂和抗血小板药物的管理应与患者的专科医生协商处理[15],停用此类药物可导致相关并发症发生,并影响SCS测试的时间。
3.2.2 全身或局部感染
活动性感染是SCS测试和植入术的相对禁忌证。应在SCS测试和植入前,对存在的感染进行诊断和治疗。为预防SCS术后感染,应在术前对患者进行金黄色葡萄球菌,包括甲氧西林敏感的金黄色葡萄球菌(MSSA)和甲氧西林耐药的金黄色葡萄球菌(MSRA)检测。对于金黄色葡萄球菌定植者,建议鼻腔使用莫匹罗星软膏和全身氯己定药浴以治疗感染[4]。
3.2.3 影像学检查
术前应行脊柱影像学检查以预测手术难度,并排除可能更适合手术而非SCS治疗的患者。对于患有严重退行性疾病、椎管狭窄或脊柱侧凸的患者,胸段影像学检查(靶节段CT+三维重建;胸椎MRI)有助于术前规划。通常严重脊柱椎管狭窄患者应避免行经皮SCS植入术,以降低因电极造成脊髓受压的风险。
3.2.4 心理、社会因素筛查
心理与社会因素筛查是SCS治疗的重要组成部分,这是由于此类因素会影响SCS的长期疗效,尤其是患者满意度。在患者接受SCS测试前,应使用包括抑郁筛查在内的客观、有效的测试方法或问卷对患者的高风险心理及社会因素进行筛查,且最好由参与多学科疼痛管理的心理学家或精神病学家进行评估。
严格来说,不建议活动性精神病或持续性药物使用障碍(SUD)患者(包含酒精依赖者)进行SCS治疗,但若为轻度SUD[美国精神疾病诊断标准(第5版)评定具有2~3种症状]、既往或正在接受SUD相关治疗时,需采用个体化临床评价的方式决定患者是否适合接受SCS测试。
超重或肥胖[16]、目前吸烟[17]可显著增加SCS治疗过程中的感染风险,以致治疗失败;而术前使用大剂量阿片类药物(>90 mg吗啡等效剂量/d)可诱导痛觉过敏,接受SCS治疗时亦存在较高的治疗失败风险[18]。一旦治疗失败需移除SCS设备。应向患者提供相应的有关减重、戒烟或阿片类药物减量相关获益的宣教与咨询,并考虑适时转诊至相关专科。
3.3 患者宣教
由于患者间存在较大的个体差异,应根据特定患者的期望和心理因素(如情绪、行为和认知),采用个体化方法合理设定患者在SCS测试中对疼痛缓解程度的预期。在进行SCS测试前,需向所有患者提供有关SCS治疗及可能的长期治疗效果宣教,包括疗效、安全性及对其他医疗需求的影响。SCS测试期间,除需提供所要求的书面信息外,可就治疗作用、测试过程、测试设备管理及可能出现与测试相关的疼痛、潜在并发症与患者进行单独沟通,以提高效率。值得注意的是,测试过程的沟通交流需与永久植入SCS的沟通交流分开进行。
4 SCS测试期注意事项
推荐意见3
(1)预防手术感染除可采取全身和局部措施外,最大限度减少组织创伤、保持组织完整性及缩短手术时间对于降低感染风险也具有重要意义(净获益证据等级:高;推荐强度:A)。不建议SCS测试期内常规使用术后抗生素,除非患者有特定的合并症,如免疫功能低下、糖尿病控制不佳等(净获益证据等级:低;推荐强度:D)。
(2)对于异常感觉依赖型SCS系统,电极放置应以异常感觉覆盖疼痛区域为导向,并应至少覆盖80%的疼痛区域;对于非异常感觉依赖型SCS系统,可根据解剖位置进行电极放置(净获益证据等级:中;推荐强度:B)。
(3)不建议在全身麻醉或深度镇静状态下植入电极(净获益证据等级:低;推荐强度:C)。
(4)SCS测试期中位持续时间为7 d,为降低感染风险,一般不建议SCS测试持续时间超过10 d(净获益证据等级:中;推荐强度:D)。
(5)SCS测试的评估应包括治疗效果、异常感觉依赖型SCS系统异常感觉对疼痛区域的覆盖率、患者对异常感觉的耐受性3个方面(净获益证据等级:高;推荐强度:A),并进行包括疼痛缓解程度、功能与睡眠改善状况、镇痛药物使用量及总体患者满意度在内的多维度评价(净获益证据等级:中;推荐强度:B)。应使用适宜的患者特定活动或目标设定,或疾病特定工具评估患者接受SCS测试后的功能改善情况(净获益证据等级:中;推荐强度:B)。
(6)SCS测试期间或测试结束时,使用经过验证的疗效评估工具证明疼痛缓解≥50%被视为治疗有效(净获益证据等级:高;推荐强度:A)。在疼痛改善程度低于50%的患者中,如因疼痛而受限的肢体功能得到显著改善(≥50%)或阿片类药物使用量显著减少(>50%)也可视为治疗有效(净获益证据等级:低;推荐强度:C)。经评估为治疗有效者,可择期行永久植入,否则应移除SCS设备。对于接受异常感觉依赖型SCS系统植入的患者,测试期间应评估是否有足够的异常感觉对疼痛区域的覆盖率,阈值为80%或更高(净获益证据等级:中;推荐强度:B)。
(7)周围血管疾病患者在接受SCS测试时,除对常规治疗效果参数进行评定外,还应采用经皮氧分压或红外成像技术作为评估血流改善的客观指标(净获益证据等级:高;推荐强度:A)。
(8)测试电极植入结束时应检查电极位置(净获益证据等级:低;推荐强度:C)。
(9)PHN病程少于6个月时,短时程SCS治疗有效(净获益证据等级:中;推荐强度:B)。
SCS并非对所有类型的慢性疼痛均有效,即使患者具有相同的适应证,SCS疗效亦可能存有较大差异,因此通常SCS的治疗分为两个阶段进行:测试期和植入期。
SCS测试是将柱状经皮穿刺电极或桨状外科电极垂直放置于脊柱硬膜外腔与疼痛区域的传入信号重叠位置(采用刺激引起的异常感觉进行测试),电极连接至外部脉冲发生器,通过持续数天的纵向观察期以评估治疗效果并决定是否进行永久植入术,故SCS测试期不仅可让患者对SCS具有直观感受和体验,还可评估疗效、患者满意度以作为临床筛查的有效补充,其主要目的是确定潜在的永久植入术受益者。
SCS的镇痛作用可不依赖于刺激所诱发的异常感觉,即无异常感觉型刺激模式,包括“高频”“高密度”“簇状(Burst)刺激”等。由于此类SCS不产生异常感觉,因此可根据疼痛所在的解剖位置经验性放置电极,例如将一根电极尖端置于T8椎体上缘,另一根电极尖端置于T9椎体上缘,以持续调控PSPS/FBSS和PDN患者的下背部与腿部疼痛。
4.1 预防感染
SCS测试和植入术均应采用严格的无菌技术、进行完善的外科皮肤准备和铺巾,操作过程需在X线或CT引导下进行。为减少围术期感染,应在术前1 h内根据患者体质量静脉预防性使用抗生素。推荐的首选药物为头孢唑林,克林霉素和万古霉素可作为备选。除可采取全身和局部抗感染措施外,最大限度减少组织创伤、保持组织完整及缩短手术时间对于降低感染风险也具有重要意义。不建议测试期内常规使用术后抗生素(无论短期或是全程),除非患者有特定的合并症,如免疫功能低下、糖尿病控制不佳等。
4.2 电极选择和放置
除特定情况下基于患者因素的技术考虑外,通常SCS测试首选经皮穿刺电极植入法,而非外科手术法(椎板切开术或椎板切除术)。根据医生的技术专长、临床因素及当地医疗条件,可考虑植入永久电极(分阶段)或临时电极,二者均可安全用于SCS测试。SCS电极放置的最佳节段取决于疼痛部位:对于腰背部和下肢疼痛,电极应放置于下胸段/腰部上段;对于颈神经根性疼痛或上肢CRPS相关疼痛,电极可由中段或上段胸椎硬膜外向上置入。
在硬膜外腔置入电极时,推荐采用实时成像技术进行监控和引导。在进行异常感觉覆盖范围测试前,应确认电极位于硬膜外后间隙。对于异常感觉依赖型SCS系统,电极放置应以异常感觉覆盖疼痛区域为导向,应至少覆盖80%的疼痛区域;对于非异常感觉依赖型SCS系统,可根据解剖位置进行电极放置,是否进行实时感觉测试取决于患者个体情况。
4.3 测试的麻醉方法
经皮穿刺SCS测试通常在局部麻醉和监护性麻醉下进行。由于存在脊髓损伤风险,除非存在特定的技术挑战或考虑患者因素,否则不建议在全身麻醉或深度镇静(无法引起患者反应)下植入电极。如测试电极需在全身麻醉或深度镇静下植入,应在病历记录中注明患者的具体指征,并在术中进行神经生理监测以确保异常感觉依赖型SCS系统放置到位。
4.4 测试持续时间
最常见的SCS测试期持续时间为3~7 d(中位时间为7 d)。由于延长测试时间可增加感染风险,且通常未带来更加明显的获益,因此一般不建议测试持续时间超过10 d(需考虑区域/城市/国家特定的卫生监管机构或支付系统)。
4.5 测试评估
SCS测试的评估与测试的正确实施同等重要,评估内容包括:
1
疼痛减轻程度及治疗对日常生活活动(ADL)和睡眠的影响;
2
异常感觉依赖型SCS系统异常感觉对疼痛区域的覆盖率;
3
对SCS诱发的异常感觉的耐受性。
根据既往相关随机对照研究数据进行估计[5,19-20],SCS测试在SCS治疗候选患者(涉及所有疼痛状况)识别方面具有良好的灵敏度(77%~100%)和中等的特异度(35%~53%)。测试成功率一般定义为测试后永久植入占测试植入数的比率,该指标可反映SCS治疗对患者选择标准的严格度。在美国临床实践中,该数据通常分布于50%~95%。
对于SCS测试期患者,应采用经过验证的评估方法对治疗效果进行多维度评价,评价内容包括疼痛缓解程度、功能与睡眠改善状况、镇痛药物使用量及患者总体满意度。应使用适宜的患者特定活动或目标设定,或疾病特定工具评估患者接受SCS测试的功能改善情况。
SCS测试期间或测试结束时,经疗效评估患者疼痛缓解≥50%才被视为治疗有效。在疼痛改善低于50%的患者中,如功能显著改善(≥50%)或阿片类药物使用量显著减少(>50%),也可视为治疗有效。对于接受异常感觉依赖型SCS系统植入的患者,测试期间还应评估是否有足够的异常感觉对疼痛区域的覆盖率,阈值为80%或更高。
需注意的情况:目标区域内存在已知的感觉减退区继而导致无法达到足够的异常感觉对疼痛区域的覆盖率,此时应采取综合性评估。周围血管疾病患者在接受SCS测试时,除对其他治疗效果参数进行评定外,还应采用经皮氧分压或红外成像仪作为评估血流改善的客观指标。
SCS测试可引起脊髓和神经根损伤等短期或长期并发症,潜在的不良反应包括操作过程中疼痛、出血(如硬膜外血肿)、感染、电极断裂、电极移位及硬脊膜意外穿破引起的头痛。文献显示,SCS测试相关并发症发生率约为2%~5%[21],且通常较轻微,故总体而言,SCS测试的获益显著大于其潜在风险。最新研究发现,SCS测试过程中电极移位发生率较既往有所升高[22-23]。建议植入电极后确认其位置,以发现可能出现的电极移位,并在术中及时进行调整,从而保证电极位置准确。
4.6 短时程SCS
来自中国的经验表明[12],短时程SCS(电极放置1~2周)对PHN患者是安全的。如PHN病程不足6个月,短时程SCS治疗被认为有效。短时程SCS治疗期间是否需应用抗生素尚未达成共识[12]。
5 SCS植入期注意事项
推荐意见4
对于需频繁进行MRI检查的患者,应选择与MRI相兼容的SCS设备,并与患者及设备制造商评估MRI的安全性(净获益证据等级:中;推荐强度:C)。
SCS测试期结束后需移除电极,经评估治疗有效者择期行永久植入术。目前国外等待时间一般超过2周,而国内一般在测试结束2周内进行植入术,其关键在于需排除感染。建议植入术于测试完成后至少2周后进行,以确保测试期未发生感染。
5.1 预防感染
SCS测试中预防感染的注意事项和措施均适用于植入术。此外,植入式脉冲发生器(IPG)囊袋和电极放置切口部位的止血对于最大限度降低血肿、皮下积液和感染风险至关重要,减少电切皮肤和良好的皮肤对合亦有助于降低感染发生率。
5.2 植入术麻醉方法
同SCS测试过程。
5.3 电极放置
于下背部中线处作一小切口(5~10 cm)以便插入硬膜外穿刺针,待穿刺针到位后,在X线或CT引导下放置电极并锚定,经皮下隧道连接电极延长线。
5.4 植入式脉冲发生器的放置
IPG的类型特征包括控制电能(即恒定电流与恒定电压)的方法、频率范围、刺激波形、是否可充电、电极特性及MRI兼容性。IPG提供的电刺激可通过改变脉宽、频率和振幅进行调节,以最大程度减轻疼痛。应根据疼痛类型、供应商、患者偏好及成本因素进行个体化选择。IPG通常放置于髂嵴上方的侧背部,也可置于臀部或腹部,放置深度一般为皮下1.5~2.5 cm。
5.5 MRI兼容性
据报道,MRI对SCS的不良影响包括改变脉冲频率、幅度、脉宽、电极设置,改变IPG囊袋周围的瞬时温觉,引发电池耗尽及导致IPG激活或失活[23]。对于需频繁进行MRI检查的患者,应选择与MRI相兼容的SCS设备。目前,虽然几乎所有新型SCS系统均与MRI相兼容(多数可承受1.5 T的MRI检查)[24],但为确保安全,在选择具体的设备前仍应与患者及制造商就MRI兼容性进行确认。
6 并发症及其处理方法
推荐意见5
(1)手术创口应多层缝合,暴力、钝性分离及过度使用电刀均可增加皮下积液的风险(净获益证据等级:中;推荐强度:B)。
(2)缝线脓肿和皮肤炎症等浅表部位感染可予以抗生素治疗。如怀疑有深层感染,应移除所有植入物,予以抗生素治疗直至感染完全消除后再行植入术,且二次植入术应在既往感染未累及部位进行(净获益证据等级:高;推荐强度:B)。
(3)如SCS植入术中发生硬脊膜穿破,可在原硬脊膜穿刺部位以上节段重新穿刺,或中止手术(净获益证据等级:中;推荐强度:C)。对于中重度、持续时间较长(>24 h)且保守治疗无效的硬脊膜穿破后头痛患者,推荐予以硬膜外血补片治疗(净获益证据等级:高;推荐强度:B)。
(4)SCS测试和植入术中及术后,患者出现任何背痛或根性痛加重现象均应考虑脊髓硬膜外血肿的可能,此类患者如伴有感觉缺失、下肢无力或肠道膀胱功能障碍等症状,应立即联系神经外科会诊并行手术治疗(净获益证据等级:高;推荐强度:B)。
(5)SCS麻醉方法推荐采用局部麻醉并进行适当镇静。对于需全身麻醉的患者,建议进行神经电生理监测以及时识别可能存在的脊髓损伤(净获益证据等级:中;推荐强度:B)。
6.1 皮下积液
手术创口应行多层缝合,以避免皮下形成可聚集液体的空腔。暴力、钝性分离及过度使用电刀可增加皮下积液的风险。皮下积液通常可自行消退,如消退异常时可在影像学引导下采用无菌技术进行抽液[25]。
6.2 感染
缝线脓肿和皮肤炎症等浅表部位感染可使用抗生素治疗。怀疑有深层感染时,建议移除所有植入物。当因感染移除植入物后,应推迟再次植入术,直至感染消除。二次植入术应在既往感染未累及部位进行。SCS装置感染的预防和管理建议见表3。
表3 SCS装置感染的预防和管理建议

6.3 硬脊膜穿破和硬脊膜穿破后头痛
如果患者存在解剖困难、有穿刺节段硬膜外腔手术史、术中不能保持体位合作等情形,可增加穿破硬脊膜的风险。如SCS术中发生硬脊膜穿破,可在原硬脊膜穿刺部位以上节段重新穿刺,或中止手术。轻度硬脊膜穿破后头痛(PDPH)患者可采取保守治疗,包括卧床休息、短期服用咖啡因和/或镇痛药物并充分补液。对于中重度、持续时间较长(>24 h)且保守治疗无效的PDPH患者,推荐予以硬膜外血补片(EBP)治疗。EBP的操作始终应严格遵守无菌原则,尤其对于已植入SCS设备的患者。
6.4 脊髓硬膜外血肿
脊髓硬膜外血肿(SEH)是神经外科急症,其诊治要点是及时清除血肿、进行神经减压,以避免永久性神经损伤发生。抗凝治疗者发生SEH的风险增加,因此,其采用SCS治疗时应遵循抗凝剂和抗血小板药物管理的术前指南[15],且SCS禁用于存在未控制的凝血功能障碍和严重血小板减少症患者。
SEH可发生于脊髓刺激器植入后即刻,也可于术后数天至数周发生,故SCS测试和植入术中及术后,患者出现任何背痛或根性痛加重现象均应考虑SEH的可能,此类患者如伴有感觉缺失、下肢无力或肠道膀胱功能障碍等症状,应立即联系神经外科会诊并行手术治疗。
6.5 脊髓损伤
虽然直接损伤脊髓在SCS植入过程中极为罕见,但其可导致严重后果。对于多数患者,SCS治疗时推荐采用局部麻醉并进行适当镇静,避免全身麻醉,以便患者报告可能提示神经损伤的疼痛或异常感觉。若患者需进行全身麻醉,建议进行神经电生理监测以及时发现可能存在的脊髓损伤。
7 小结
慢性疼痛是临床最常见的症状之一,近年来针对慢性疼痛发生机制、诊断与治疗策略的研究方兴未艾。SCS作为一种安全、有效、微创、可逆的神经调控疗法,已被用于多种难治性慢性疼痛的管理中,但其临床应用尚缺乏统一规范。
本共识基于现有临床证据,在SCS治疗慢性疼痛的适应证与禁忌证,患者选择、筛查及宣教,测试期与植入期注意事项等方面给出了具体的推荐意见,以期助力该治疗策略在临床规范化、标准化应用,继而帮助更多患者解除疼痛。随着SCS设备和治疗模式的优化,将会有更多SCS在慢性疼痛治疗中应用的高质量临床证据出现,本共识也将进行定期更新和改进。
参考文献
[1]De La Rosa J S, Brady B R, Ibrahim M M, et al. Co-occurrence of chronic pain and anxiety/depression symptoms in U.S. adults: prevalence, functional impacts, and opportunities[J]. Pain, 2024, 165(3): 666-673.
[2]Shanthanna H, Eldabe S, Provenzano D A, et al. Evidence-based consensus guidelines on patient selection and trial stimulation for spinal cord stimulation therapy for chronic non-cancer pain[J]. Reg Anesth Pain Med, 2023, 48(6): 273-287.
[3]Petersen E A, Stauss T G, Scowcroft J A, et al. Effect of High-frequency (10-kHz) Spinal Cord Stimulation in Patients With Painful Diabetic Neuropathy: A Randomized Clinical Trial[J]. JAMA Neurol, 2021, 78(6): 687.
[4]Mekhail N, Levy R M, Deer T R, et al. Long-term safety and efficacy of closed-loop spinal cord stimulation to treat chronic back and leg pain (Evoke): a double-blind, randomised, controlled trial[J]. Lancet Neurol, 2020, 19(2): 123-134.
[5]Mekhail N, Visnjevac O, Azer G, et al. Spinal Cord Stimulation 50 Years Later: Clinical Outcomes of Spinal Cord Stimulation Based on Randomized Clinical Trials—A Systematic Review[J]. Reg Anesth Pain Med, 2018, 43(4): 391-406.
[6]Xu J, Liu A, Cheng J. New advancements in spinal cord stimulation for chronic pain management[J]. Curr Opin Anaesthesiol , 2017, 30(6): 710-717.
[7]脊髓电刺激治疗慢性疼痛专家共识编写组.脊髓电刺激治疗慢性疼痛专家共识[J].中国疼痛医学杂志, 2021, 27(6):406-409.
[8]陈耀龙,杨克虎,王小钦,等. 中国制订/修订临床诊疗指南的指导原则(2022版)[J]. 中华医学杂志,2022,102(10):697-703.
[9]Chen Y, Yang K, Marušic A, et al. A Reporting Tool for Practice Guidelines in Health Care: The RIGHT Statement[J]. Ann Intern Med, 2017, 166(2): 128-132.
[10]U.S. Preventive Services Task force. Grade definitions[EB/OL]. [2024-01-17]. https://www.uspreventiveservicestask-force.org/uspstf/about-uspstf/methods-and-processes/grade-definitions.
[11]Sun W, Jin Y, Liu H, et al. Short-term spinal cord stimulation is an effective therapeutic approach for herpetic-related neuralgia—A Chinese nationwide expert consensus[J]. Front Aging Neurosci, 2022, 14: 939432.
[12]Isagulyan E, Tkachenko V, Semenov D, et al. The effective-ness of various types of electrical stimulation of the spinal cord for chronic pain in patients with postherpetic neuralgia: a literature review[J]. Pain Res Manag, 2023, 2023: 6015680.
[13]Wan C F, Song T. Efficacy of Pulsed Radiofrequency or Short-Term Spinal Cord Stimulation for Acute/Subacute Zoster-Related Pain: A Randomized, Double-Blinded, Controlled Trial[J]. Pain Physician, 2021, 24(3): 215-222.
[14]The Neuromodulation Foundation[EB/OL].[2024-01-17]. https://www.neuromodfound.org/treatment_of_chronic_neuropathic_pain/patient_selection/contraindication/.
[15]The Neurostimulation Appropriateness Consensus Committee (NACC): Recommendations on Bleeding and Coagulation Management in Neurostimulation Devices[J]. Neuromodulation, 2017, 20(4): 407.
[16]Mekhail N, Mehanny D, Armanyous S, et al. The impact of obesity on the effectiveness of spinal cord stimulation in chronic spine-related pain patients[J]. Spine J , 2019, 19(3): 476-486.
[17]Mekhail N, Azer G, Saweris Y, et al. The impact of tobacco cigarette smoking on spinal cord stimulation effectiveness in chronic spine-related pain patients[J]. Reg Anesth Pain Med, 2018, 43(7): 768-775.
[18]Adil S M, Charalambous L T, Rajkumar S, et al. Machine Learning to Predict Successful Opioid Dose Reduction or Stabilization After Spinal Cord Stimulation[J]. Neurosurgery, 2022, 91(2): 272-279.
[19]Lu Y, Mao P, Wang G, et al. Spinal cord stimulation for chronic intractable trunk or limb pain: study protocol for a Chinese multicenter randomized withdrawal trial (CITRIP study)[J]. Trials, 2020, 21(1): 834.
[20]Kapural L, Patterson D G, Li S, et al. Multiphase Spinal Cord Stimulation in Participants With Chronic Back or Leg Pain: Results of the BENEFIT-02 Randomized Clinical Trial[J]. Neuromodulation, 2023, 26(7): 1400-1411.
[21]Petraglia F W 3rd, Farber S H, Gramer R, et al. The Incidence of Spinal Cord Injury in Implantation of Percutaneous and Paddle Electrodes for Spinal Cord Stimulation[J]. Neuromodulation, 2016, 19(1): 85-90.
[22]Mullins C F, Royds J, Al-Kaisy A. Radiographic lead migration in percutaneous spinal cord stimulator trials[J]. Reg Anesth Pain Med,2023. doi: 10.1136/rapm-2023-104347.
[23]Das A, Gopinath S D, Arimbasseri G A. Systemic ablation of vitamin D receptor leads to skeletal muscle glycogen storage disorder in mice[J]. J Cachexia Sarcopenia Muscle, 2022, 13(1): 467-480.
[24]Sayed D, Chakravarthy K, Amirdelfan K, et al. A Comprehensive Practice Guideline for Magnetic Resonance Imaging Compatibility in Implanted Neuromodulation Devices[J]. Neuromodulation, 2020, 23(7): 893-911.
[25]Deer T R, Russo M A, Grider J S, et al. The Neurostimulation Appropriateness Consensus Committee (NACC): Recommendations for Surgical Technique for Spinal Cord Stimulations[J]. Neuromodulation,2022,25(1):1-34.