单核细胞衍生的肿瘤相关巨噬细胞(Mo-TAMs)密集浸润弥漫性胶质瘤,具有显著的异质性。
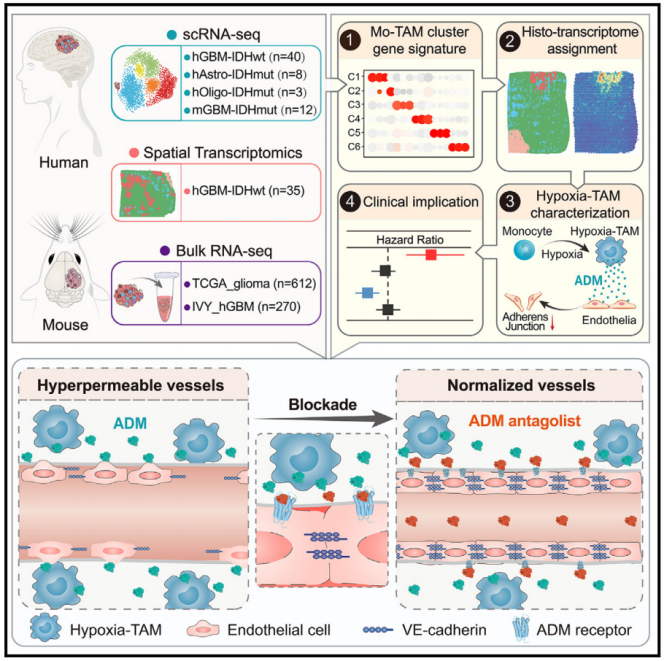
2024年4月18日,陆军军医大学第一附属医院(重庆西南医院)全军临床病理学研究所卞修武院士、时雨副教授、平轶芳教授团队联合陆军军医大学第一附属医院脑胶质瘤医学研究中心、神经外科李飞副教授、华中科技大学武汉光电国家研究中心张智红教授团队的祁淑红副研究员在Cancer Cell 在线发表题为“Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization”的研究论文,该研究绘制了51例异柠檬酸脱氢酶(IDH)野生型胶质母细胞瘤或IDH突变型胶质瘤患者的Mo-TAMs的空间解析转录图谱。该研究结果强调了弥漫性胶质瘤中Mo-TAM的多样性和空间小生境引导的Mo-TAM重编程,并指出了针对低氧TAM的潜在治疗方法,以使肿瘤血管系统正常化。

弥漫性胶质瘤,包括异柠檬酸脱氢酶野生型胶质瘤(GBM)和异柠檬酸脱氢酶突变型星形细胞瘤和少突胶质细胞瘤,是成人中最常见的恶性脑肿瘤。肿瘤相关巨噬细胞(TAM)是弥漫性胶质瘤中主要的免疫浸润TAM,直接与恶性细胞相互作用,促进肿瘤进展,并作为免疫抑制微环境的“建筑师”。因此,TAM已成为一个有吸引力的治疗靶点。
目前,几种靶向TAM的方法正在测试中,目的是干扰TAM的募集或存活,恢复TAM的吞噬作用,重编程TAM的表型,或转移基因编辑的巨噬细胞。然而,在大规模的临床试验中没有观察到这些策略的令人信服的疗效,这可能源于肿瘤内和肿瘤间显著的细胞多样性和TAM池的可塑性。因此,解剖具有不同个体起源的TAM的分子和功能异质性是合理设计有效的TAM靶向治疗的先决条件。
弥漫性胶质瘤中的TAM主要来源于外周单核细胞(单核细胞来源的TAM [Mo- TAMs])或脑内小胶质细胞(小胶质来源的TAM [Mg-TAMs])。不同于单核细胞来源的巨噬细胞驻留在正常组织中表现出稳态和抗菌功能,浸润胶质瘤的Mo- TAMs通常是肿瘤支持的,用途非常广泛。它们与Mg-TAMs的不同之处在于其独特的基因标记,主要分布在肿瘤核心,以及在GBM-IDHwt和复发性胶质瘤中的细胞频率增加。
特别是,在多种肿瘤中发现了Mo- TAMs的显著转录异质性。单细胞RNA测序(scRNA-seq)和空间转录组学技术的出现使得在分离的肿瘤小生境中探究空间解析的转录程序和细胞相互作用成为可能,为以时空方式探索肿瘤浸润免疫细胞的多样性提供了强大的工具。然而,各种Mo-TAM亚群的功能以及它们的表型是否受到空间限制或由特定的生态位线索控制,在很大程度上仍然未知。
机理模式图(图源自Cancer Cell )
该研究描述了一个定位于坏死周围生态位的Mo-TAM亚群,并被缺氧生态位线索扭曲,以获得缺氧反应特征。缺氧-TAM通过激活肾上腺髓质素旁分泌信号破坏内皮粘附连接的稳定性,从而刺激高透性的新生血管,阻碍异种胶质母细胞瘤移植的药物传递。因此,对缺氧-TAM产生的肾上腺髓质素进行基因消融或药物阻断,可恢复血管完整性,提高肿瘤内抗肿瘤药物dabrafenib的浓度,获得联合治疗效果。缺氧-TAM或肾上腺髓质素表达比例升高预示着肿瘤血管通透性过强,胶质母细胞瘤预后较差。该研究强调了弥漫性胶质瘤中Mo-TAM的多样性和空间小生境引导的Mo-TAM重编程,并指出了针对缺氧-TAM的潜在治疗方法,以使肿瘤血管系统正常化。
陆军军医大学西南医院病理科(病理学研究所)硕士生王文英、博士生李天然和程玥,神经外科李飞副教授,华中科技大学武汉光电国家研究中心祁淑红副研究员为该论文的并列第一作者。陆军军医大学第西南医院病理科(病理学研究所)、重庆金凤实验室的时雨副教授、卞修武院士和平轶芳教授为共同通讯作者。陆军军医大学第一附属医院神经外科冯华教授、胡荣教授,全军临床病理研究所刘新东教授、王岩教授、刘浩飞博士,华中科技大学武汉光电国家研究中心张智红教授,陆军军医大学第二附属医院朱波教授等也为这项研究提供了建议或技术指导。
原文链接:
https://www.cell.com/cancer-cell/abstract/S1535-6108(24)00119-3