广阔的应用前景正引领着纳米材料和纳米制造技术的蓬勃发展。纳米材料在给我们生活、生产等各方面带来便利的同时,也给人类的健康带来重大的威胁。多壁碳纳米管(multi-walled carbon nanotubes, MWCNTs)是目前应用最多的新型纳米纤维材料,其大规模地生产和使用给人类健康带来的危害已经引起越来越多的关注。由于防护措施并不完善,从事 MWCNTs 生产和使用的相关工作人员面临着巨大的职业暴露风险。此外,MWCNTs 是大气中 PM2.5 的重要组成成分,普通人群也很容易在不良的空气环境中接触到 MWCNTs。因此,人类暴露于 MWCNTs 已经是常态化事件。碳纳米管暴露直接影响人体呼吸系统,引起炎症、纤维化,甚至肿瘤发生,但其中的机制还不甚清楚。
多项研究表明机体吸入的 MWCNTs 会被巨噬细胞吸收而引起呼吸系统的炎症应答和损伤,MWCNTs 可以调控巨噬细胞中的关键基因表达和信号通路的活化介导其不同的极化类型,因此巨噬细胞很有可能作为 MWCNTs 的直接作用靶细胞在其引起的机体炎症免疫应答中扮演重要角色。朱勇等先前报道肺部暴露MWCNTs 引起的炎症应答可以重塑肿瘤微环境,从而促进乳腺癌细胞的浸润、转移和转移灶的克隆化生长,在此过程中巨噬细胞发挥了重要作用(图1)。但是,巨噬细胞应答MWCNTs暴露进而促进乳腺癌转移及其相关机制还需要进一步研究。
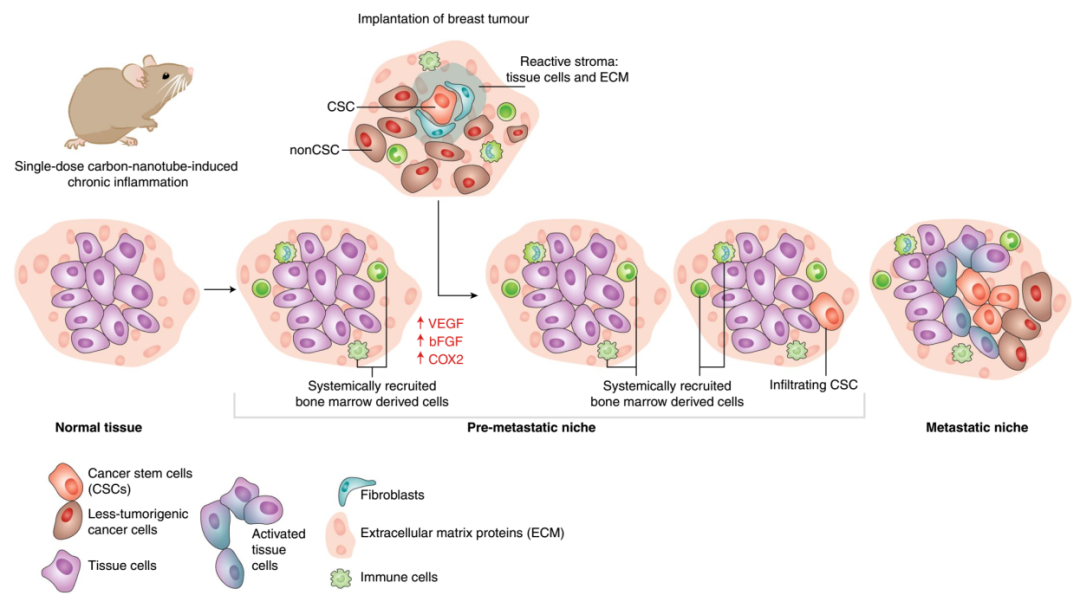
图1.碳纳米管肺暴露对乳腺癌转移影响的示意图。碳纳米管暴露导致慢性肺部炎症,释放VEGFA、bFGF和COX2,诱导肺内转移前和转移微环境的形成,促进乳腺癌细胞的侵袭和转移
近日,来自安徽医科大学的朱勇/丁克硕研究团队通过构建乳腺癌细胞/巨噬细胞共培养体系揭示了MWCNTs暴露促进巨噬细胞M2极化,进而易化乳腺癌的肺部转移和克隆化生长,并从表观遗传学角度阐明其中的分子机制。相关工作以“Multiwalled Carbon Nanotubes Reprogrammed Macrophages Facilitate Breast Cancer Metastasis via NBR2/TBX1 Axis”为题在ACS Nano上发表。

【文章要点】
该研究发现MWCNTs刺激的巨噬细胞可以显著增强乳腺癌细胞的迁移、侵袭能力。体内实验表明MWCNTs刺激的巨噬细胞促进MDA-MB-231乳腺癌细胞在小鼠肺部形成更大、更多的转移灶以及诱导更多的M2型(CD206阳性)巨噬细胞聚集。通过实时荧光定量PCR、免疫荧光和流式细胞术检测发现MWCNTs刺激可显著诱导巨噬细胞向免疫抑制的M2型极化。结合高通量测序技术筛选出巨噬细胞中的长非编码RNA NBR2表达水平受MWCNTs刺激所抑制,并且乳腺癌临床样本中NBR2表达水平与巨噬细胞浸润呈负相关。组合功能实验证实了由于MWCNTs刺激导致的乳腺癌转移增强的效应都会随着NBR2过表达而显著抑制。(图2)
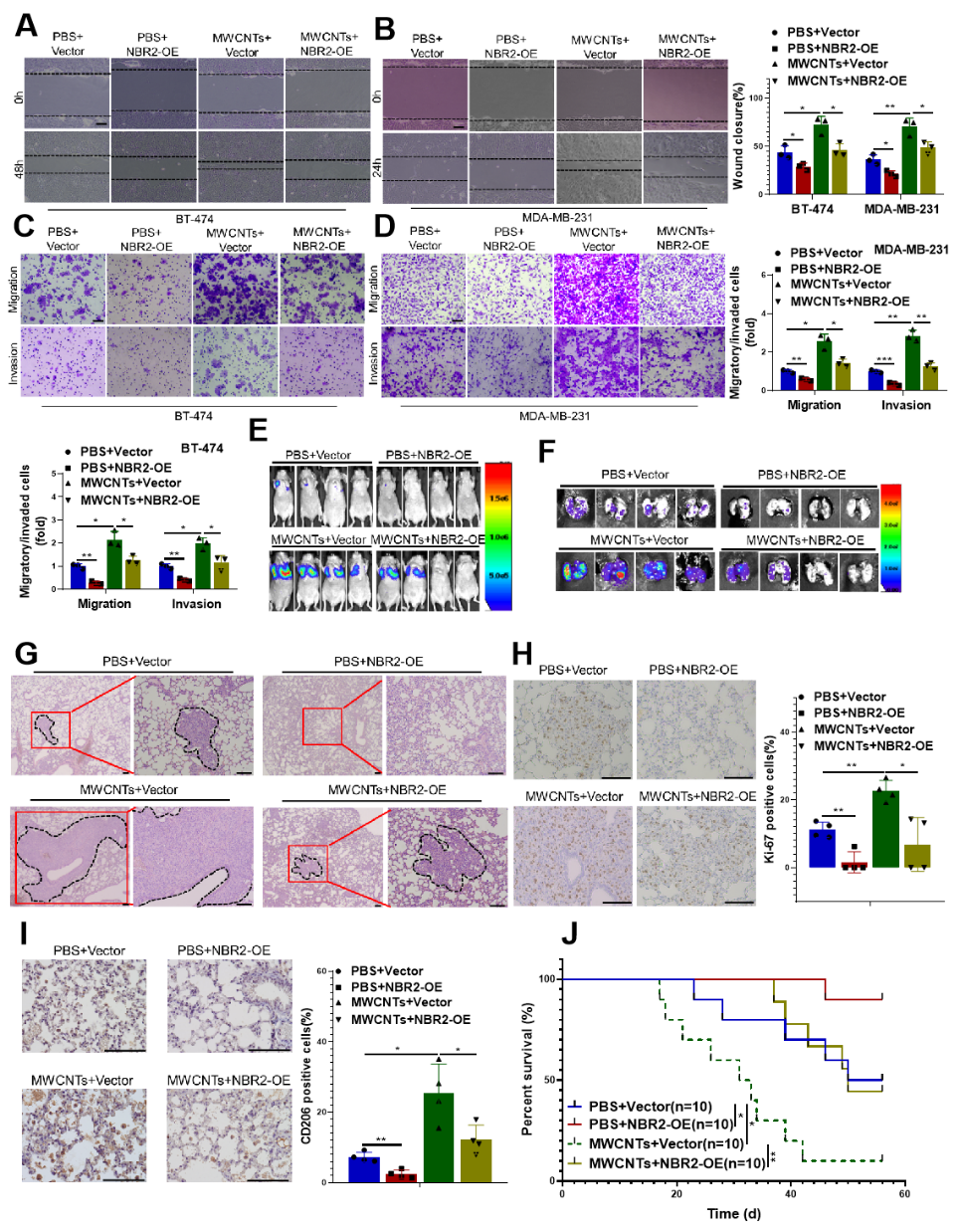
图2 MWCNTs暴露促进乳腺癌转移依赖于NBR2表达
该研究进一步通过转录组测序、生物信息学分析、分子和细胞生物学实验方法明确了NBR2介导MWCNTs暴露促进乳腺癌转移的分子机制:MWCNTs暴露下调巨噬细胞中NBR2的表达,从而激活多条M2相关信号通路(包括IL-6、IL-17、NF-Kappa B、MAPK等)。深入的机制研究发现NBR2通过与乙酰转移酶p300结合调控TBX1的H3K27ac活化进而促进TBX1表达。NBR2/p300/H3K27ac/TBX1信号通路所介导的巨噬细胞M2极化促进乳腺癌转移。(图3)。
【结论与展望】
作者最后介绍道,随着碳纳米材料的广泛使用,如何有效地评价碳纳米材料的安全性,建立科学的碳纳米材料毒理学研究体系,是纳米材料研发和广泛使用中不可回避的问题。该研究将碳纳米材料毒理学研究深入到分子层面,为MWCNTs暴露的健康危害提供坚实证据,同时提示NBR2/H3K27ac/TBX1信号通路阻断可成为乳腺癌预防、治疗的潜在方向。
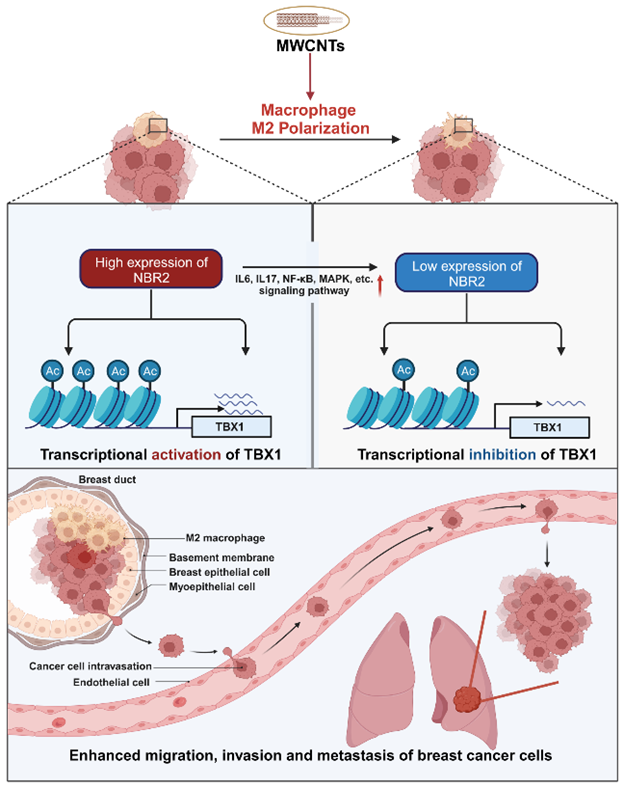
图3 NBR2/H3K27ac/TBX1调控MWCNTs暴露促进巨噬细胞M2极化介导乳腺癌转移示意图
安徽医科大学朱勇副教授,国家纳米科学中心陈春英院士和中国科学技术大学朱涛教授为该论文的共同通讯作者,丁克硕副教授、朱亚玲副教授和严朗助理研究员为本论文的共同第一作者。本研究受到国家自然科学基金、国家重点基础研究发展计划、安徽省自然科学基金等项目资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c11651