AML降低移植后复发
有效的移植物抗白血病 (GVL) 效应加上减低强度预处理 (RIC)的发展,以及供者可用性的增加,导致异基因干细胞移植 (allo-SCT) 成为适合移植的75岁以下成人 AML的治疗方案的核心组成部分。虽然支持治疗的进展和 GVHD 预防的改善在很大程度上降低了 allo-SCT 的毒性,但在降低疾病复发风险方面进展有限,相当比例的患者会复发,也是移植失败的主要原因。开发能够减少疾病复发而不增加移植毒性的新策略仍是优先事项,需要开发可能减少移植后复发风险的治疗干预。
近日《British Journal of Haematology》发表的一篇综述中,作者基于目前对疾病生物学和移植物抗白血病(GVL)效应的理解,讨论了旨在提高移植前缓解率、减少移植前MRD的方案,移植物来源的影响,优化预处理方案,并讨论了增强GVL效应的方案和移植后维持治疗。现翻译全文供参考。

AML的生物学及疾病复发
疾病生物学是移植后复发的主要风险因素,复杂核型和包括 TP53 和 FLT3-ITD 在内的基因突变均与复发风险增加相关。移植后复发的其他重要决定因素包括预处理方案强度和移植前疾病状态(包括MRD水平)。
克隆演变是移植后复发的重要特征,可导致潜在靶向突变的获得性丢失,也对维持治疗策略的选择有影响。然而,值得注意的是,allo-SCT后复发性 AML的最大转录变化与丢失或获得突变谱的差异无关,而是指向促进 GVL效应免疫逃避的机制。最熟知机制是单倍体相合移植后 HLA 表达减少伴不相合HLA 单倍型的丢失,以及HLA 相合移植后 HLA II 类分子下调。
除了可靶向抗原的克隆丢失和抗原呈递机制,疾病微环境对 GVL 效应的调节也可能是 allo-SCT 后疾病复发的重要机制。在 TP53 突变AML 中,天然免疫标记被抑制,表现为 PD-L1 表达增加、骨髓浸润的细胞毒性 T 和 NK 细胞数量减少以及调节性 T 细胞 (Treg) 比例增加。
因此,高危 AML 患者的免疫预后模型可独立预测患者的生存期,其中高危疾病的特征为CD8+ T细胞、Tregs比例更高和检查点阻断分子表达增加。鉴于免疫特征决定了骨髓衰竭综合征治疗的临床反应,因此AML的免疫特征可调节天然或异基因细胞毒性免疫应答,从而增加高危 AML患者的移植后复发率。与该假设一致,复发患者的白血病原始细胞显示检查点阻断配体表达增加,相应的检查点分子包括在 AML 特异性 T 细胞上发现的PD-1、KLRG-1和TIGIT。具体来说,PD-1+ TIM-3+ KLRG1+ 2B4+ 特征代表了在复发时 AML 患者骨髓中发现的功能性“耗尽”CD8+ 干细胞样记忆 T 细胞。虽然这似乎是半相合和无关移植受者的特征,但脐带血移植受者中较少。
总体而言,对 AML 和异基因移植后疾病复发的生物学的深入了解,尚未转化为确定的预防性治疗,但希望这些知识能为未来的移植前、移植期间和移植后策略的设计提供信息,以减轻复发风险(图1)。下面详细解读各策略。
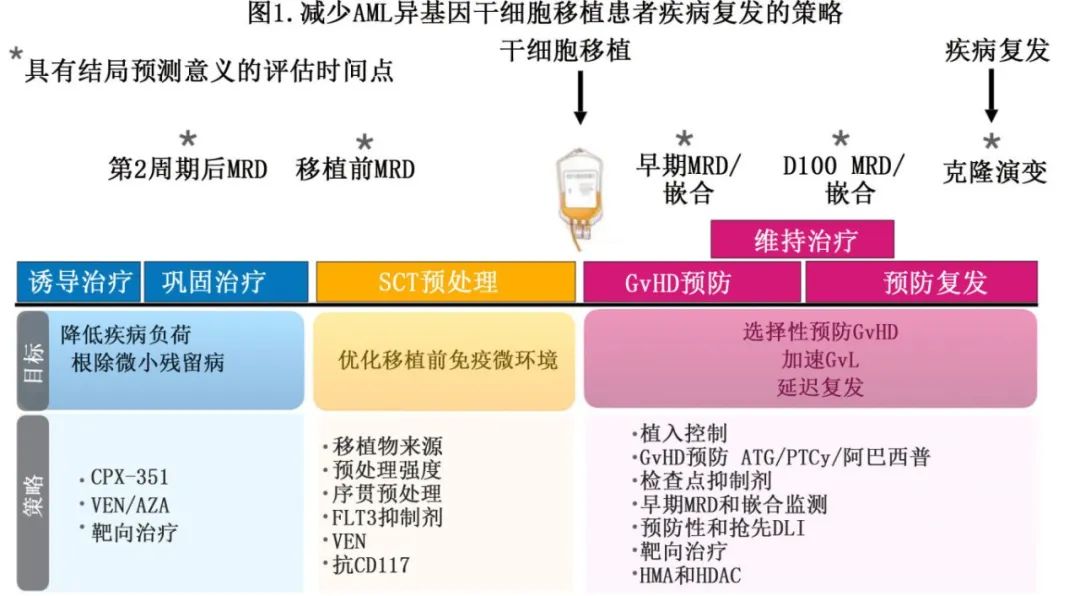
减少异基因移植后疾病复发的移植前治疗策略
MRD 状态提供了疾病对治疗反应的动态风险评估,移植前 MRD 状态是 allo-SCT 后复发的重要预后因素。移植前存在许多评估 MRD 的方法:适当分子标志物(如NPM1)的 PCR 监测是一种灵敏的方法,而多参数流式细胞术 (MFC) 为无分子标志物的患者提供了一种广泛适用的方法。allo-SCT前可检测到 MRD 的患者复发风险增加,且最近的两项前瞻性研究中进一步证实移植前 MRD 的意义。这些研究不仅证实了移植前 MRD 的预后价值,也提供了对 MRD 基础生物学的见解,以及使用MRD 的方法。
移植前靶向治疗可改变接受 allo-SCT 治疗 FLT3 突变 AML 患者的MRD,在诱导化疗中加用midostaurin可改善总生存期,尤其是首次达到完全缓解 (CR1) 并接受 allo-SCT 的患者。同样,QuANTUM-First研究表明,在 allo-SCT 前 MRD 阳性的患者中,quizartinib带来的移植后生存获益最明显。
历史登记组数据未显示allo-SCT 前进行额外周期的强化疗有显著获益,但最近研究发现,继发性 AML 患者接受CPX-351诱导治疗与常规DA(7+3) 相比移植后结局改善。在 III 期前瞻性研究中,CPX-351的安全性特征与DA(7+3) 相似,而在 AML19 研究中,在新诊断为不良细胞遗传学 AML 或高危骨髓增生异常综合征 (MDS) 的年轻成人中比较 CPX-351 与FLAG-IDA,仅MDS 相关突变患者有移植后生存获益,表明可能仅高危 AML 患者可从增强诱导化疗中获益。
在不适合强化疗的≥75岁患者中,BCL2抑制剂维奈克拉(VEN)联合阿扎胞苷 (AZA)与AZA 单药相比可改善 CR/CRi率。大量接受 VEN/AZA 治疗的患者也达到MRD 阴性CR,且在 NPM1 突变 AML 的治疗中似乎特别有效。初步数据表明,VEN/AZA可克服fit成人中明显的 NPM1 复发并诱导深度缓解,从而允许后续allo-SCT。还探索了VEN/AZA联合FLT3 抑制剂(如吉瑞替尼和quizartinib),其中回顾性和前瞻性 I/II 期数据表明,在不适合接受强化疗的 FLT3 突变 AML 老年患者中,VEN/AZA具有较高的 CR 率和令人鼓舞的 MRD 阴性水平。回顾性数据支持 VEN/AZA 可成功用作 allo-SCT 桥接,移植后短期治疗结局似乎与≥60岁新诊断 AML 患者接受强化疗诱导后的结局相似。另外, VEN 联合强化疗方案(如 DA 或FLAG-IDA)也报告了较高的 CR 率和令人印象深刻的 MRD 清除率,证实可在移植前优化常规诱导化疗策略。这些方案还需要前瞻性验证,以了解fit成人患者 VEN/AZA 治疗与传统诱导化疗方案相比的移植后结局,正如美国一项重要随机研究指正在做的 (NCT04801797)。
总体而言,移植前联合治疗对长期生存的影响尚不清楚,需要进一步的随访数据,也需要进一步的随机试验来阐明移植前的更多治疗是否可改善中危以及高危患者的结局。其他重要问题还包括,精准识别哪些无 MRD 标志物的患者可获益于额外的移植前治疗或移植后维持治疗,以及 allo-SCT在中危 AML 患者中的作用(他们可获益于移植前联合策略)。
移植物来源对移植后复发的影响
无相合同胞供者的供者选择越来越多。相合良好(8/8或10/10)无关供者与相合同胞供者的临床结局接近,HLA分子学相合的细化也提高了对HLA-DPB1“允许性不相合(permissive mismatching)”潜在临床获益的理解,目的是在不增加 GVHD 风险的情况下增强 GVL 效应。
多项回顾性研究评估了相合同胞或无关供者allo-SCT 后去除 T 细胞 (TCD) 作为 GVHD 预防对 AML 复发风险的影响。一项大型登记组分析发现,无论 AML 患者移植前的 MRD 状态如何,ATG均不会增加 AML 患者的复发率。同样,在 RIC 背景下使用体内alemtuzumab也不是复发的独立风险因素,而移植后高水平的环孢素是风险因素。在清髓性移植时,使用 CD34 选择性移植物的体外 TCD 不会增加 CR1 患者接受 allo-SCT 后的复发风险,但具有高危特征的患者结局明显较差。最近的前瞻性研究表明,使用 ATG 或阿巴西普作为体内 TCD 可改善重度GVHD,同时不会增加复发率。后置环磷酰胺 (PTCY) 作为一种有效的 GVHD 预防方法的出现,显著改善了采用半相合供者移植的高危 AML 患者的结局。采用 PTCY 的半相合 allo-SCT 甚至可以克服继发性 AML 的不良预后,与半相合 allo-SCT 治疗原发性AML 的复发率相当。对于相合无关供者异基因 SCT,PTCY 与基于钙调磷酸酶的 GVHD 预防的疾病复发率也相似。对于大多数儿童患者,半相合供者最有可能是孩子的母亲或父亲,患者暴露于非遗传性母体抗原 (non-inherited maternal antigen,NIMA) 可能会增强 GVL 效应,并且在母体而非父系单倍体相合供体中观察到复发(和非复发)死亡率降低。对于成人患者,可考虑兄弟姐妹和子女,并且在非去 T 细胞(T-replete)单倍体 SCT 联合 PTCY 的情况下,优于亲代供者,但 NIMA 的免疫作用或非遗传性父系抗原 (non-inherited paternal antigen,NIPA) 不匹配对结局的影响仍不清楚,父亲是首选亲代供者。
同样,鉴于脐带登记处的扩展,以及非去 T 细胞脐带移植平台在脐血allo-SCT 治疗儿科髓系疾病中的强效 GVL 效应,从而扩大了高危 AML 患者替代供者库的潜力。BMT CTN 1101研究报告了接受半相合或脐带移植物 allo-SCT 的成人患者的复发率相同,但研究并非针对AML,且采用目前未使用的预处理方案。回顾性数据集表明,脐带血移植CR1 AML 患者的复发率较低,以及移植前 MRD 极具重要性,但未来需要随机试验验证。虽然需要更多的数据来确定替代供者来源在AML 复发预防方面的优先性,但对于缺乏相合同胞或10/10(8/8) 非亲缘供者的患者,替代方案的可用性增加仍具有重要的实际意义,意味着大多数合格患者现在可以考虑进行allo-SCT。
人们对移植物衍生效应细胞对 allo-SCT 后复发风险的影响越来越感兴趣,并且干细胞移植物中高剂量的 NK 细胞可显著降低相合同胞或相合无关供者移植的复发率。因此,优化去除 T 细胞策略和干细胞袋(stem cell bag)组成或可改善 AML allo-SCT 后的复发和非复发死亡率。
优化预处理方案以预防复发
BMT-CTN 0901 研究解决了关于在 CR1 中接受 allo-SCT 治疗 AML 的患者中选择清髓性 (MAC) 还是RIC 方案的重要问题。MAC组的无事件生存率和总生存率均有所改善;MAC组的复发率异常低,而RIC 组具有高复发率。重要的是,与接受 RIC 方案的患者相比,移植前 MRD 阳性患者在 MAC 方案后的生存率显著改善;而移植前 MRD 阴性的患者中未观察到获益。因此,在 CR1 的年轻fit患者选择 MAC 方案似乎是合理的,尤其是在移植前MRD 阳性的情况下。然而,对于占大多数的、无法耐受 MAC 方案的患者,最佳预处理方案仍不清楚。许多氟达拉滨为基础的 RIC 方案较为常用,包括氟达拉滨联合白消安 (FB2) 和美法仑 (FM)。最近一项研究中,氟达拉滨/treosulfan耐受性良好,具有良好结局。
“序贯预处理”也得以探索,即在标准RIC之前给予额外化疗。Malard et al.回顾性研究了 FLAMSA-BU 方案(氟达拉滨、amsacrine、阿糖胞苷和白消安)额外化疗的影响,降低了高危 AML 中疾病复发。英国 FIGARO 研究将患者随机分配至标准 RIC 方案或 FLAMSA-BU 序贯方案,但即使在移植前 MRD 阳性患者中也未发现生存优势。因此,开发创新且可耐受的 RIC 方案(低疾病复发风险)仍是当务之急,已招募完成的 COSI 研究旨在研究将塞替派并入FB2 方案是否可改善移植结局。
用靶向治疗增强移植预处理方案是另一个重要的新兴关注领域。在 MAC 或 RIC 移植平台中添加 VEN 似乎是安全的,对植入率没有不利影响,并且早期数据令人鼓舞。在 FLT3-ITD 突变 AML 异基因移植患者中,索拉非尼联合分次清髓性预处理可耐受。在非清髓性背景中,添加 CD117 靶向单克隆抗体 JSP191 似乎是安全的,导致高水平的供者干细胞植入,而在复发性或难治性 AML 患者中,正在进行的 SIERRA 研究正在检查I-labelled抗 CD45 单克隆抗体联合非清髓性氟达拉滨/低剂量 TBI 预处理方案。总体而言,这些研究证明了联合预处理方案的可行性,但需要更大型、随访时间更长的前瞻性研究来改变当前实践。
优化移植后GVL效应
经典的移植后异基因免疫应答是由供者 T 细胞所介导,免疫生物学的进展导致开发了一系列预防疾病复发的治疗靶点。早期异基因免疫应答的重要证据,不仅来自移植后免疫抑制强度与复发风险的关联,但也得到以下结果的支持:在因骨髓增生异常而接受异基因 SCT 的患者中,移植后30天持续存在疾病相关突变与疾病复发风险增加相关。同样,多项回顾性和前瞻性研究中已证明,极早期获得完全供者嵌合体似乎可预防各种髓系疾病的复发。由患者和供者来源Treg 维持的早期混合嵌合体可抑制异基因免疫应答,降低 GVHD 风险,但会增加复发。与之相反,早期输注供者来源 Treg 似乎可有效限制移植物抗宿主病,而不会增加疾病复发。
在体内去除 T 细胞 allo-SCT中,移植后14天即可在供者CD8+ T细胞中检测出复发相关基因标签,检查点分子 CD94(NKG2A) 的高表达和CD8+ T细胞上激活剂分子 CD96(TACTILE) 的低表达与复发风险增加4.7倍和2.2倍相关。CD94通常由 NK 细胞、活化αβCD8+ T细胞、γδ-T细胞和 NK T 细胞表达,而 monalizumab可结合CD94/NKG2A。一项 I 期研究表明,monalizumab在 allo-HSCT 后2个月是安全的,正在进行的 II 期研究的结果有待等待。该研究的原理是基于 CD94(NKG2A) 通常被认为是 NK 细胞检查点轴,NK细胞是 allo-SCT 后前几周内重建淋巴细胞的主要细胞,并且在 AML 中产生功能障碍 NK 细胞。白血病干细胞也可降低NKG2D 配体的表达,allo-SCT后复发与 NK 细胞靶点及 HLA减少相关。除 CD94 轴外,还发现 allo-SCT 后14天可检测到的CD70+ CD8+ T细胞是异基因反应性记忆T细胞,可进入组织并引起急性GVHD。CD70也被 AML 原始细胞表达,因此可能是早期预防 GVHD 和疾病复发的理想靶点。CD70单克隆抗体 cusatuzumab 已被证明是安全的,并且在AML早期研究中具有令人鼓舞的抗白血病疗效。
GVL 效应的免疫机制的深入了解,导致一系列增强异基因免疫应答的免疫方法。理想情况下,这些药物可靶向 AML 特异性突变产生的白血病特异性抗原。然而,虽然部分易位(AML1-ETO、PML-RARA和 BCR-ABL)和功能获得性突变(FLT3-ITD、NPM1和IDH1/2)可产生此类抗原,但AML是其中突变负荷最低的肿瘤。AML的谱系限制性抗原包括CD33、CD123和NKGD2,但健康组织也存在这些表位,从而增加靶向免疫治疗引起的潜在损伤。因此,人们对改善移植结局的药物和细胞治疗策略兴趣愈加浓厚。
AIlo-SCT后的药物维持治疗
移植后维持治疗正在成为降低移植后复发风险的重要措施,可通过靶向残留白血病、为产生具有临床意义的 GVL 效应争取时间或通过增强异基因反应性来减少复发,例如去甲基化药物(如 AZA 和地西他滨)就很有吸引力。许多回顾性研究已经证明,即使采用减量给药方案,两药在移植后均耐受良好。最近的一项前瞻性随机研究未显示移植后 AZA 皮下给药的生存获益,但许多患者的给药持续时间较短。基于英国的随机 AMADEUS 研究(使用耐受性良好的 AZA 口服制剂CC486)的结果值得等待,可能有助于确定最佳治疗方案。
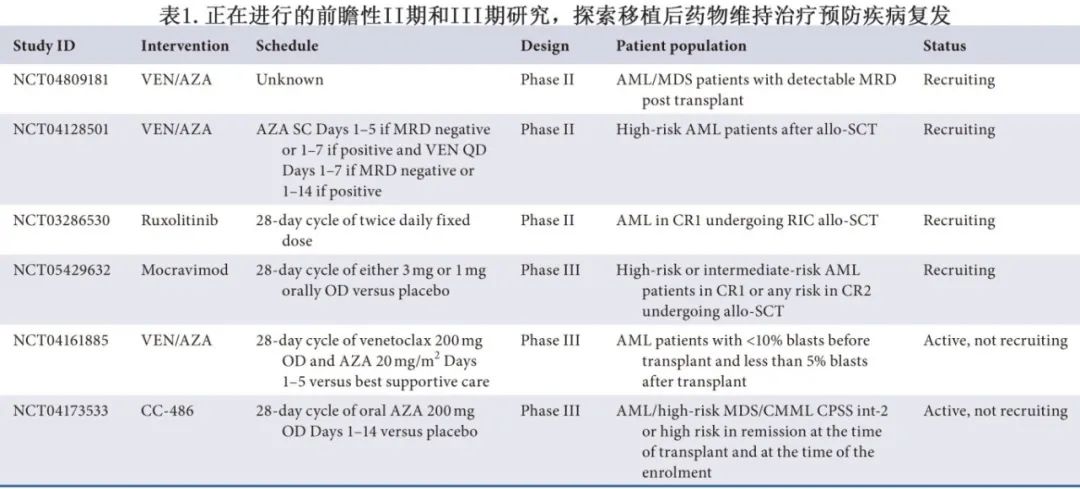
对于因 FLT3 突变 AML 而接受 allo-SCT 的患者,移植后维持治疗对结局的改善尤为明显。它们容易快速复发,而许多新型 FLT3 抑制剂已显示出作为移植后维持治疗的前景。两项随机研究已证实采用索拉非尼进行移植后维持治疗具有生存获益,MORPHO(BMT-CTN 1506) 研究的最终同行审评结果(吉瑞替尼维持)也即将发表,其2023年EHA摘要数据显示无复发生存期改善,具体而言就是在移植前MRD 阳性患者。还在使用 IDH1 抑制剂 enasidenib 探索药物维持策略,而使用 menin 抑制剂进行移植后维持也是一个越来越受到关注的领域。该领域的前瞻性研究应旨在确定以下问题:allo-SCT 前后 MRD 的预后价值、识别在无分子标志物的情况下可从维持治疗中获益的患者、维持策略对晚期并发症(如GVHD)的影响,以及何时可合理停止维持治疗。表1概述了正在进行的、移植后药物维持治疗预防疾病复发的 II 期和 III 期研究。
Allo-SCT后的细胞治疗策略
供者淋巴细胞输注 (DLI) 是预防 allo-SCT 后 AML 复发的常见细胞策略,通常在高危AML患者中预防性给药。虽然回顾性研究在预防 DLI 的时间和剂量方面存在差异,但移植后总生存期均延长,尤其是在高危和复发性/难治性 AML 中。这策略扩展到单倍体相合移植,但也伴随着 DLI 诱导GVHD(发生率33%)。支持预防性 DLI 的大多数数据是回顾性数据,因此英国前瞻性随机 PRO-DLI 研究 (NCT02856464) 的结果值得期待,可能会改变实践。
抢先 DLI 可用于预防(完全供者嵌合体缺失或 MRD预示的)马上的复发。其证据主要是回顾性,但在各种血液恶性肿瘤中进行的一项大型前瞻性研究表明,疾病复发率显著降低。这在两项专门针对 AML的研究中也得到证实,其中混合嵌合体和 MRD 触发抢先DLI。
预防性DLI和抢先DLI治疗的潜在获益必须考虑伴随毒性(即GVHD),其中急性和慢性 GVHD 的发生率分别约为12%和31%。
修饰 DLI 细胞组成以增加其疗效并降低 GVHD 风险的方法包括:Treg 细胞耗竭、记忆 T 细胞富集、离体活化或细胞因子诱导 DLI 预输注,以及联合其他靶向治疗(如索拉非尼和VEN)。
抢先DLI 的未来前瞻性研究将获益于移植后 MRD 和嵌合体监测方法和标准的协调一致,并且可能需要协作网络来招募有意义的患者数量。基因和细胞的实现工程学也有望开发出令人兴奋的新细胞疗法来调节或重现 GVL 反应,但它们尚不容易实现。
总结
疾病复发仍是 AML 异基因移植患者治疗失败的主要原因。诱导化疗及治疗移植前 MRD的发展有可能降低移植后复发的风险,还需要改善预处理方案的抗白血病活性,而不伴随增加毒性。最后,可能最有前景的方法为开发新药或移植后细胞干预,以最大化 GVL 效应。如果患者要从这些治疗选择中获益,需要加速开展嵌入 MRD 和基因组数据的高质量随机研究,并且研究加速模型(如美国 BMT CTN 和英国 IMPACT 移植试验网络)也将变得越来越重要。
参考文献
Kinsella FAM, Maroto MAL, Loke J, Craddock C. Strategies to reduce relapse risk in patients undergoing allogeneic stem cell transplantation for acute myeloid leukaemia. Br J Haematol. 2024;00:1–11. https://doi.org/10.1111/ bjh.19463