摘要
目的 替洛利生在治疗成人发作性睡病的有效性和安全性已在国外的临床试验中得到证实,但目前没有在中国患者应用的数据,本研究旨在替洛利生治疗中国成人发作性睡病患者的有效性和安全性。方法 本研究共纳入30例受试者,采用个体化滴定给药8周,每日单次给药。采用Epworth嗜睡量表(ESS)和日均猝倒次数(DCR)作为主要疗效标准,临床总体印象严重程度量表(CGI-S)和临床总体印象病情变化量表(CGI-C)作为次要疗效指标,安全性指标包括不良事件(AE)记录和实验室检查。结果 结果显示用药后ESS评分和猝倒次数与基线期相比均有明显改善。至治疗结束时,ESS评分相较基线下降了(7.63±4.79)分(P<0.001)。受试者基线日均猝倒次数为0.83次,接受替洛利生治疗3周和5周的日均猝倒频率为(0.39±0.82)和(0.38±0.79)相较于基线的下降是显著的(P<0.05)。治疗结束后,日间过度思睡(EDS)的CGI-S评分中位数由基线时“严重”改善为“轻微”(P<0.001),猝倒的CGI-S评分由基线时“轻微”改善为基本“正常”(P<0.001)。绝大多数AE均为轻度且未采取任何药物治疗,其他用于监测受试者一般情况的化验指标在治疗前后也没有统计学差异。结论 替洛利生治疗中国成人发作性睡病的日间过度思睡和猝倒具有较好的有效性和安全性。
发作性睡病(narcolepsy)作为一种罕见的慢性神经系统疾病,其特征是睡眠-觉醒维持困难。日间过度思睡(excessive daytime sleepiness,EDS)和猝倒是发作性睡病的核心症状,EDS的典型特征是反复发作无法控制的困倦感,猝倒是指突然、短暂的肌张力丧失,通常是由情绪诱发。还有部分患者会出现睡眠幻觉、睡眠瘫痪等快速眼球运动睡眠期调节障碍表现。发作性睡病发病率在0.02%~0.05%,是国际公认的罕见病,中国也在2023年9月18日将发作性睡病纳入第二批罕见病目录中。
发作性睡病患者的药物治疗旨在减少EDS、猝倒、睡眠幻觉和睡眠瘫痪,改善夜间睡眠中断。参与促进觉醒的各种神经递质(例如去甲肾上腺素、5-羟色胺、多巴胺、组胺)为药物干预提供了多个靶点。目前的治疗药物作用主要的神经递质是增加多巴和GABA的浓度,而这一类的药物都有成瘾和依赖的风险。
替洛利生(pitolisant)作为一种H3受体反向激动剂,可以干扰H3受体信号传导,阻断其抑制作用,增加脑内组胺以及5-羟色胺、去甲肾上腺素、多巴胺和其他神经递质的水平,从而促进觉醒。2016年替洛利生获欧洲药品管理局(EMA)批准用于治疗伴有或不伴有猝倒的成人发作性睡病,2018年被美国食品和药物管理局(FDA)认定为发作性睡病的突破性治疗药物,并于2019年和2020年分别被FDA批准用于治疗成人发作性睡病患者的EDS和猝倒症状。《中国发作性睡病诊断与治疗指南(2022版)》推荐替洛利生作为治疗EDS的首选药物(Ⅰ级推荐,A级证据)和治疗猝倒的常用药物(Ⅰ级推荐,A级证据)。因此,本研究通过在中国大陆纳入1型或2型发作性睡病患者,评估替洛利生治疗中国成人发作性睡病患者的安全性和耐受性,并评估替洛利生在治疗发作性睡病EDS和猝倒等症状的有效性。
1 资料与方法
1.1 实验方案
本研究采用开放、单臂的观察性研究方法,项目于2021年8月获得了海南省人民医院伦理委员会的批准。所有受试者被告知项目的真实目的,可自主选择是否同意参加本项目,在入组之前需签署项目告知书及保险授权书。
1.2 研究人群
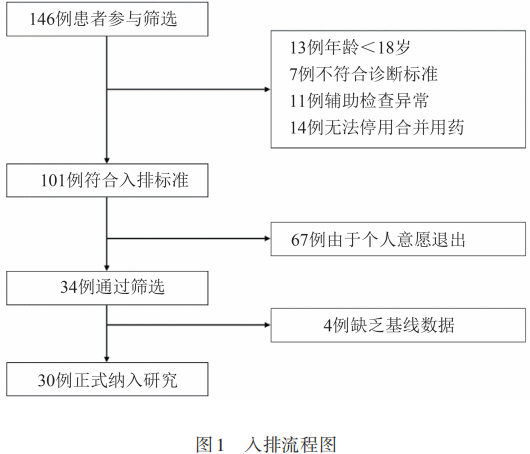
2021年5月1日—2022年8月30日共有146例患者参与了本项目筛选。对登记的受试者进行入选和排除标准的筛查。所有纳入研究的受试者必须满足ICSD-3中发作性睡病1型和2型的诊断标准,并且入组时Epworth嗜睡量表(ESS)评分应≥14分。在基线访视前至少14 d内受试者应停止接受精神兴奋剂和镇静药物,或三环类抗抑郁药治疗。有重度猝倒的受试者可使用除三环类抗抑郁药以外的抗猝倒治疗,但需要在入组前该治疗已稳定剂量使用至少1个月,且在整个研究期间保持该剂量不变。146例患者中有13例由于年龄<18岁,7例不符合诊断标准,11例存在辅助检查异常,14例无法停用合并药物,67例由于个人意愿退出研究,最后共有34例受试者通过筛选。最初4例患者在筛选时尚未获得本项目伦理委员会批准,且缺乏基线ESS评分等基线数据而未纳入分析。最终纳入分析的受试者共30名(见图1)。
1.3 给药方法
对30名受试者进行基线数据采集后开始接受替洛利生治疗,前3周为灵活剂量滴定到最佳剂量后,稳定剂量持续给药5周,共治疗8周。替洛利生在早晨随早餐单次服用,1次/d,服用剂量采用向上滴定,根据个体的反应和耐受性使用最低有效剂量,最大有效剂量不得超过36 mg/d(见图2)。
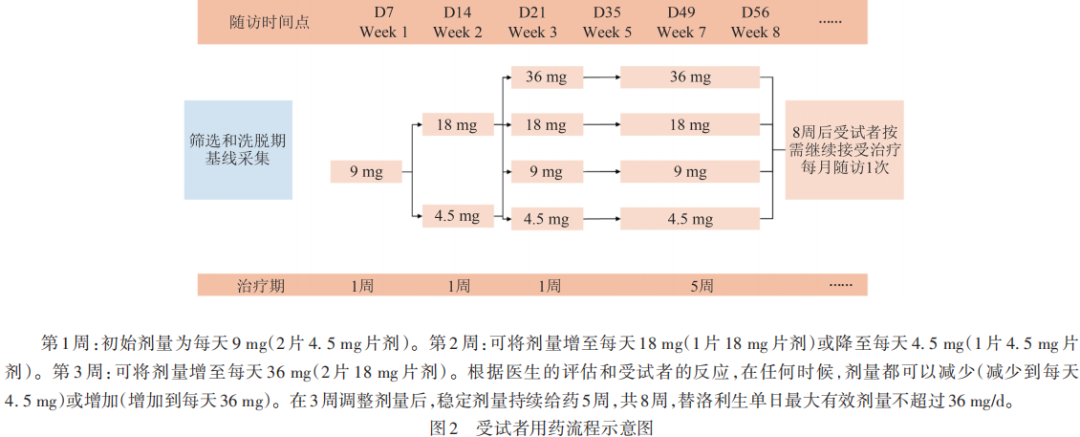
在试验过程中,临床医生根据受试者对药物的反应调整了用药剂量。其中11例受试者在(D15~D16)采用27 mg/d作为18 mg/d~36 mg/d剂量之间的过渡,1例受试者2次服用22.5 mg/d(D8及D9),1例受试者4次服用13.5 mg/d(D13~D16),1例受试者以27 mg/d完成最后3周治疗(W1066、D36~D56),其他日期均按照以上方案执行。
从剂量递增访视到末次访视期间(D15~D56)接受相同药物剂量的受试者定义为接受稳定剂量替洛利生的受试者,30例受试者中,最后6周内20例受试者以40 mg的稳定剂量治疗,其中10例受试者在D15及D16遵医嘱服用27 mg/d,1例受试者因COVID-19管控断药1 d(D32),1例受试者因感冒自行停药1 d(D51)。1例受试者以18 mg的稳定剂量治疗。
1.4 疗效性及安全性评估
主要疗效指标为使用ESS问卷评估受试者的嗜睡情况。计算关于ESS的应答率,当ESS末次评分不超过10或较基线改变≥3时,认为受试者对治疗有应答。受试者的猝倒次数通过睡眠日记以电子问卷的形式收集。要求受试者每天早晨起床后记录前1晚的睡眠日记,每次评估涵盖的时间段为24 h。在计划访视的前7 d记录猝倒发作的次数以确定猝倒发作频率。次要疗效分析指标使用研究者评估的临床总体印象严重程度量表(Clinical Global Impression of Severity,CGI-S)和临床总体印象病情变化量表(Clinical Global Impression of Change,CGI-C)来测定EDS和猝倒的严重程度。安全性指标评估是通过记录不良事件,比较治疗结束期和基线的实验室检查参数。在本试验中,于筛选时和D56访视中对受试者进行了实验室评估,包括血常规、血生化等。因为受到COVID-19疫情的影响,仅有部分受试者完成了D56的实验室评估。另外,由于各医院的实验室检测差异,个别指标数值可能存在缺失。
1.5 统计学分析
采用SPSS 23.0软件进行统计学分析,符合正态分布的计量资料采用(x±s)表示,不符合正态分布的计量资料采用中位数(四分位数)[M(P25,P75)]表示。计量资料采用例数和百分比表示。使用t检验进行符合正态分布的组间比较,使用Wilcoxon检验进行不符合正态分布的组间比较,取P<0.05时有统计学意义。对于在D56时没有ESS评分的受试者,ESSF为末次观察值结转值。对于次要终点的缺失数据不予填补。若发作性睡病确诊日期有缺失,如果年份和月份已知,则使用已知月份的第1天(-01)进行填补。如果只有年份已知,则使用已知年份的1月份第1天(01-01)进行填补。
2 结 果
2.1 人口学特征
本研究共纳入分析30例发作性睡病受试者,其中男性23例(76.67%),女性7例(23.33%)。30例受试者的年龄最小20岁,最大54岁,中位年龄为27岁,平均身高为172.53 cm,平均体重为82.43 kg,平均BMI为27.62 kg/m2。
按照中国肥胖工作组和中国糖尿病学会的定义,体质指数(body mass index,BMI)<18.5 kg/m2定义为体质量过低,18.5 kg/m2≤BMI<23.9 kg/m2定义为正常体质量,24.0 kg/m2<bmi<27.9 kg=m2定义为超重,BMI>28.0 kg/m2定义为肥胖。按照此标准,本项目中有50%的受试者超重(15/30),40%的受试者为肥胖(12/30)(见表1)。

2.2 基线临床特征分析
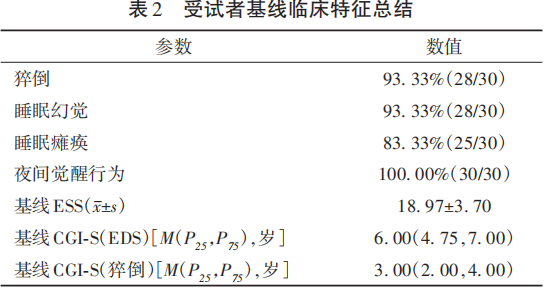
30例受试者中有28例诊断为1型发作性睡病(93.33%)。受试者从确诊发作性睡病到使用替洛利生的中位病程为32.68月(6.91~81.32),最短0.57月,最长244.43月。基线ESS、CGI-S(EDS)、CGI-S(猝倒)评分定义为填写入组申请表时的评分,其中,76.67%(23/30)受试者ESS评分达到重度日间过度思睡(ESS评分≥16分)。受试者出现典型发作性睡病临床症状及量表评分的具体数据见表2。
2.3 替洛利生治疗发作性睡病的疗效评估
2.3.1 替洛利生治疗日间思睡的疗效
2.3.1.1 ESS评分及应答率
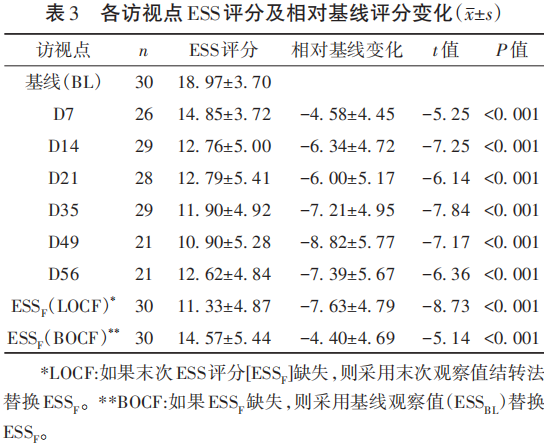
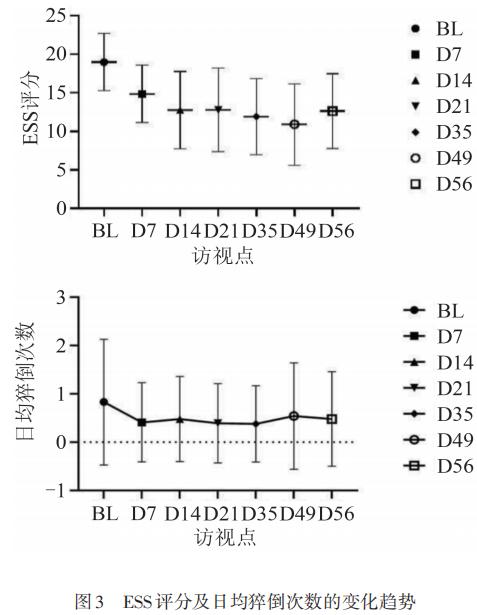
受试者接受替洛利生治疗后,2周内ESS评分显著降低,此后持续稳定,与基线相比,各访视点ESS评分相较于基线的差异均有显著变化(P<0.001),至治疗结束时(D56),ESS评分相较基线下降了(-7.63±4.79)分,具体数值和变化趋势(见表3、图3)。
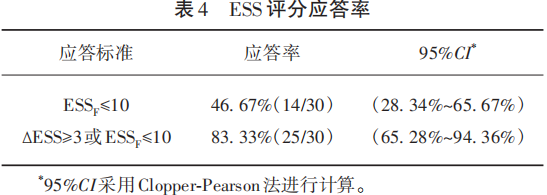
分别采用两种标准计算ESS应答率,若①ESSF(末次ESS评分)≤10或②∆ESS≥3或ESSF≤10,将受试者视为应答者,ESS应答率(见表4)。
2.3.1.2 CGI-S和CGI-C评估EDS
在基线时,使用 CGI-S 问卷评估 EDS 的严重程度。不同严重程度对应的评分如下:0=未评估;1=正常,没有生病的迹象;2=非常轻微;3=轻微;4=中度;5=重度;6=严重;7=极其严重。基线CGI-S 评分为6.00(4.75,7.00),D56 时CGI-S评分为3.00(2.00,4.00)。经过8周替洛利生治疗后,EDS严重程度中位数由基线时 “严重”改善为“轻微”。治疗前后CGI-S评分具有统计学差异(P<0.001)(见图4)。

通过CGI-C分析EDS的变化,结果显示替洛利生治疗7 d时,受试者获得改善(即,报告的EDS为“显著改善”“改善”或“稍改善”)的受试者比例为76.92%(20/26),治疗56 d时,获得改善的受试者比例为85.71%(18/21)。以上结果与在主要终点观察到的结果一致,即在日常生活的常见情况下,使用替洛利生治疗可改善日间思睡。
2.3.2 替洛利生治疗猝倒的疗效
2.3.2.1 日均猝倒次数
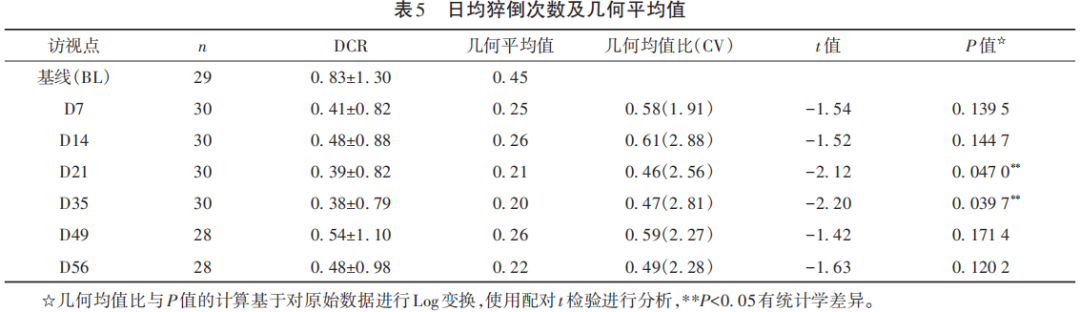
通过睡眠日记得到的受试者基线日均猝倒次数为0.83次,经过替洛利生治疗1周后下降至0.41次,降幅达到50.60%。22例受试者在筛选期及接受8周替洛利生治疗过程中至少有1次猝倒发作。对这些受试者基线及治疗过程中的猝倒发作次数计算几何平均值。对发作次数为0时按0.5/d数进行填补。日均猝倒率几何平均值相较基线均有下降,其中接受替洛利生治疗3周和5周(D21、D35)的日均猝倒率相较于基线的下降是显著的(P<0.05)。其他各访视日均猝倒次数、日均猝倒次数几何平均值和趋势(见表5、图3)。
2.3.2.2 CGI-S和CGI-C评估猝倒
对入组时报告有猝倒发作的28例受试者进行CGI-S和CGI-C评估猝倒症状的改善程度。在基线时,使用 CGI-S 量表评估的猝倒严重程度。基线CGI-S评分为3.00(2.00,4.00)。D56时CGI-S评分为1.00(1.00,2.00)。经过8周替洛利生治疗,猝倒严重程度由基线时“轻微”改善为基本“正常”。治疗前后CGI-S评分具有统计学差异(P<0.001)(见图4)。
CGI-C评分结果显示替洛利生治疗7 d时,受试者获得改善(即,报告的猝倒为“显著改善”“改善”或“稍改善”)的比例为67.86%(19/28),治疗56 d时,获得改善的受试者比例为69.23%(18/26)。以上结果与在主要终点观察到的结果一致,使用替洛利生治疗可改善猝倒发作。
2.3.3 不良事件(AE)及实验室检查指标
2.3.3.1 不良事件记录
在接受替洛利生用药的所有30例受试者中,共有8例(26.7%)受试者报告了18例次AE。在本项目中报告的所有AE均被评价为与替洛利生可能有关或很可能有关。所有受试者均未报告严重不良事件(SAE)。按照系统器官分类(SOC)和首选术语(PT)显示。
按照SOC分类,最常见(≥2例受试者报告)的SOC为“精神病类”,共有6例(20.0%)受试者报告6例次AE,包括中间易醒型失眠和失眠;其次为SOC“各类神经系统疾病”,共有3例(10.0%)受试者报告5例次AE,包括头痛、头晕和感觉减退;其余SOC均仅有1例(3.3%)受试者报告。
按照PT分类,最常见的PT为“中间易醒型失眠”,共有5例(16.7%)受试者报告5例次;其次为 “头痛”和“头晕”,分别各有2例受试者(6.7%)报告2例次;其余PT均仅有1例(3.3%)受试者报告1例次。
最终经评估,所有AE中,除1例(3.3%)受试者的肝酶升高,AE为中度并停药接受了药物治疗外,其余AE均为轻度,未采取任何药物治疗。
2.3.3.2 治疗前后实验室检查指标评估
各个实验室参数正常(在正常值范围内)和异常(超出正常值范围)的受试者比例分析。大多数受试者在研究期间的实验室检查值都在正常范围内,且异常值都与基线病史、合并疾病等有关。治疗前后指标的改变没有统计学意义。
3 讨 论
发作性睡病(narcolepsy)作为一种罕见的慢性神经系统疾病,好发于儿童青少年,高峰发病年龄在10~15岁,呈双高峰现象,男女发病比例相当。典型的症状包括EDS、猝倒、睡眠幻觉、睡眠瘫痪和夜间睡眠紊乱。发作性睡病有两种类型:1型发作性睡病(narcolepsy type 1,NT1) (伴有猝倒发作和/或脑脊液食欲素水平低)和2型发作性睡病(narcolepsy type 2,NT2)[不伴有猝倒和(或)脑脊液食欲素水平无减低]。目前认为NT1的发病机制可能是由激活免疫通路的遗传因素(如HLA-DQB1*06:02)和环境因素(如感染)导致的下丘脑外侧分泌食欲素的神经元选择性丧失引起,而NT2的病理生理学尚不太清楚。
美国食品和药物管理局(FDA)批准用于治疗成人发作性睡病EDS的药物包括传统兴奋剂(如安非他明、哌甲酯)、促醒药(如莫达非尼、阿莫达非尼)、多巴胺和去甲肾上腺素再摄取抑制剂(索安非托)等。此外,选择性5-羟色胺再摄取抑制剂(SSRIs)、5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs)等抗抑郁药也被超说明书范围使用。由于猝倒、睡眠瘫痪和睡眠幻觉都是REM睡眠调节障碍的表现,所以对猝倒有效的药物也有望减轻其他REM睡眠相关症状。然而,迄今来自对照临床试验的确证性数据有限。多巴胺是一种促觉醒的神经递质,传统兴奋剂和促醒药,例如安非他明和莫达非尼,是通过增加多巴胺的突触浓度来促进觉醒的。索安非托是一种多巴胺和去甲肾上腺素再摄取抑制剂,其治疗发作性睡病患者的EDS的疗效已经得到证实,然而其对猝倒似乎没有明显的改善。由于多巴胺也参与其他的行为和心理过程,例如动机和奖励,可能会导致促醒之外的辅助作用:药物滥用和成瘾。去甲肾上腺素和5-羟色胺参与猝倒的发生机制,因此抗抑郁药如TCAs、SSRIs和SNRIs常被超说明书范围使用,但这一治疗方案缺乏大型临床试验证实,且停药可能会导致反跳性的猝倒。综上所述,一方面,目前缺乏同时对EDS和猝倒均有显著改善的药物;另一方面,传统的发作性睡病治疗药物均存在自己的短板。因此,发作性睡病的药物治疗亟待探索。
组胺是一种单胺类信号分子。在大脑中,组胺主要是作为促进觉醒以及抑制快眼动睡眠的神经递质发挥功能。在大脑中,结节乳头体核(TMN)是脑组织中组胺的唯一神经源性的来源。组胺可以通过四种不同的G蛋白耦联受体(H1-H4)发挥作用,其中H1、H2以及H3受体都在脑组织中表达。H3受体是一种一致性的自身受体。当组胺水平增高时,组胺可以与结节乳头体核神经元的H3受体相结合,使这些细胞超极化并降低这些细胞的活性。H3受体也在多种神经元上表达异种受体,包括制造多巴胺、5-羟色胺、去甲肾上腺素、乙酰胆碱、GABA以及谷氨酸能神经元。H3受体目前已经成为治疗发作性睡病的新的药物靶点。
替洛利生(pitolisant)作为一种H3受体反向激动剂,可以干扰H3受体信号传导,阻断其抑制作用,增加脑内组胺以及5-羟色胺、去甲肾上腺素、多巴胺和其他神经递质的水平,从而促进觉醒。在缺乏食欲素的小鼠中,替洛利生增加了觉醒,减少了NREM睡眠,并且减少了猝倒。在随机安慰剂对照试验(RCT)中,替洛利生对减少成人发作性睡病患者EDS和猝倒的疗效也得到了证实。
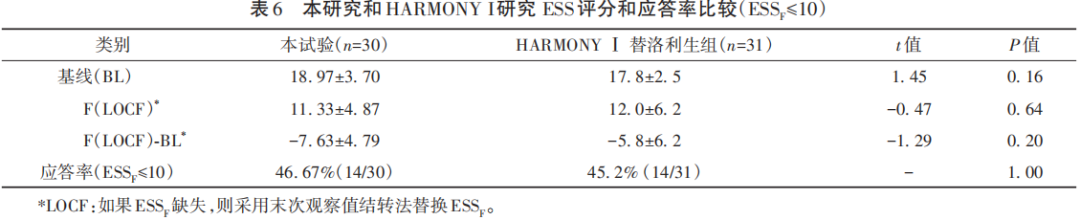
在本试验中,ESS评作为主要观察的疗效指标,受试者在接受替洛利生治疗后ESS评分较基线评分有了明显改善(P<0.001),同样的结果也出现在睡眠日记记录的猝倒发生频率中。次要疗效观察指标CGI-S和CGI-C评分呈现出同样的趋势。全球关键研究HARMONY Ⅰ期中也将ESS评分作为主要观察指标。与HARMONY Ⅰ期相比,本试验在基线、治疗结束(F)和△ESS(FLOCF-BL)方面均无显著区别。HARMONY Ⅰ期研究中采用ESSF≤10计算患者应答率,替洛利生治疗组中有45.2%患者为应答者。使用相同标准时,本项目患者应答率为46.67%。采用Fisher精确检验验证本研究与HARMONY Ⅰ期在应答率(ESSF≤10)方面的差异时,没有显著区别,表明替洛利生在中国发作性睡病患者中降低发作性睡病EDS方面的疗效与全球关键临床研究趋势一致,具体比较见表6。
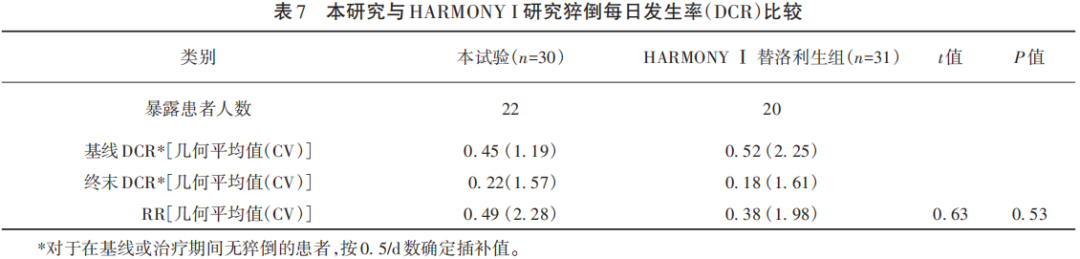
通过对睡眠日记记录的受试者发生猝倒的频率进行评估,本试验和HARMONY Ⅰ期研究中分别有22例和20例患者在筛选期及接受8周替洛利生治疗过程中至少有1次猝倒发作,针对这些患者睡眠日记中记录的猝倒频率进行评估,根据患者猝倒次数的终末/基线的比值(rate ratio,RR)的几何均值和CV,经Log转换后采用t检验计算,本试验得到的比值比与HARMONY Ⅰ期研究相比未见显著区别(P=0.53),说明替洛利生在控制患者猝倒方面与全球关键研究未见显著差异(见表7)。
从安全性角度来看,所有30例患者中有8例(26.7%)患者报告了18例次AE。最常见(≥2例患者报告)的AE为失眠、头痛和头晕,未发生严重不良事件或死亡。仅1例(3.3%)患者因AE而导致停用药物。基线和D56访视的临床实验室数据结果未见重要的安全性发现。总体来看,替洛利生的耐受性良好,观察到的安全性结果与替洛利生已知的安全性特征象一致。HARMONY Ⅰ期研究中与替洛利生相关的不良反应发生率在治疗的前几周最高,并随着时间的推移而下降。值得注意的是,HARMONY Ⅰ期研究中只有1例接受替洛利生治疗的患者因AE退出研究。这一发现表明,停药并不能解释AE频率随时间推移的减少,提示副作用可能通过继续治疗而缓解。
由于本试验与HARMONY Ⅰ期研究的持续时间相对较短(即3个月),不能排除继续用药后可能出现耐受性和新的治疗紧急不良事件。但是HARMONY Ⅲ期临床研究在真实世界环境和自然条件下进行了为期12个月的前瞻性纵向随访,以评估使用替洛利生的长期安全性和有效性。HARMONY Ⅲ期研究的主要目的是确认在真实生活条件下,在有或无猝倒的成人发作性睡病患者中使用替洛利生的长期安全性,结果显示,替洛利生长期疗效稳定,具有良好的耐受性和安全性,在这项现实的研究中,替洛利生单药治疗或联合治疗患者的不良事件发生率在前3个月内最高,这表明医生和患者在前3个月内应更加关注不良事件的发生。同时,长期使用替洛利生能显著降低Epworth嗜睡量表(ESS)评分和显著改善猝倒发作。日间思睡的最大改善在第6个月时出现,有1/3的受试者在使用替洛利生后日间思睡恢复到正常(ESS<10分)。猝倒的改善也十分显著,在治疗12个月后,每日发生部分性和全身性猝倒的频率都下降了65%和76%。同样的改善也发生在睡眠幻觉和睡眠瘫痪症状中。同时,替洛利生不会刺激与药物滥用有关的伏隔核多巴胺的释放,因此不会出现药物滥用及戒断症。因此,替洛利生已经成为发作性睡病患者安全、有效的治疗新选择。
本研究证实了替洛利生对中国发作性睡病患者的两大症状:日间过度思睡和猝倒发作均有明显改善作用,耐受性总体良好,并且观察到研究结果与全球关键临床研究HARMONY Ⅰ期治疗趋势一致的有效性和安全性,进一步证实了替洛利生在治疗发作性睡病患者的强大能力。
参考文献
[1]Bassetti CLA,Adamantidis A,Burdakov D,et al. Narcolepsy-clinical spectrum,aetiopathophysiology,diagnosis and treatment [J]. Nat Rev Neurol, 2019, 15(9):519-539.
[2]王梦云, 张红菊. 发作性睡病伴快速眼动睡眠行为障碍的相关性研究进展 [J]. 中风与神经疾病杂志, 2023, 40(3):232-234.
[3]Zhan S, Ye H,Li N,et al. Comparative efficacy and safety of multiple wake-promoting agents for the treatment of excessive daytime sleepiness in narcolepsy:a network meta-analysis [J]. Nat Sci Sleep, 2023, 15:217-230.
[4]Flik G, Folgering JH, Cremers TI, et al. Interaction between brain histamine and serotonin,norepinephrine,and dopamine systems:in vivo microdialysis and electrophysiology study [J]. J Mol Neurosci, 2015, 56(2):320-328.
[5]Meskill GJ,Davis CW, Zarycranski D,et al. Clinical impact of pitolisant on excessive daytime sleepiness and cataplexy in adults with narcolepsy:an analysis of randomized placebo-controlled trials [J]. CNS Drugs,2022,36(1):61-69.
[6]中华医学会神经病学分会睡眠障碍学组. 中国发作性睡病诊断与治疗指南(2022版)[J]. 中华神经科杂志, 2022, 55(5):406-420.
[7]Scammell TE. Narcolepsy [J]. N Engl J Med, 2015, 373(27):2654-2662.
[8]张益萌, 詹淑琴. 食欲素及多功能生理作用研究进展 [J]. 中风与神经疾病杂志, 2020, 37(11):1043-1047.
[9]Mahoney CE, Cogswell A, Koralnik IJ, et al. The neurobiological basis of narcolepsy [J]. Nat Rev Neurosci, 2019, 20(2):83-93.
[10]Thorpy MJ, Bogan RK. Update on the pharmacologic management of narcolepsy:mechanisms of action and clinical implications [J]. Sleep Med, 2020, 68:97-109.
[11]程岳阳, 詹淑琴. 再认识快速眼球运动睡眠及相关谱系疾病 [J]. 中风与神经疾病杂志, 2022, 39(3):215-220.
[12]Baladi MG, Forster MJ, Gatch MB, et al. Characterization of the Neurochemical and Behavioral Effects of Solriamfetol (JZP-110), a Selective Dopamine and Norepinephrine Reuptake Inhibitor [J]. J Pharmacol Exp Ther, 2018, 366(2):367-376.
[13]Vignatelli L, D'Alessandro R, Candelise L. Antidepressant drugs for narcolepsy [J]. Cochrane Database Syst Rev, 2008, 2008(1):CD003724.
[14]Haas HL, Sergeeva OA, Selbach O. Histamine in the nervous system [J]. Physiol Rev, 2008, 88(3):1183-1241.
[15]Schlicker E, Kathmann M. Role of the Histamine H(3) Receptor in the Central Nervous System [J]. Handb Exp Pharmacol, 2017, 241:277-299.
[16]Lamb YN. Pitolisant:A Review in Narcolepsy with or without Cataplexy [J]. CNS Drugs, 2020, 34(2):207-218.
[17]Lin JS, Dauvilliers Y, Arnulf I, et al. An inverse agonist of the histamine H(3) receptor improves wakefulness in narcolepsy:studies in orexin-/- mice and patients [J]. Neurobiol Dis, 2008, 30(1):74-83.
[18]Szakacs Z, Dauvilliers Y, Mikhaylov V, et al. Safety and efficacy of pitolisant on cataplexy in patients with narcolepsy:a randomised, double-blind, placebo-controlled trial [J]. Lancet Neurol, 2017, 16(3):200-207.
[19]Dauvilliers Y, Bassetti C, Lammers GJ, et al. Pitolisant versus placebo or modafinil in patients with narcolepsy:a double-blind, randomised trial [J]. The Lancet Neurology, 2013, 12(11):1068-1075.
[20]Watson NF, Davis CW, Zarycranski D, et al. Time to onset of response to pitolisant for the treatment of excessive daytime sleepiness and cataplexy in patients with narcolepsy:an analysis of randomized,placebo-controlled trials [J]. CNS Drugs,2021,35(12):1303-1315.
[21]Dauvilliers Y,Arnulf I,Szakacs Z,et al. Long-term use of pitolisant to treat patients with narcolepsy:HARMONY III Study [J]. Sleep,2019,42(11):174.
[22]Setnik B,McDonnell M,Mills C,et al. Evaluation of the abuse potential of pitolisant,a selective H3-receptor antagonist/inverse agonist, for the treatment of adult patients with narcolepsy with or without cataplexy [J]. Sleep,2020,43(4):252.
作者信息
作者单位:1.首都医科大学宣武医院神经内科,北京 100053;2.海南省人民医院,海南 海口 570311
通信作者:詹淑琴,E-mail:[email protected];陈 涛,E-mail:[email protected]
