RET抑制剂可达到令人印象深刻的总体缓解率,并且目前可用于NSCLC(非小细胞肺癌)患者,但识别RET融合仍然是一项艰巨的挑战。大多数指南鼓励预先使用二代测序(NGS),或者在NGS不可能或不可获得时,采用荧光原位杂交(FISH)或反转录聚合酶链反应(RT-PCR)。总而言之,虽然与鼓励普及NGS的理念一致,但目前在晚期NSCLC患者中应用预测性生物标志物的临床实践中,单分析物检测RET融合的性能不佳,这扩大了一些临床实践差距。这种情况促使研究者在RET融合阳性NSCLC的一个大型多中心队列(n=38)中评估了几项RET检测,以获得真实世界数据。所有阳性标本除采用基于RNA的NGS(标准方法)检测外,还均采用两种不同的方法进行断裂-分离RET FISH检测,并采用RT-PCR检测。
最常见的RET伴侣是KIF5B(78.9%),其次是CCDC6(15.8%)。2例RET NGS阳性而FISH阴性的样本均存在KIF5B(15)-RET(12)融合。RT-PCR未检出的3种RET融合基因分别为AKAP13(35)-RET(12)、KIF5B(24)-RET(9)和KIF5B(24)-RET(11)。所有3例RT-PCR假阴性病例均为FISH阳性,具有典型的断裂-分离模式,两种FISH检测均含有大量阳性的肿瘤细胞。印戒细胞、砂粒体和多形性特征在肿瘤中常见(分别占34.2%、39.5%和39.5%)。
深入了解不同RET检测方法的优缺点可以帮助临床和分子肿瘤委员会实施和维护合理的算法,以快速和有效地检测NSCLC患者的RET融合。FISH和RT-PCR均有可能出现RET假阴性结果,这进一步表明NSCLC患者需要提前进行NGS检测。
研究背景
RET原癌基因位于10号染色体长臂上,编码由细胞外配体结合域、跨膜区和细胞内酪氨酸激酶域组成的跨膜蛋白。当GDNF配体与其受体结合时发生RET活化,导致同源二聚化、自磷酸化,并最终激活下游信号通路。在包括甲状腺乳头状癌和NSCLC在内的多种恶性肿瘤中已发现致癌激活性融合。RET融合见于1%-2%的NSCLC,并且在从不吸烟者或轻度吸烟者、年龄较小的腺癌(AC)中患病率较高。在未接受过治疗的患者中,RET融合往往与其他主要致癌驱动基因相互排斥。这些重排通常涉及由外显子12-18编码的RET的3 '激酶区到各种5 '异源上游伴侣基因。在NSCLC中,最典型报告的RET伴侣是KIF5B(~70%)、CCDC6(~20%)和NCOA4(~2%),还有许多其他伴侣作为孤立的例子被报告。因此,RET融合的分子流行病学很难推断,但不同系列之间重叠较多的不常见RET伴侣的频率通常约为1%:ERC1、TRIM24、TRIM27、TRIM33、DOCK1、KIF13A和KIAA1468。选择性RET抑制剂在肺癌、甲状腺癌甚至肿瘤未知策略中获得了高效开发和批准,这意味着准确识别RET融合的重要性。
目前用于鉴定RET融合的诊断方法包括日益流行的NGS和单基因方法,如FISH和RT-PCR。因此,在临床试验中,当地的检测方法存在巨大的异质性,18%-42%的患者是通过FISH或RT-PCR确诊的。几个专业组织和学术团体已经发布了关于日常实践和临床研究中检测RET融合的标准方法的建议。大多数指南鼓励首先使用NGS,或者在NGS不可能或不可用时,使用FISH或RT-PCR。虽然断裂-分离FISH传统上是检测融合的公认标准检测方法,但RET FISH尤其难以解读,并且可能容易出现假阴性和假阳性。此外,特异性RT-PCR检测法在真实世界中的性能仍然很大程度上未知。
综上所述,虽然与鼓励普及NGS的理念一致,但目前在晚期NSCLC患者中应用预测性生物标志物的临床实践中,单分析物检测RET融合的性能不佳,这扩大了一些临床实践差距。因此研究者推测,深入了解不同RET检测方法的优缺点可以帮助临床和分子肿瘤委员会实施和维护合理的算法,以便在NSCLC患者中快速和有效地检测预测性生物标志物(即包括RET)。这种情况促使研究者在RET阳性NSCLC的一个大型多中心队列中评估了几种RET检测方法(即作为标准方法的RNA-based NGS、FISH和RT-PCR),以获得真实世界数据。
研究方法
流程图如图1所示。本研究使用了来自16个不同机构的NSCLC患者的57份RET融合阳性样本,这些样本最初是作为常规临床治疗的一部分进行了检测。为了确认RET融合阳性状态,在转诊机构进行了基于靶向RNA的NGS分析(标准方法)。仅纳入有足够组织(即肿瘤细胞占比至少为20%)的病例。此外,作为常规临床治疗的一部分,在转诊机构检测的100份连续的RET NGS阴性NSCLC样本被纳入阴性对照。所有肿瘤取材均为福尔马林固定石蜡包埋(FFPE)。所有病例均由三位病理医师(E.C、F.L.R和J.L.R.C.)审核。除NGS外,所有阳性样本还使用自动扫描系统通过两种不同的检测进行了断裂-分离RET FISH,并通过基于RNA PCR进行了检测。在阴性队列中,仅研究了一项RET FISH检测。
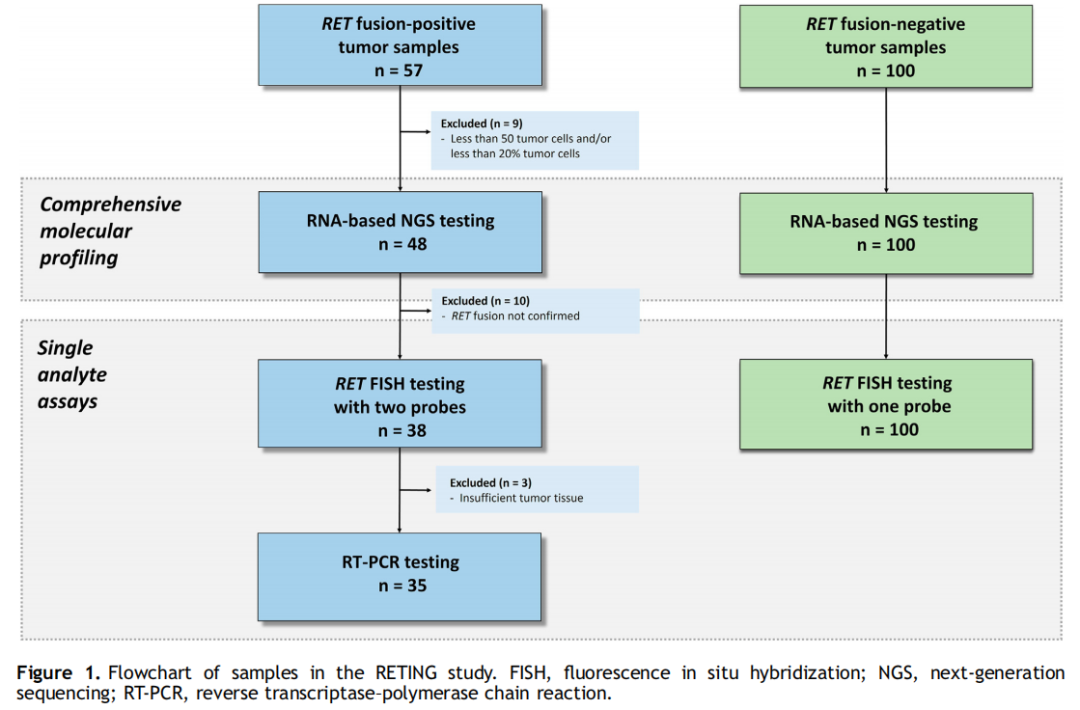
图1
对所有标本(阳性和阴性)进行了基于RNA的靶向NGS检测。以RET NGS结果作为标准方法,只有RET NGS阳性队列才能获得完整的NGS报告。对所有病例的4μm厚FFPE未染色肿瘤组织切片进行FISH检测。对于所有的阳性病例,研究者使用了两种商业断裂-分离RET FISH检测试剂盒:Vysis RETFISH断裂-分离探针RUO试剂盒(Abbott Molecular, IL)和ZytoLight SPEC RET双色断裂-分离探针(ZytoVision GMbH, Bremerhaven, Germany)。在阴性队列中,研究者仅进行了Vysis RET FISH探针检测。至少计数了50个肿瘤细胞核。RET FISH阳性定义为肿瘤细胞中有≥15%的断裂-分离信号(间隔大于1个信号直径)或孤立的3 '信号。根据研究者预先设定的标准,如果信号之间的间隔大于1但小于2个信号直径,则将这种模式命名为“临界阳性断裂-分离”。RET FISH阴性样本定义为有融合信号、孤立的5 '信号或阳性细胞少于15%的样本。根据AmoyDx多基因突变检测试剂盒的说明书,对所有阳性样本进行RT-PCR检测。这种基于RNA的检测方法用于检测6种不同的RET融合变异(即CCDC6[1]-RET[12]、NCOA4[6]-RET[12]、KIF5B[15]-RET[12]、KIF5B[16]-RET[12]、KIF5B[22]-RET[12]和KIF5B[23]-RET[12])。
研究结果
RET融合患者的临床病理特征见表1。
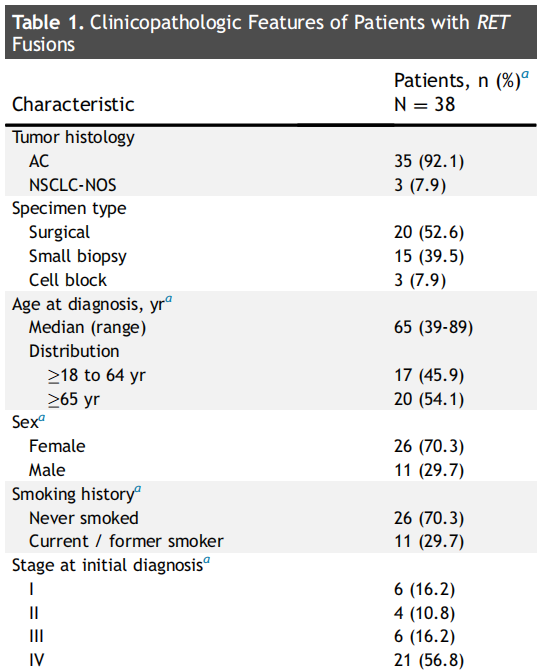
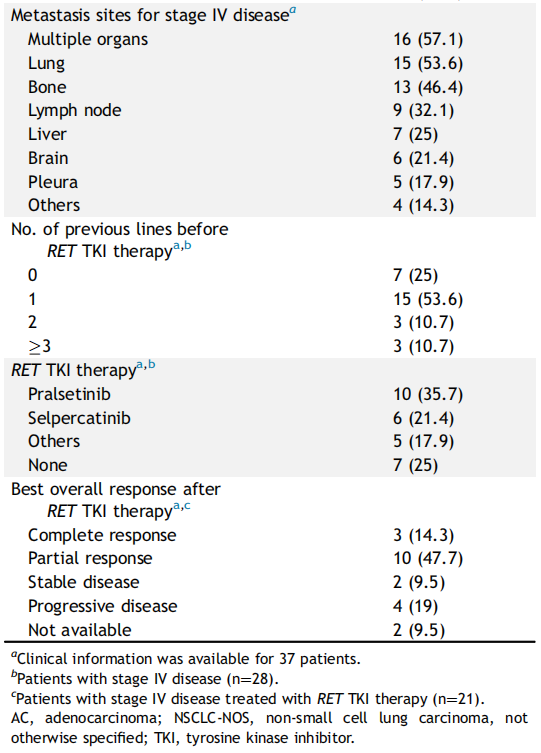
表1
基于NGS评估RET融合:
在57份RET融合阳性肺癌样本中,有9份(9/57,15.8%)样本因肿瘤细胞占比不足而被排除。6份(6/48,12.5%)样本为RET融合阴性,并且由于测序覆盖率不足,4份(4/48,8.3%)样本的结果无法评估(图1)。因此,阳性队列的最终样本数量为38。有30份(30/38,78.9%)样本携带KIF5B-RET融合(25份为KIF5B[15]-RET[12]变异,2份为KIF5B[16]-RET[12]变异,其余3份分别为KIF5B[23]-RET[12]、KIF5B[24]-RET[11]和KIF5B[24]-RET[9]变异),6份(6/38,15.8%)样本检测到CCDC6(1)-RET(12)融合。1份(1/38,2.6%)样本携带NCOA4(6)-RET(12),1份(1/38,2.6%)样本携带AKAP13(35)-RET(12)融合。44.7%(17/38)的RET阳性患者存在非RET变异。三种较常见的共基因变异包括TP53(5/38,13.2%)、SETD2(5/38,13.2%)和CTNNB1(2/38,5.3%)突变。值得注意的是,还检出MDM2(1/38,2.6%)和CDK6(1/38,2.6%)基因拷贝数变异的孤立病例。
由于阴性队列是回顾性的,因此NGS在全部100例RET阴性肿瘤中均获得成功(图1)。
基于FISH评估RET融合:
所有138例标本(阳性和阴性)均成功进行了FISH检测(图1)。38例RET NGS阳性标本中,36例(94.7%)经两种探针检测均为RET FISH阳性,与NGS结果一致。两种探针的总体结果非常相似。Vysis探针的平均阳性细胞占比为74.6%(中位数77%,范围:16%-100%),ZytoVision探针的平均阳性细胞占比为70.5%(中位数74%,范围:18%-96%)。断裂-分离模式比孤立的3 '信号模式更容易被观察到(30/36,83.3% vs . 6/36,16.7%)(图2A-D)。使用其中一种探针时,具有临界阳性断裂-分离模式的病例数量较高(ZytoVision为36例中的13例,36.1%;Vysis为36例中的6例,16.7%)。值得注意的是,除AKAP13外,这种临界模式在所有融合伴侣中均被发现。CCDC6的频率(ZytoVision:3/6,50%;Vysis:1/6,16.7%)高于KIF5B(ZytoVision:9/28,32.1%;Vysis:4/28,14.3%)(图3A)。两份RET NGS阳性但FISH阴性的样本含有KIF5B(15)-RET(12)融合(图3B)。这两个ACs均表现为沙砾体,并在手术标本中被诊断。这2例患者接受了RET TKI治疗,并达到了部分缓解。阴性队列中所有病例的FISH结果与NGS的结果一致(图3C)。
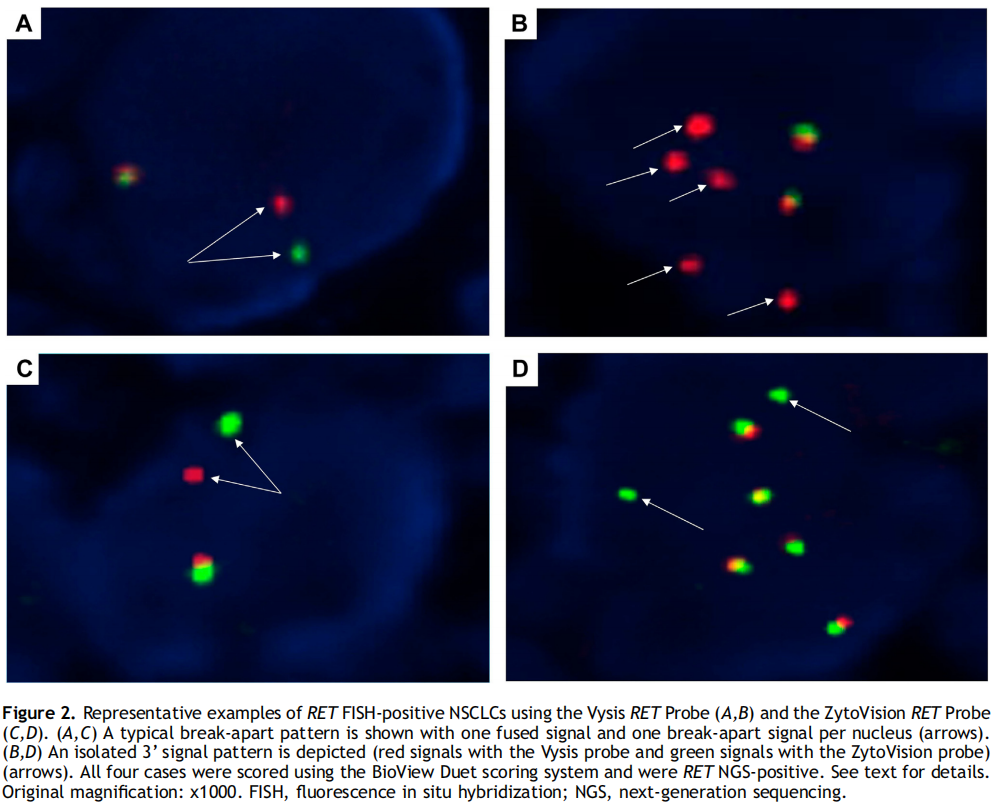
图2
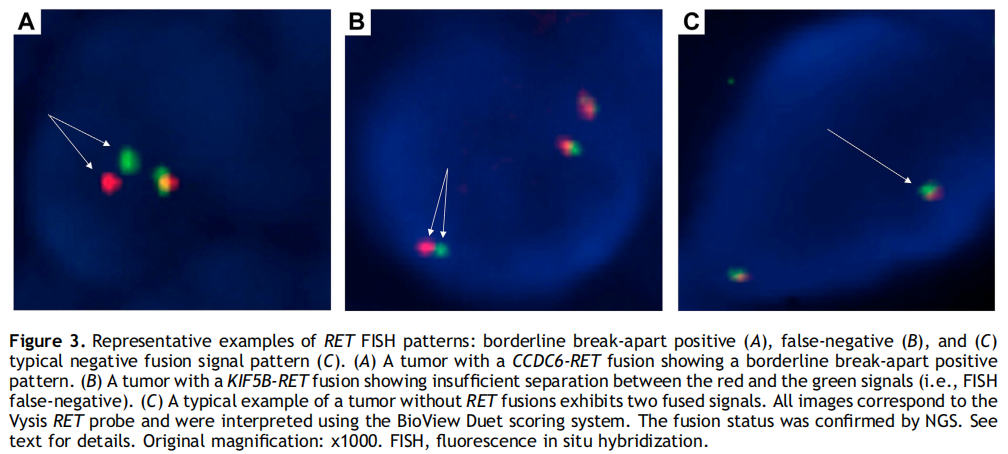
图3
基于RT-PCR评估RET融合:
在之前的分析后,3例RET NGS阳性病例因缺乏肿瘤组织而被排除(图1)。在剩余的35份NGS阳性样本中,有32份(91.4%)为RT-PCR阳性。RT-PCR未鉴定出的3种RET融合基因分别为AKAP13(35)-RET(12)、KIF5B(24)-RET(9)和KIF5B(24)-RET(11)。3例均为AC,其中2例经手术切除,1例经粗针穿刺活检确诊,手术切除标本均含有印戒细胞或沙砾体。3例均为FISH阳性,均表现为典型的断裂-分离模式,且两种FISH方法检测的阳性肿瘤细胞数量均很高(Vysis分别为82%、92%和90%;ZytoVision分别为60%、94%和96%)。值得注意的是,这3例患者中有2例接受了RET TKI治疗,并达到了部分缓解。
组织学特征:
共有35个肿瘤(35/38,92.1%)为AC,3个肿瘤(3/38,7.9%)为非特指NSCLC。腺泡型16例(45.7%),实性型11例(31.4%),贴壁型5例(14.3%),乳头型2例(5.7%,分别为KIF5B[15]-RET[12]和CCDC6[1]-RET[12]),微乳头型1例(2.8%,KIF5B[15]-RET[12])。印戒细胞、沙砾体和多形性特征经常被观察到(分别见于13/38[34.2%]、15/38[39.5%]和15/38[39.5%])(图4A-C)。值得注意的是,只有携带KIF5B伴侣的肿瘤存在多形性。
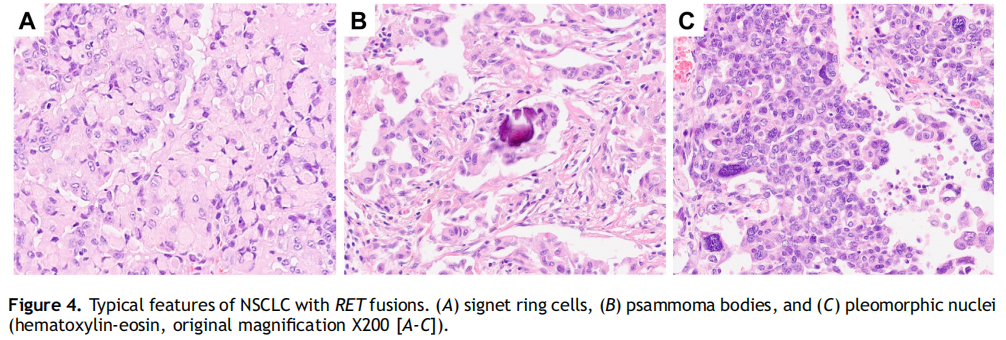
图4
讨 论
本文提供的信息非常及时,因为最近一项对500,000多例患者的调查发现,由于生物标志物检测方面的问题,近50%的晚期NSCLC患者不适合接受靶向治疗。临床差距可总结如下:组织(组织不足或对肿瘤细胞含量的估计不准确)、检测(未安排适当的检测或者结果不确定或假阴性)和时间(周转时间延迟)。因此,在一些系列中,RET融合的频率低于1%,并且在完全基因分型的队列中,这一百分比在预期范围内(即1%-2%),这并不令人意外。这些结果与其他可干预融合有类似趋势的越来越多证据一致。虽然广泛分子谱分析是大多数指南推荐的NSCLC检测方案,但NGS并未普遍应用,也未被普遍要求。在对所有晚期NSCLC患者常规进行NGS之前,对“分子冗余”概念的深入理解令人安心。这一概念已得到该领域所有主要专业组织的推荐和支持,可概括如下:“实验室应确保使用替代方法或样本以确认或解决意外、不一致、模棱两可或其他低可信度的检测结果”。因此,在这项RETING研究中,研究者希望探讨通常使用的单基因RET检测法作为NGS的潜在补充工具在晚期NSCLC患者的检测流程中的性能。
鉴于RNA测序较高的灵敏度,现在正成为融合鉴定的公认标准,因此研究者决定使用一种需要少量RNA的大型RNA-based NGS检测作为标准。本系列中RET融合的分子特征与之前的报道非常相似(即同时出现TP53、SETD2和CTNNB1突变的频率较高),包括令人困惑的MDM2和CDK4/6扩增。总体而言,发现的RET伴侣的种类和个体频率与之前所描述的相似(表2)。最常见的融合伴侣是KIF5B、CCDC6和NCOA4。从本研究中可以得出几个结论。首先,两种常用FISH探针的性能相似:在同一样本中,两种探针均有两个明确的假阴性结果。令人遗憾的是,这两个不理想的结果均涉及NSCLC患者中最常见的RET融合(即KIF5B[15]-RET[12]融合)(表2)。尽管最初的描述是RET FISH假阴性结果仅限于NCOA4,但已有10个涉及KIF5B融合的孤立病例报告。其次,研究没有RET FISH假阳性结果的原因可能是研究者使用了出色的自动化FISH扫描系统,并且使用了大型NGS panel与FISH比较。与其他作者的观点一致,研究者认为目前RET FISH的假阳性率可能被高估,主要有两个原因:(1)对于阳性断裂-分离信号采用了较低的信号分离阈值,或者以较低的阳性细胞核百分比作为阳性的临界值,(2)使用RT-PCR或作为标准的小NGS panel,这可能会遗漏一些融合伴侣。此外,与其他断裂-分离FISH探针相似,RET FISH检测中出现复杂模式(例如信号丢失),显然与假阳性结果相关。然而,关于这一主题的文献应非常谨慎地解读,因为大多数系列的规模较小,并且使用了非常不同的方法和标准(表3)。
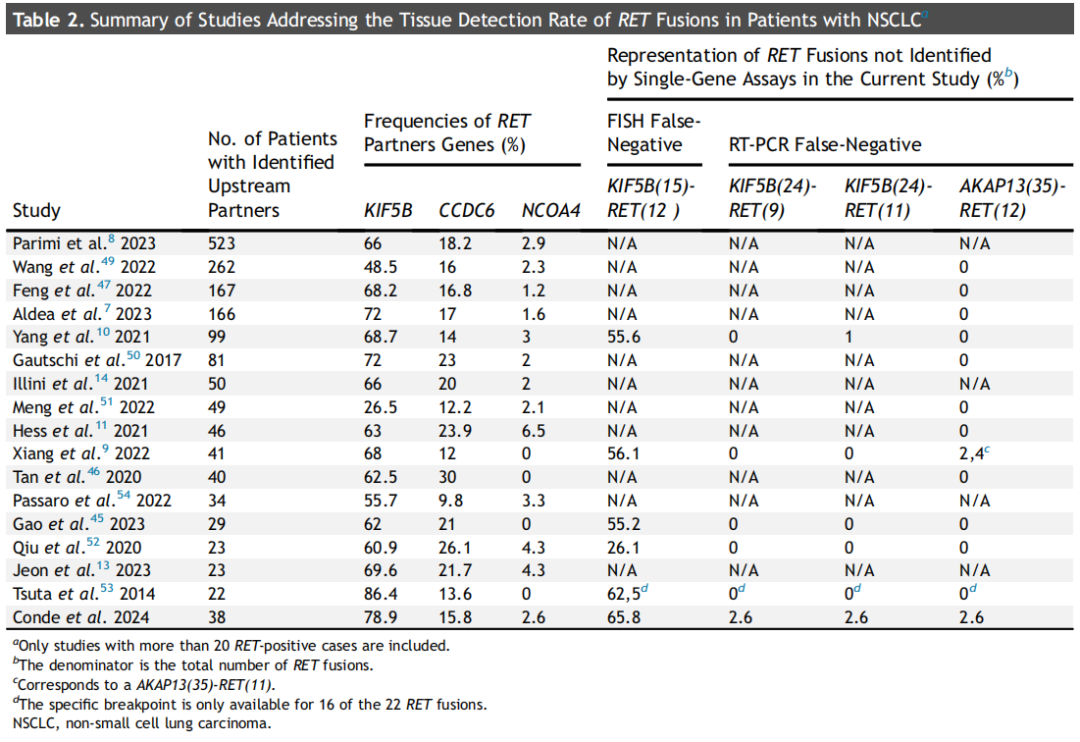
表2
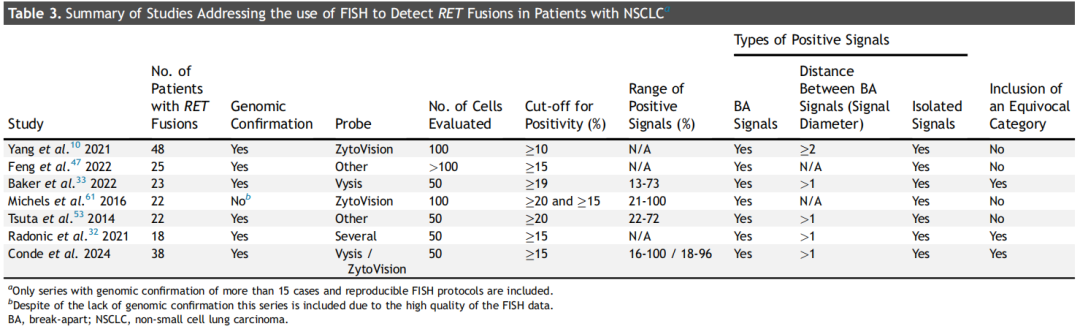
表3
在使用RT-PCR时,重要的是理解“诊断敏感性”的概念,它与检测法的全面性有关,或与给定检测法可检出的基因所描述的所有RET融合的百分比有关。这些检测法的用户应该时刻意识到“假阴性”(即因为在检测法的设计中未包括部分融合伴侣)是不可避免的。因此,RT-PCR试剂盒漏检了3个RET融合,这强调了对于驱动基因阴性的NSCLC患者,始终需要考虑NGS检测。根据本研究对文献进行的综述提示,AKAP13伴侣的存在是一种罕见事件。遗憾的是,一些大型系列缺乏关于具体KIF5B断点的详细信息,因此无法就KIF5B(24)-RET(9)和KIF5B(24)-RET(11)融合的分子流行病学得出明确结论(表2)。Mizukami等人指出,在包括60例患者的多个队列中,KIF5B(24)-RET(11)融合的频率为2%,这与本研究(2.6%)相似。然而,在两个非常小的病例系列中(13例和14例患者,发生率约为7%)偶尔出现这种融合仍然令人担忧,这凸显出在使用RT-PCR进行RET检测时,很难计算假阴性结果的风险。由于成本原因或在EGFR突变率高的地区进行排除性检测,单分析方法在全球仍然非常流行。在排除性检测中,首先检测几种生物标志物,然后在驱动基因阴性的患者中进行NGS。尽管关于这一策略的成本效益报道相互矛盾,但亚太地区最近发布的专家共识或建议支持在NSCLC患者中首先使用NGS。
由于RET免疫组织化学检测RET融合的敏感性(50%-100%)和特异性(30%-90%)范围较广,因此目前不推荐使用RET免疫组织化学检测RET融合,但以下几点意见可能有助于未来RET抗体的实施和开发:(1)由于许多报告的样本量较小,并且非KIF5B伴侣的代表性不足,关于这一主题的证据仍不确定;(2)只有针对RET C端部分的抗体才能用于鉴定嵌合蛋白;(3)克隆EPR2871可能是最常用的和特征明确的,在融合伴侣和蛋白表达之间存在有趣的关联。一些作者报告了KIF5B融合的较高H评分,这使KIF5B-RET融合检测具有完美的灵敏度。
本研究的RET融合NSCLC的组织学特征与文献一致。仔细回顾已发表的研究发现,大多数病例为AC(范围:82%-100%,平均值:92.6%,中位数:94%)。众所周知,RET融合阳性AC可含有印戒细胞(范围:27-36%,平均:30.7%,中位数:30%)和沙砾小体,但在临床实践中,这些特征的预测价值尚未得到充分认识。值得注意的是,5个FISH/RT-PCR假阴性样本中有4个包含印戒细胞或沙砾小体。因此,在这些情况下,病理学家应始终报告这些情况,并坚持寻找可干预的融合,因为它们也可在有ALK或ROS1融合的NSCLC中发现。另一个有趣且未被充分认识的特征是RET融合阳性肺AC中存在乳头或微乳头模式:在本研究中,近9%的AC表现出其中一种模式,报道的发生率范围为9%-36%。与其他作者一致,KIF5B和非KIF5B伴侣均参与乳头状形成。最后,一定要强调的是,RET融合在其他肺癌亚型中也有报道,包括鳞状细胞癌、腺鳞癌、肉瘤样癌、多形性癌和神经内分泌癌。值得注意的是,在对RET融合阳性实体瘤进行的癌症研究中,也可以发现神经内分泌分化,这凸显出还需要将组织学分类作为一种方法,以提高在肿瘤未知疗法中找到可行融合的可能性,尽管这看起来可能违反直觉。
总之,单项分析结果可能出现假阴性结果,这进一步证明了NSCLC患者需要提前进行NGS。考虑到NSCLC的临床问题,需要了解使用的方法在真实世界环境中的表现。
参考文献:
Conde E, Hernandez S, Rodriguez Carrillo JL, et al. RET Fusion Testing in Patients With NSCLC: The RETING Study. JTO Clin Res Rep. 2024;5(4):100653. Published 2024 Feb 20. doi:10.1016/j.jtocrr.2024.100653
