金属平衡的破坏可以引发铜死亡和铁死亡的协同作用,为肿瘤学领域的持久挑战提供极具前景的解决方案。在本研究中,南京大学宁兴海教授和Yurui Xu等人设计了一种名为MetaCell的细胞特洛伊木马,这一策略使用活的中性粒细胞通过稳定地内化热敏脂质体双金属Fe-Cu-MOFs(Lip@Fe-Cu-MOFs)来实现。MetaCell可引发铜死亡和铁死亡,从而提高治疗效果。MetaCell反映了中性粒细胞的特征,可以逃避免疫系统,不仅渗透到肿瘤中,还可以通过释放治疗成分来应对炎症,从而克服传统的治疗障碍。尤其是Lip@Fe-Cu-MOFs还表现出显著的光热效应,在癌症细胞内激发Fe-Cu-MOFs的靶向释放,并增强铜死亡和铁死亡的协同作用。MetaCell在荷瘤小鼠中显示出了良好的治疗结果,有效消除实体瘤并预防复发,延长生存期。这项研究为恶性肿瘤中铜和铁稳态之间的复杂相互作用提供了深刻的见解,有望为癌症治疗的创新方法铺平道路。相关工作以“Cellular Trojan Horse initiates bimetallic Fe-Cu MOF-mediated synergistic cuproptosis and ferroptosis against malignancies”为题发表在Science Advances。

【文章要点】
值得注意的是,铜死亡和铁死亡的协同诱导可以克服独立疗法的某些局限性,如耐药性或疗效受限的问题。当铁和铜都过度积累,导致活性氧(ROS)升高时,这种协同效应可能特别明显。随之而来的氧化应激增加会加剧细胞损伤并加剧细胞死亡,从而比单独的铜死亡或铁死亡发挥更强大的抗癌作用。尽管如此,对这两种细胞死亡机制的同时激活的研究仍然十分有限。为此,作者设计了MetaCell,其包含了包封有双金属Fe-Cu金属有机框架的热敏脂质体制剂的活中性粒细胞 (Lip@Fe-Cu-MOFs)。MetaCell的生成使用了集成的制造策略,从而产生了具有不同特性的响应性治疗平台。其中,Fe-Cu-MOFs是通过将铁和铜金属离子与有机配体结合形成高度多孔的框架来合成的。与单金属MOFs相比,这些双金属Fe-Cu-MOFs表现出优异的性能,包括增强的稳定性、提高的催化活性和增强的吸附能力。为了进一步提高Fe-Cu-MOFs的有效性,作者还将其封装在热敏脂质体中,并在随后由活的中性粒细胞进行内化(图1)。
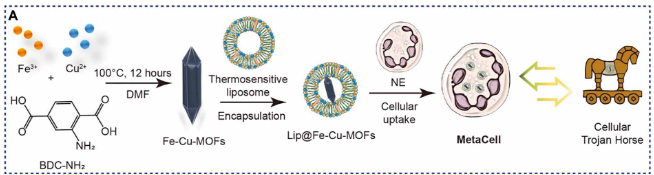
图1 MetaCell
这种仿生方法赋予MetaCell固有的中性粒细胞特性,提供了一系列好处,如改善生物相容性、免疫系统逃避和靶向递送。MetaCell经过独特的工程设计,可促进肿瘤靶向释放,以响应多种近红外(NIR)激光照射诱导的炎症刺激。与正常组织相比,肿瘤组织中炎症水平的提高可导致MetaCell的大量积累并释放Lip@Fe-Cu-MOFs,最终产生自我放大的肿瘤靶向效应。此外,将NIR激光刺激专门应用于肿瘤区域,而不是正常组织,会产生显著的炎症差异。这些差异有助于增加MetaCell向肿瘤部位的募集。此外,Fe-Cu-MOFs由于其在近红外区域的强吸收而表现出显著的光热转换能力,因此在细胞摄取时,热敏脂质体可以通过肿瘤区域的局部加热来控制药物释放。MetaCell介导的光热加热可以在癌症细胞内释放Fe-Cu-MOFs,而且还增强了Fe-Cu-MOFs促进的铜死亡和铁死亡。而Fe3+或Cu2+催化的类芬顿/类芬顿反应产生了大量的羟基自由基,这些自由基与Cu2+结合,协调肿瘤细胞内谷胱甘肽(GSH)的耗竭。这种协同作用可进一步协同诱导铁死亡和铜死亡(图2)。
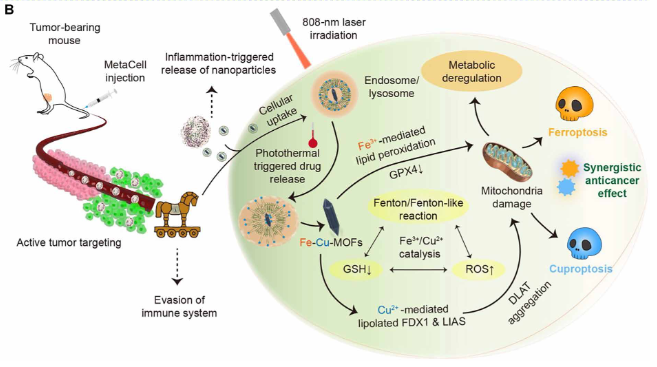
图2 铁死亡和铜死亡协同抗肿瘤治疗示意图
原文链接:
https://www.science.org/doi/10.1126/sciadv.adk3201