肿瘤血管异常是肿瘤的重要标志,异常的肿瘤血管不仅可以导致肿瘤细胞进入血液循环发生远端转移,同时还会使得肿瘤内酸性物质积聚,极度缺氧,抗肿瘤药物的递送困难,削弱药物的治疗效果,因此,深入挖掘影响肿瘤内皮细胞的相关靶点,筛选相应的治疗药物迫在眉睫。
丹参归属于活血化瘀药,具有祛瘀止痛、活血痛经、清心除烦的作用。有研究表明丹参中的水溶性成分丹参素(SAA)可通过改善血管异常结构治疗心肌缺血、冠心病等多种疾病。
南京中医药大学陆茵、赵杨教授团队对丹参素是否影响肿瘤血管以及如何影响肿瘤血管进行了探究,其研究结果发表于《Acta Pharmaceutica Sinica B》杂志。

SAA改善肿瘤血管生成抑制肿瘤生长
研究者选用6-8周龄的雄性C57BL/6J小鼠,通过皮下注射LLC细胞和B16-F10细胞构建两种肿瘤模型。随机分为两组,给药组喂以SAA(40mg/kg),模型组则给予等量生理盐水。通过瘤体积测量、IVIS活体成像、Ki67免疫组化染色及HE染色发现,与模型组相比,
SAA显著抑制了肿瘤组织的生长。
紧接着,研究者采用3D多普勒成像对给药后的肿瘤血管情况进行检查,结果显示,与模型组相比,SAA增强了血管灌注和氧气运输。进一步选用LLC荷瘤小鼠,尾静脉注射缺氧探针(PIMO),60-90分钟后,处死小鼠,剥离肿瘤进行免疫荧光染色,结果显示,SAA可显著减少肿瘤组织内部的缺氧状况。这提示
SAA可能通过改善肿瘤缺氧微环境以抑制肿瘤的发生发展。
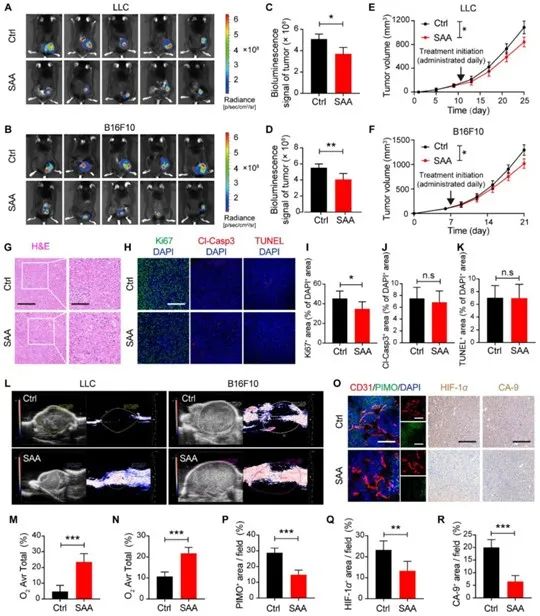
图1 SAA抑制肿瘤生长
那么,SAA对肿瘤缺氧微环境的影响又是否与其改善肿瘤血管结构与功能相关呢?基于这一疑问,研究者利用免疫荧光进一步对肿瘤血管进行探究,CD31染色结果显示,相较于模型组,给药组中的
肿瘤血管数量明显减少,血管生成受到抑制。在血管结构方面,CD31/α-SMA染色和CD31/NG2染色发现,α-SMA和NG2标记的平滑肌细胞和周细胞阳性率升高,这提示
SAA改善了肿瘤血管平滑肌细胞和周细胞的覆盖率,使得血管结构更加完整,促使血管正常化。
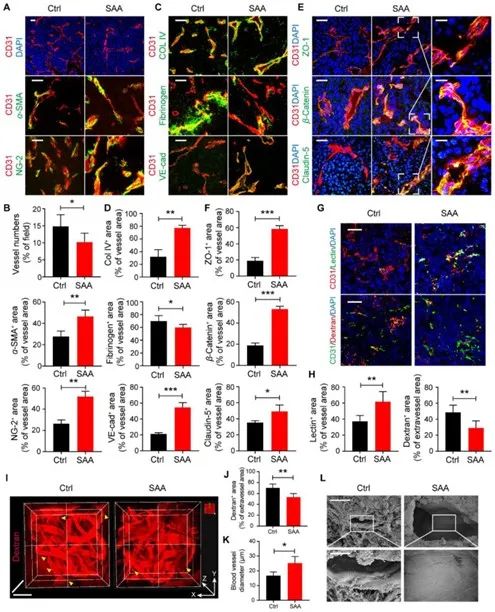
图2 SAA促使血管正常化
为进一步明确SAA对肿瘤血管及肿瘤微环境的调节作用,研究者在体外使用缺氧诱导的HUVEC构建了肿瘤血管模型。并对缺氧诱导的HUVEC进行了RNA测序,结果显示,
在SAA治疗时,有72个基因显著上调,64个基因显著下调。KEGG富集分析差异表达基因发现其主要参与TJ和AJ等过程。SAA处理后,AJ的关键成分VE-cad和TJ的关键调节因子的ZO-1的表达均升高。
此外,与载体对照组相比,SAA 能够在细胞-细胞接触位点引发β -Catenin 的广泛表达,但限制其核积累,降低磷酸化水平。上述结果提示,
SAA可以通过改善内皮细胞的TJ,从而缓解缺氧所致的血管内皮功能障碍。
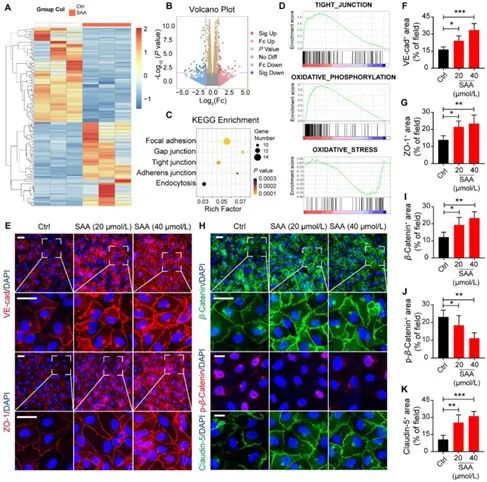
图3 SAA改善缺氧所致的血管内皮功能障碍
有研究表明,缺氧可增强内皮细胞的氧化应激,进而导致内皮细胞功能障碍。基于此,研究者对HUVEC中的多种氧化应激指标进行了检测,发现与常氧条件相比,缺氧条件降低了SOD、CAT和GSH-Pxt的浓度,增加MDA的含量;而SAA的处理则很好的逆转了上述现象。
这提示SAA减轻了内皮细胞的氧化应激。
由于Keap1/Nrf2信号通路与氧化应激相关,研究者进一步发现SAA还能影响Keap1/Nrf2信号通路相关蛋白。鉴于该信号通路与代谢联系紧密,研究者采用非靶向代谢组学分析,结果发现在缺氧诱导的HUVEC细胞中,载体对照组和SAA治疗组的代谢产物存在显著差异。而Seahorse分析结果显示SAA多倾向于抑制糖酵解和线粒体呼吸。
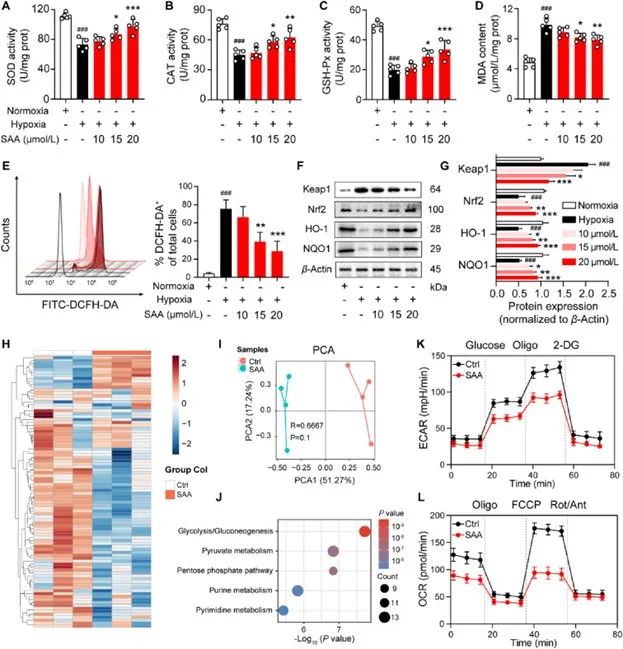
图4 SAA减轻内皮细胞氧化应激
SAA调控肿瘤血管的作用机制
为探索SAA潜在作用的分子靶标,研究者通过DARTS技术筛选获得相对丰度最高的小分子M2型丙酮酸激酶(PKM2)。CETSA和SPR结果显示
,SAA和PKM2存在直接相互作用。
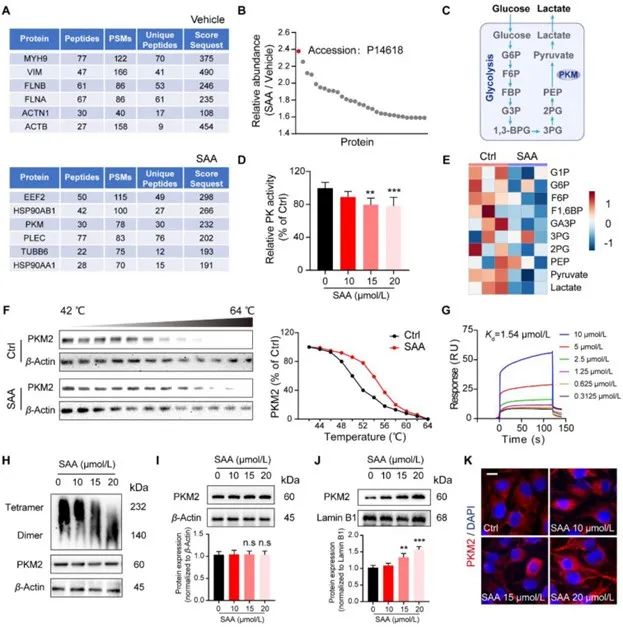
图5 SAA与PKM2存在直接相互作用
随后,研究者通过分子对接进一步寻找SAA与PKM2的结合位点。根据预测结果,SAA可与PKM2的多个氨基酸残基结合(Arg489,、Gly520和Lys433)。构建上述位点的突变质粒,转染细胞后检测发现Lys433位点突变后,即使提高SAA的浓度,SAA也无法与PKM2结合。这表明,
Lys433是SAA和PKM2的结合位点。
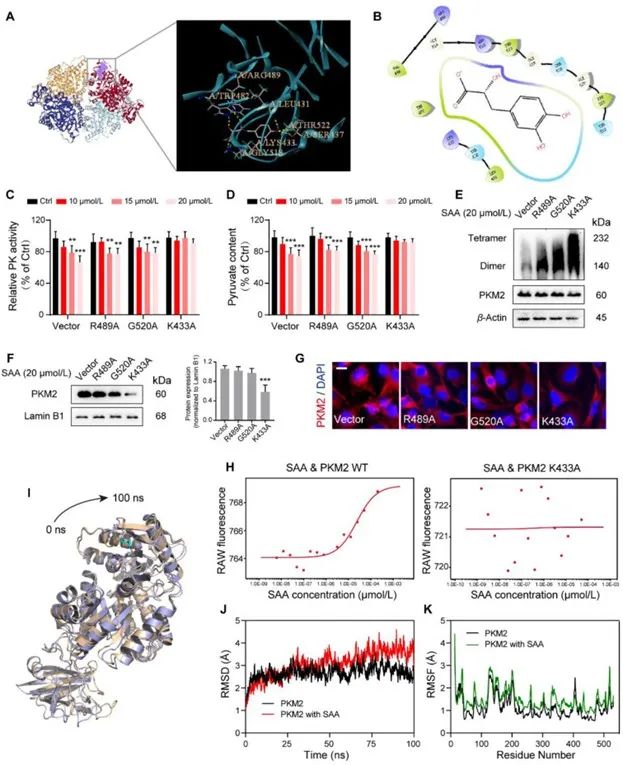
图6 Lys433是SAA与PKM2的结合位点
研究者选择14例高分化或低分化的人类肺癌标本,以探究PKM2与肿瘤发生发展的相关性。与正常肺组织相比,PKM2在肿瘤组织中呈现高表达,且与CD31存在共定位现象。与高分化肿瘤组织相比,PKM2在低分化肿瘤组织中表达显著升高。此外,在低分化的肿瘤组织中β-Catenin和Claudin-5表达也出现明显异常。而前期研究中同样发现,SAA可以影响β-Catenin的核转位,降低其磷酸化水平,那么SAA是否通过影响PKM2进而影响β-Catenin呢?研究者构建PKM2敲除细胞发现,敲除PKM2后,SAA的处理将无法影响β-Catenin及其下游Claudin-5的表达,这提示,
SAA依赖PKM2调节β-Catenin/Claudin-5信号轴改善内皮TJ。
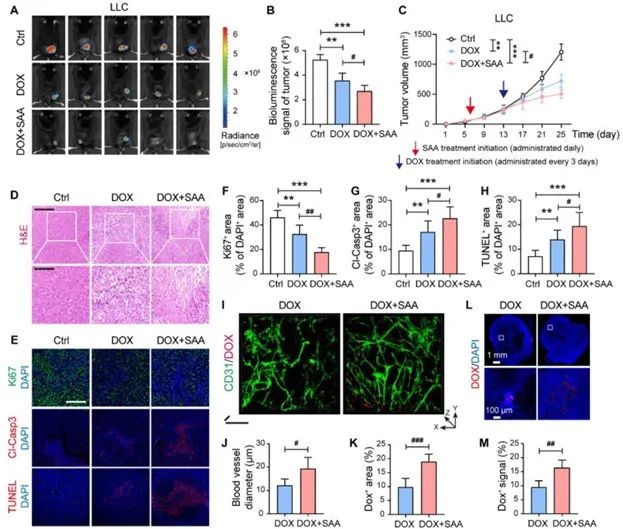
图7 SAA依赖PKM2调节β-Catenin/Claudin-5信号轴
SAA与阿霉素(DOX)的联合增效
研究者选择雄性C57BL/6J小鼠造模,在40mg/kg SAA治疗7天后,再给予8mg/kg DOX治疗发现,相较于模型组和DOX单药组,SAA和DOX联用可显著抑制肿瘤的生长,促进肿瘤细胞的凋亡。此外,相较于DOX单药组,
联合用药组的血流灌注、血管直径以及DOX的药物递送均得到了明显增强。
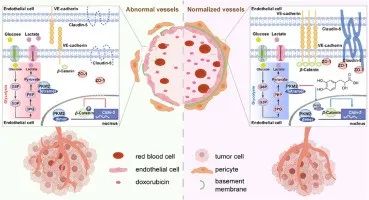
图8 SAA与DOX协同增效
综上所述,SAA通过调控丙酮酸激酶PKM2影响β-Catenin/Claudin-5信号轴增强内皮细胞的紧密连接,改善肿瘤血管的异常结构和功能,促使肿瘤血管正常化,增强化疗药物的疗效,为肿瘤联合治疗提供了更多选择。
参考文献:
Cheng Qian, Yueke Zhou, Teng Zhang et al.Targeting PKM2 signaling cascade with salvianic acid A normalizes tumor blood vessels to facilitate chemotherapeutic drug delivery,Acta Pharmaceutica Sinica B,2024,ISSN 2211-3835,https://doi.org/10.1016/j.apsb.2024.02.003.








