儿童癌症是罕见疾病,大多数有胚胎细胞起源的证据。在极其罕见的情况下,儿童在治愈了原发性恶性肿瘤多年后会出现二次肿瘤。如果二次肿瘤与原发恶性肿瘤具有不同类型并与原发肿瘤无关,其起源可能与潜在的生殖系癌症易感性或在胎儿发育期间获得的早期嵌合体细胞突变有关。此外,原发肿瘤治疗期间使用的细胞毒药物的致突变和/或促癌作用也可能会造成二次肿瘤(如继发于治疗的急性髓系白血病)。研究表明,细胞毒药物的致突变作用可以通过在药物暴露后采集的样本中识别特定的突变谱图(常被称作突变印记)进行追踪。然而,在正常组织中识别化疗诱导的突变受到样本获取困难和准确识别极低频率突变这一技术挑战的阻碍。因此,尽管有零星报道,仍然缺乏对细胞毒性药物给癌症生存者正常组织造成的突变负荷的全面了解。
近日,巴塞罗那生物医学研究所 Lopez-Bigas 博士和巴塞罗那SJD儿童癌症中心儿童肿瘤学家Jaume Mora博士领导的联合团队在Cancer Discovery上发表了题为Origins of Second Malignancies in Children and Mutational Footprint of Chemotherapy in Normal Tissues 的文章。文章报道了4个儿童二次肿瘤的临床案例。这4例患者的共同点是在婴儿期、儿童期或青春期首次诊断为恶性实体瘤,在4至11年后发展出第2个不相关的恶性肿瘤,并且没有可识别的生殖系癌症易感变异。通过肿瘤和正常组织的全基因组测序和纠错超深双重测序,研究人员揭示了二次肿瘤的起源和发展途径。此外,研究人员还发现,在接受化疗的个体的10个正常组织中存在铂类药物相关突变,强调了细胞毒性疗法可能对癌症生存者产生的影响。

继发于细胞毒性疗法的急性髓系白血病
案例1是一名13岁零7个月时出现右下肢非转移性腺泡型横纹肌肉瘤(ARMS)的儿童。该儿童接受了伊立替康和卡铂的化疗,随后进行根治性手术和放疗并达到长期完全缓解。她在17岁时出现了治疗相关的急性髓系白血病 (tAML),一种常见的继发性恶性肿瘤。
研究人员首先对ARMS、tAML和首次诊断时获得的正常血液样本进行了中位深度120倍的全基因组测序。使用正常血液样本作为生殖系基因组的参考,鉴定出ARMS和tAML的体细胞突变并根据变异等位基因频率(VAF)识别出克隆突变。分析显示,在ARMS中存在PAX3-FOXO1融合驱动基因;在tAML中存在潜在的驱动因子:1个致癌性KRAS G12A错义变异、1个WT1移码插入或缺失(indels)以及7号染色体单体。整体上看,在ARMS和tAML中分别鉴定出1259和2231个体细胞克隆单核苷酸变异(SNV),两者之间没有共同的克隆SNV。这表明两种恶性肿瘤起源于胚胎发育期间造血组织出现前或出现时分离的细胞谱系。
接下来,研究人员分析了tAML克隆和亚克隆突变的三核苷酸谱。对tAML样本突变谱的目检显示在C[C>T]T和C[C>T] C三核苷环境中存在高频率的C>T变异。这两种类型的高频率突变,是铂类药物相关突变特征SBS31最活跃的突变,也是SBS35最活跃的突变之一,表明tAML中存在铂类药物诱导的突变。通过对tAML的克隆和亚克隆SNV的突变特征分析,研究人员发现SBS31(或SBS35)促进了tAML的克隆性突变。由于所有tAML细胞均存在铂类相关突变,这只能解释为tAML在接受化疗期间或之后由单个造血干细胞扩增而来。正如预期的那样,在化疗暴露之前发生的ARMS中未观察到铂类相关突变。因此,与成人tAML的情况一样,这例儿童tAML在暴露于细胞毒性药物后经历了完全克隆扩增。
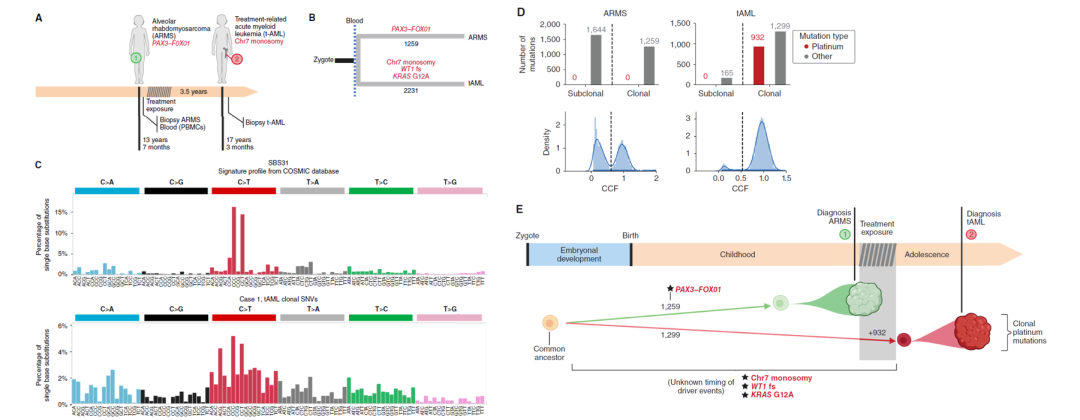
最后,为了探讨tAML的驱动突变是否由卡铂药物暴露引起,研究人员计算了KRAS驱动突变由SBS31或SBS35产生的可能性。他们估算出该驱动突变由铂类暴露产生的概率为23% (SBS35) 到 32% (SBS31)之间,由年龄相关的SBS5产生的概率是61%到72%,这表明KRAS驱动突变可能在药物暴露前就已经存在。但无论该驱动突变是预先存在的还是由细胞毒性治疗引起的,在tAML的克隆性突变中活跃的铂类突变印记表明在治疗开始后发生了克隆清除。
两种实体肿瘤具有共同起源
案例2是一名10个月时被诊断为间变性室管膜瘤(EPN)的儿童。在完全切除肿瘤后,患儿接受伊立替康和顺铂的辅助化疗以及随后总剂量59.4 GY的质子束放疗。8.5年后,该儿童确诊H3K27突变的弥漫性中线胶质瘤(DMG)。
研究者以中位深度120倍对肿瘤和血液样本的全基因组进行了测序。以血液样本作为该儿童的参考生殖系基因组,确定了两种肿瘤的体细胞突变,并根据变异等位基因频率确定了克隆突变。结果在两个肿瘤中发现了参考血液样本中不存在的5个体细胞SNV,这表明在共同的神经谱系和造血组织分化后,两个肿瘤有共同的起源。所有剩余的克隆体细胞突变对每个肿瘤都是独特的(EPN有106个,DMG有89个),这表明在细胞谱系早期分化之后的独立发展导致了这两种恶性肿瘤。
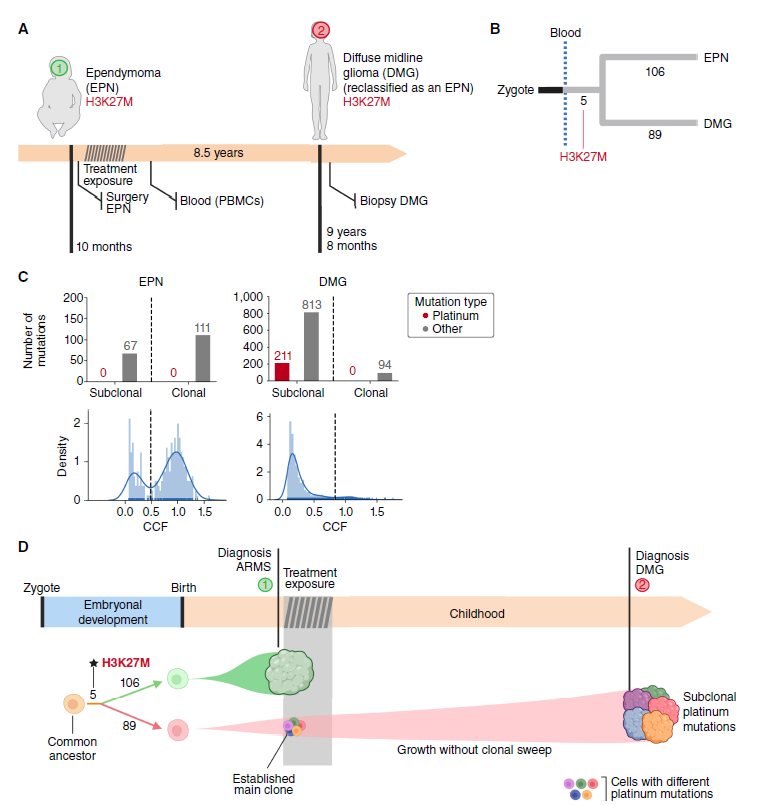
为了解释两种肿瘤的克隆突变数量相似,但临床确诊时间间隔很长(8.5年),同时 DMG中发现的亚克隆突变数量远多于EPN,研究人员假设两种肿瘤可能同时发生,但DMG在临床上无法检测到。为了验证这一假设,他们分析了DMG克隆和亚克隆突变的三核苷酸谱,并发现铂类相关印记仅在DMG的亚克隆突变中有活性,在治疗前切除的EPN样本中未检测到铂类相关突变。如果DMG在铂类药物暴露期间从单细胞开始扩增,则该肿瘤应该携带铂相关的克隆性突变。克隆性突变的缺失表明顺铂治疗后,DMG在演化过程中没有发生克隆清除。这说明在10月龄接受治疗时,DMG已经作为多细胞实体存在。随后,它继续积累亚克隆突变,并缓慢扩增了8.5年,直至出现明显的临床表现。
两种实体肿瘤具有独立起源
案例3是一名17月龄时诊断为MYCN扩增型未分化神经母细胞瘤(NB)的儿童。在接受了包含顺铂的高危NB诱导化疗,随后经历手术、放疗和数个周期的高剂量化疗后,患者获得完全缓解并继续接受以mu3F8为基础的免疫治疗,在初诊后20个月完成了治疗。在正常发育8.5年后,她在10岁时出现了软组织恶性横纹肌样瘤(MRT),并伴有SMARCB1双等位基因缺失。6个月后,患儿因疾病进展去世。
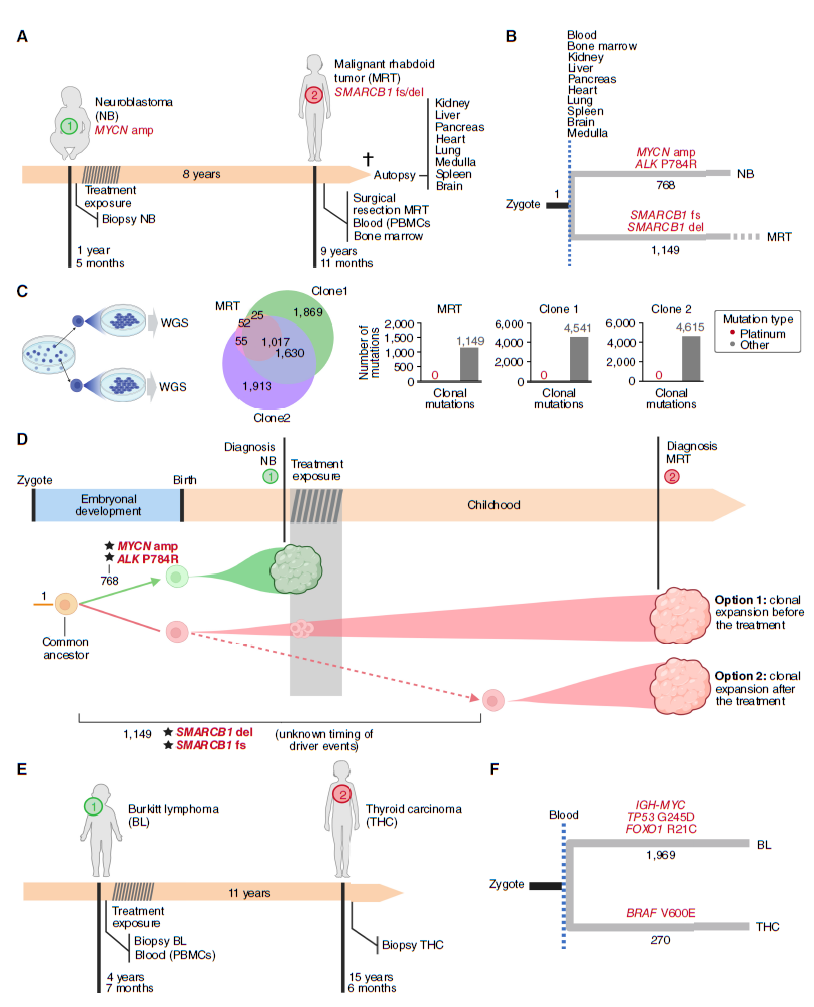
研究人员对原发肿瘤(NB)、继发肿瘤(MRT)、诊断MRT时采集的血液和骨髓样本,以及尸检时获取的肾脏、肝脏、胰腺、心脏、肺、脊髓、脾脏和脑的正常组织样本进行了中位深度为120倍的全基因组测序。此外,对父母双方的血液样本进行了全基因组测序(约30倍)。通过与父母DNA的比较排除遗传性变异,并将变异等位基因频率(VAF)约为0.5或1的变异确定为新生生殖系变异。通过直接的体细胞肿瘤-血液对比确定了每个肿瘤中的克隆性体细胞SNV、indels和较大的结构变异。结果证实了高水平的MYCN扩增是NB的驱动事件并发现ALK的非同义SNV (P784R)可能是另一个潜在的驱动事件。在MRT中,它也证实了SMARCB1双等位基因失活这一驱动因子。
由于NB和MRT只有一个共同的体细胞克隆突变,且这一突变在低VAF下也出现在所有正常组织中,这表明该突变可能是新生生殖系突变或非常早期的嵌合体细胞突变。因此,产生NB和MRT的原始细胞谱系在发育的早期就出现了分化。
案例4的儿童在4岁时被诊断为伯基特淋巴瘤(Burkitt lymphoma, BL) 4期。经过化疗和利妥昔单抗治疗后,患儿达到完全缓解,不需要手术或放疗,直到15岁时被诊断出甲状腺癌。通过对两种肿瘤的全基因组测序并与参考血液样本进行直接比较,研究人员分析了BL和THC中体细胞SNVs和易位,揭示了两种肿瘤的体细胞驱动突变。在BL中检测到典型的IGH-MYC易位、1个FOXO1激活的SNV (R21C)和1个潜在的TP53功能缺失SNV。在THC中发现了BRAF (V600E)SNV,这在儿童中的发生率低于原癌基因RET相关融合。虽然在BL中发现了1969个克隆性体细胞SNV(生发中心来源的恶性肿瘤典型的高突变负荷),在THC中只有270个SNV(突变负荷相对较低的肿瘤类型)。和案例3类似,两个肿瘤没有相同的体细胞SNV表明它们的细胞谱系在发育早期分离,并且具有独立的起源。
铂类疗法对正常组织的致突变作用
癌症基因组学中一个重要且尚未探索的问题是细胞毒性疗法对癌症患者正常组织的致突变作用。这类系统性研究(尤其是针对儿童的研究)面临的障碍之一是难以从不同个体的正常组织中获取样本。第二个问题是可靠识别组织中出现的频率极低的突变在技术上的挑战。绕过这一问题的一种方法是对起源于化疗暴露时正常的造血干细的tAML进行突变谱图研究(如案例1)。在该案例中,观察到932个克隆性铂类相关突变。相比之下,在克隆扩增开始之前,该细胞中累积了1,136个年龄相关突变。由于卡铂治疗了4天,因此可以计算出治疗期间铂类相关突变的发生率为每天232.99个,而每天累积的年龄相关突变为0.18个。然而,这种方法不适用于没有克隆扩增的正常组织。对于正常组织可以通过纠错高深度双重测序进行分析。于是研究人员使用(~ 20,000倍)靶向双重DNA测序检测了治疗期间获得的血液(案例2)和正常骨髓(案例3)样本,以及在案例3尸检获得的正常肾、肝、胰腺、肺和脾样本中是否存在铂类突变印记(SBS31或SBS35)。与案例1 tAML的三核苷酸谱一样,案例2的正常血液样本以及案例3的正常肝脏、肾脏和胰腺样本在C[C>T]T和C[C>T]C三核苷酸环境中显示出高频率的C>T变异,表明这些样本中存在铂诱导的突变。对所有正常组织中观察到的突变谱进行仔细解析,也发现了铂类相关突变的存在。相反,两个未暴露于铂类药物的非相关献血者的血液样本中未检测到铂类相关突变。根据靶向测序结果,研究者估算了整个基因组中铂类相关突变的总数。在案例2和3的正常组织中,铂类药物对每个基因组突变负荷的贡献为39个到 237个突变之间,意味着接受化疗的患者每天大致发生5到 30个铂类相关突变,比这些组织中与年龄相关的突变积累率高出2个数量级。
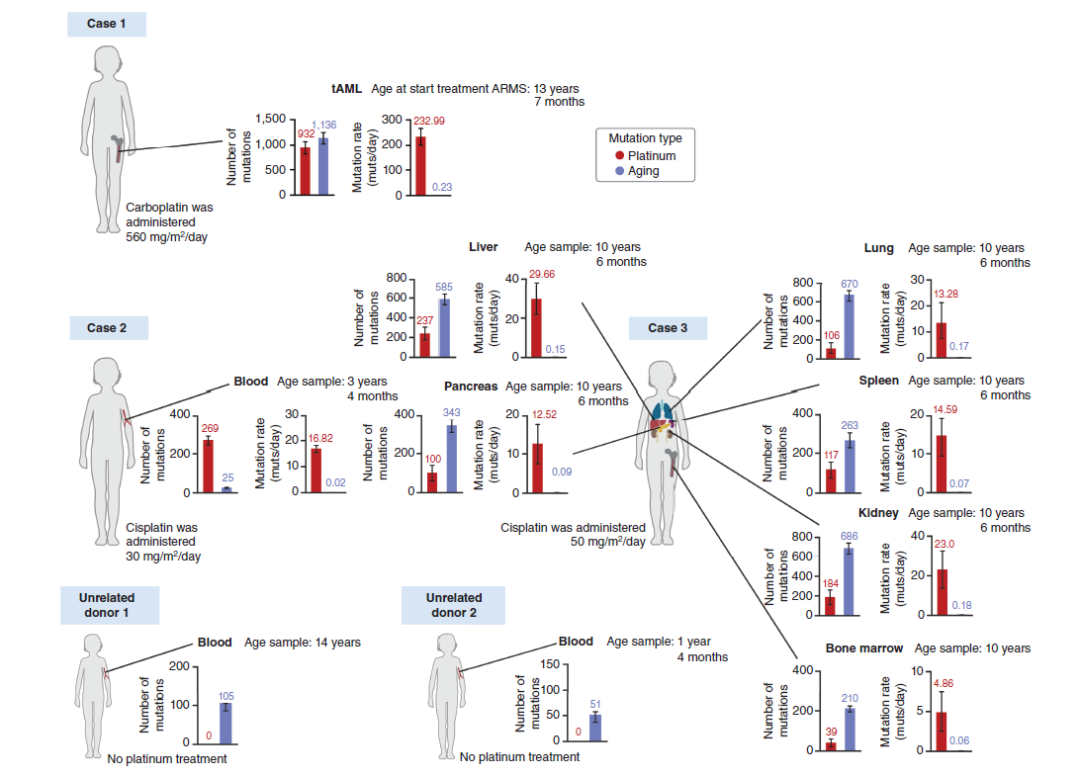
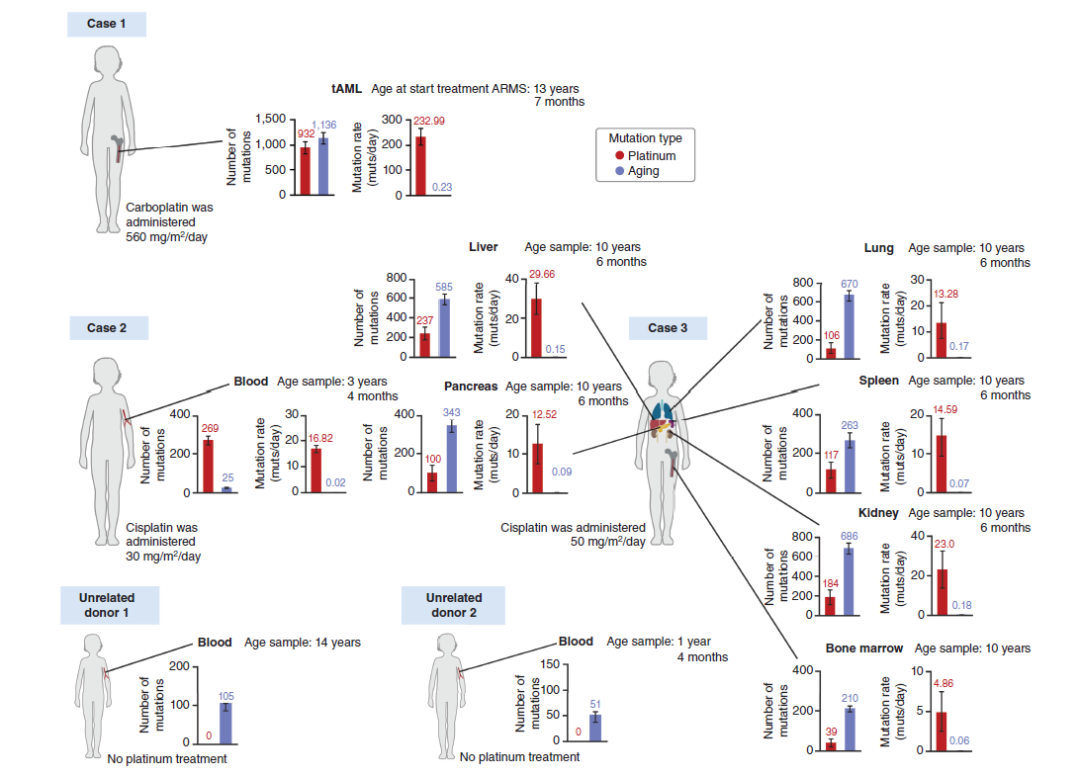
总之,研究人员分析了4例儿童二次恶性肿瘤的发生和发展过程。案例1中,铂类药物化疗可能提供了驱动tAML克隆扩增的突变或者促进先前突变的造血干细胞的扩增,也可能两者兼而有之,是4个案例中唯一真正的继发性肿瘤。案例2中,驱动两种恶性肿瘤的H3K27M突变出现在原肠胚形成后不久,并且两种肿瘤都有大致相同的起源,二次肿瘤在原发肿瘤治疗时已经存在。在案例3和案例4中,两个肿瘤在胚胎形成过程中由完全独立的克隆分化而来。此外,通过对正常组织的靶向双重测序,研究人员分析了铂类疗法对正常组织的致突变作用。在所有暴露于铂类药物的儿童的多个正常组织中发现了普遍的致突变效应,且每日暴露于铂类药物导致的突变比内源性的年龄相关突变多100倍。这证明化疗相关的突变会在健康组织中累积,因而可能对儿童期癌症生存者的健康产生长期影响。