乳腺癌是全球女性最常见的恶性肿瘤。2022年全球新发乳腺癌病例约230万,占新发癌症总数的11.6%[1]。在我国,乳腺癌在女性恶性肿瘤中的发病率位居第二,呈逐年上升的趋势[2]。面对乳腺癌,我们并非无计可施。针对不同类型、分期和分子亚型的乳腺癌,采用个体化的治疗方案,可以有效提高治疗效果。目前,临床可以借助基因检测等手段对乳腺癌进行亚型分型,进而选择最适合患者的治疗方案。
乳腺癌诊疗之精准治疗
目前,乳腺癌的常规治疗方式主要包括手术、放疗和药物治疗。药物治疗是乳腺癌精准治疗中的重要一环,包括化疗、激素治疗、靶向治疗和免疫治疗。其中,靶向治疗是通过靶向药物识别肿瘤细胞中特定分子靶点或生物标志物,在精确杀灭肿瘤细胞的同时,避免对正常机体细胞造成伤害,从而达到治疗肿瘤的目的。由于具备特异性强、疗效显著、毒副反应小等优点,靶向治疗已成为乳腺癌治疗的研究热点。
乳腺癌靶向治疗的选择与其分子亚型密切相关。因此,为了指导临床靶向治疗,乳腺癌患者在治疗前需要进行基因检测,明确其基因突变状态。根据患者雌激素受体(ER)和孕激素受体(PR)状态、人表皮生长因子受体2(HER2)和增殖指数Ki-67的表达情况,乳腺癌可分为四个亚型:Luminal A、Luminal B、HER-2过表达和三阴性乳腺癌。不同乳腺癌亚型的分子图谱有明显特异性,且标准治疗方案和预后差异较大[3]。
随着乳腺癌分子分型的精细化和药物研发的精准化,乳腺癌的靶向治疗药物也不断推陈出新。目前针对乳腺癌靶向治疗的药物靶点有BRCA1/2、PIK3CA、AKT、CDK4/6、HER2、ESR1等。
乳腺癌精准治疗需检测的关键基因
精准治疗,检测先行。基因检测的快速发展为癌症治疗模式带来了令人瞩目的变化,乳腺癌治疗也开始迈入精准医疗的新时代。
乳腺癌基因检测是通过检测某些致病基因突变是否存在以指导患者治疗,明确患者是否适合进行靶向治疗等,在指导治疗决策、疗效及预后预测等方面体现了重要的应用价值。
1 BRCA基因
大约10%的乳腺癌患者携带易感基因胚系致病性或可能致病性突变,其中BRCA1和BRCA2突变最为常见[4]。PARP抑制剂可有效治疗胚系BRCA突变(gBRCAm)的HER2阴性转移性乳腺癌。
在OlympiA研究中,使用PARP抑制剂奥拉帕利作为gBRCAm高危HER2阴性早期乳腺癌患者的辅助治疗显示了出色的疗效。结果显示,奥拉帕利显著降低了浸润性疾病复发或死亡率,达到了研究的主要终点。4年iDFS绝对获益率达7.3%。与安慰剂相比,奥拉帕利使受试者的死亡风险降低了32%,将三年OS率提高到92.8%(98.5% CI 0.47-0.97;P=0.009);奥拉帕利组与安慰剂组的4年IDFS率分别为82.7%和75.4%(95% CI 3.0%-11.5%),4年DDFS率分别为86.5%和79.1%(95% CI 3.6%-11.3%)。OS、IDFS和DDFS的分析证明了主要亚组的益处[5]。
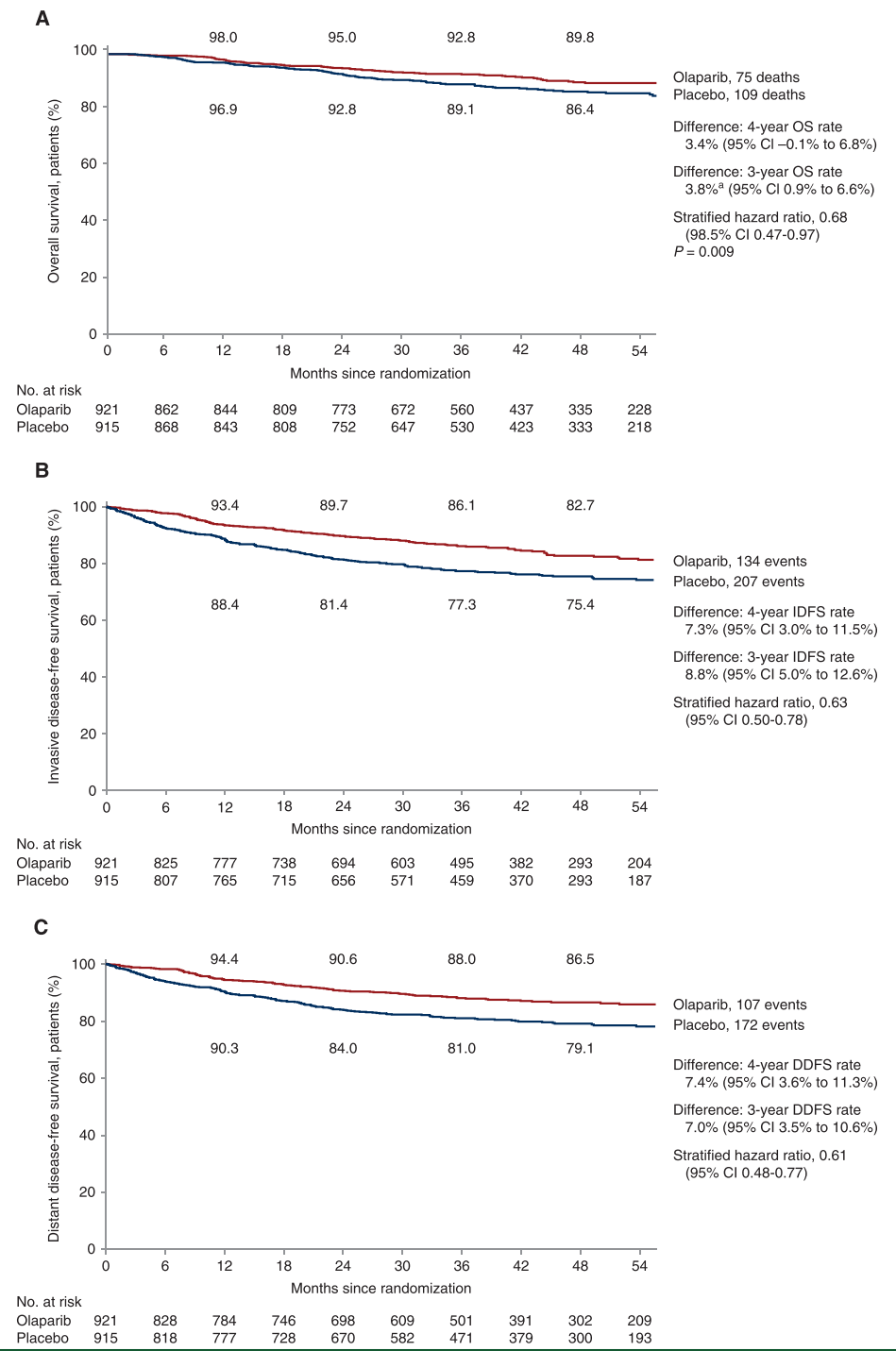
图:OlympiA研究中奥拉帕利和安慰剂治疗的Kaplan-Meier生存估计。来源:参考资料[5]
基于上述研究结果,奥拉帕利已于2022年3月获美国FDA批准,成为第一个被FDA批准用于治疗BRCA胚系突变晚期乳腺癌的靶向药物。此外,中国国家药品监督管理局药品审评中心(CDE)也已在受理适应症“奥拉帕利单药或与内分泌治疗联合用于既往接受过新辅助或辅助化疗的胚系BRCA1/2突变的HER2阴性早期高危乳腺癌成人患者的辅助治疗”的上市申请,有望尽快造福我国乳腺癌患者。
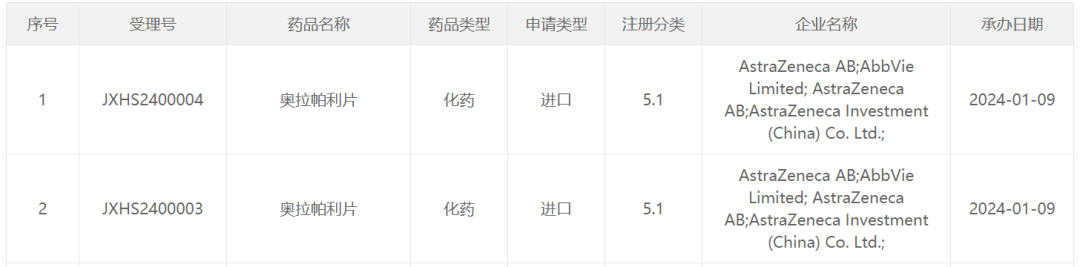
图:奥拉帕利的乳腺癌适应症上市申请已获得受理,来源:CDE官网
除指导治疗之外,BRCA1/2基因检测在评估遗传风险方面也具有重要应用意义。
肿瘤家族史和致病性遗传突变是乳腺癌的高危风险因素,《基于靶标指导乳腺癌精准治疗标志物临床应用专家共识(2022版)》[4]中提出,为了评估遗传风险,建议对相关高风险人群进行遗传咨询及胚系BRCA1/2基因检测。JAMA发表数据显示[6],BRCA1/2突变携带者至80岁时乳腺癌累积风险分别为72%(95% CI 65%-79%)、69%(95% CI 61%-77%)。乳腺癌发病率从成年后早期迅速增加,直至30~40岁(BRCA1突变携带者)、40~50岁(BRCA2突变携带者),保持相似恒定的发病率(每年20-30‰)直至80岁。
在辅助手术决策方面,携带胚系BRCA1/2突变的乳腺癌患者行保乳术后局部复发风险增加,对侧乳腺癌风险增加,因此携带此类型突变的乳腺癌患者,临床医生应慎重讨论是否采取全乳切除术和预防性对侧乳腺切除术[7]。
2 PIK3CA、AKT、PTEN、CDK4/6基因
对于HR+/ HER2-晚期乳腺癌患者,CDK4/6抑制剂是重要治疗方法之一,但大多数患者仍会进展并产生耐药性,因此明确基因突变状态有助于耐药后用药选择。研究发现,PI3K/AKT/mTOR信号通路在乳腺癌中广泛激活,与乳腺癌的发生、发展以及post-CDK4/6耐药密切相关[8]。在此通路的靶向药物研发中,AKT抑制剂Capivasertib为CDK4/6抑制剂经治HR+/HER2-晚期乳腺癌患者带来了新曙光。III期CAPItello-291研究显示,通过基因检测明确携带PIK3CA/AKT1/PTEN基因变异的HR+/ HER2-的局部晚期或转移性乳腺癌患者,使用Capivasertib联合氟维司群治疗中位PFS为7.2个月,相对安慰剂组的3.6个月实现了翻倍的生存获益,并且在CDK4/6抑制剂经治患者中,也观察到显著的PFS改善[9]。
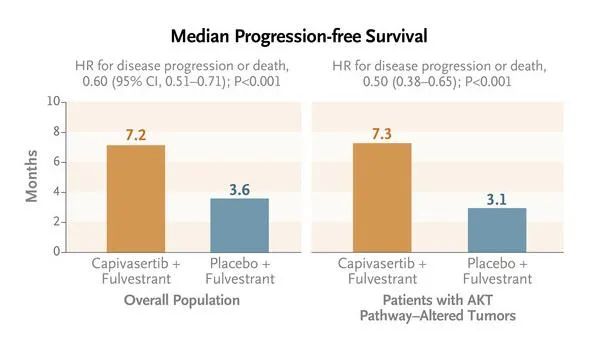
图:III期CAPItello-291研究,Capivasertib联合氟维司群对比安慰剂联合氟维司群治疗的mPFS,来源:参考资料[9]
基于此,乳腺癌NCCN指南(2024 V1)推荐,对于PIK3CA或ATK1或PTEN突变的HR+/HER2-绝经后乳腺癌患者,二线治疗推荐Capivasertib联合氟维司群(Ⅰ级推荐)[10]。目前,我国CDE也已经受理了Capivasertib的Ⅰ类新药上市申请。
此外,PIK3CA基因突变可作为预测ER+乳腺癌PI3Kα特异性抑制剂阿培利司疗效的敏感性标志物;CDK4/6突变状态则能提示内分泌用药选择,且CCNE1高表达、Rb缺失、TK活性等在预测CDK4/6抑制剂疗效中也具有潜在价值。
3 HER2基因
HER2+乳腺癌是异质性极为复杂的肿瘤。约4%的乳腺癌患者携带HER2基因变异,其中点突变发生率最高为2.0%~2.4%,且不同位点突变与不同的临床意义相关。HER2点突变可能导致传统抗HER2治疗的获得性耐药,如L755S、V777L、D769Y等突变提示对曲妥珠单抗原发或继发耐药,L755S、D769Y、V842I等突变提示对拉帕替尼耐药,其中有p.L755S突变的患者表现出对曲妥珠单抗和拉帕替尼耐药[4]。
4 ESR1基因
ESR1的基因状态可提示激素阳性乳腺癌患者治疗方案的选择和预后。
《基于靶标指导乳腺癌精准治疗标志物临床应用专家共识(2022版)》[4]中指出,ESR1突变是ER+乳腺癌继发性耐药的重要机制之一,也是预后不良的指标。2023年Journal of Clinical Oncology在线发表了对于HR+/HER2-晚期乳腺癌生物标志物检测的ASCO指南更新,增加了ESR1突变作为指导晚期HR+/HER2-晚期乳腺癌的生物标志物,推荐这部分晚期患者进行常规检测[11]。
NGS助力乳腺癌基因检测
NGS又称二代测序。传统的基因检测方法仅检测单一基因突变进而指导药物治疗,而NGS可以一次性检测多个基因,覆盖点突变、扩增、长片段缺失、融合等所有突变类型,提示多个潜在用药机会,能够高效指导乳腺癌的临床用药选择,在不同亚型乳腺癌中也有重要的参考价值。
例如,BRCA1/2基因的突变遍布2个基因的全长区域,没有热点突变,且突变分散、形式多样[12]。如果使用传统的Sanger测序、qPCR方法等对BRCA1/2整个基因进行检测,都无法一次性检测所有变异类型,并且耗时长、成本高。相比之下,NGS更为高效快速,且能够一次性对BRCA1/2基因所有外显子及邻近上下游区域内的突变同时进行检测。目前,NGS凭借其快速、准确、高通量、性价比高等优势,已经成为BRCA1/2基因检测的主流方法。
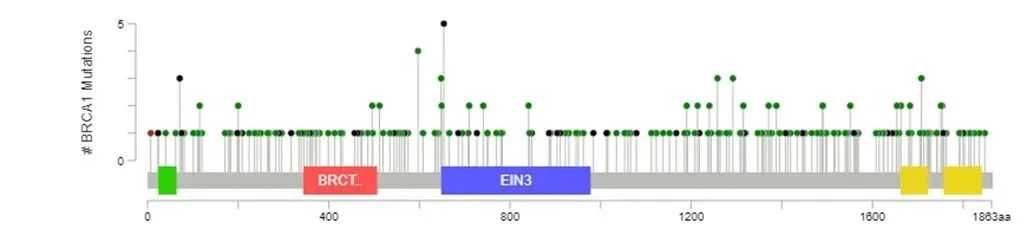
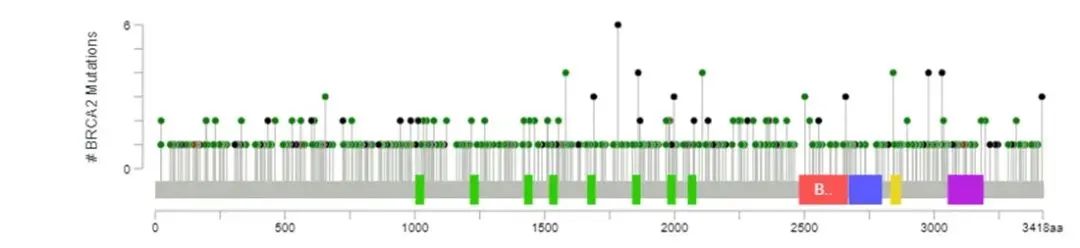
BRCA1/2基因突变的分布。来源:参考资料[12]
基于NGS的应用优势,乳腺癌NCCN指南(2024 V1)[13]已对多种基因检测推荐使用NGS方法,如胚系BRCA1/2突变检测、PIK3CA/AKT1/PTEN突变检测,ESR1基因检测、RET融合检测等。
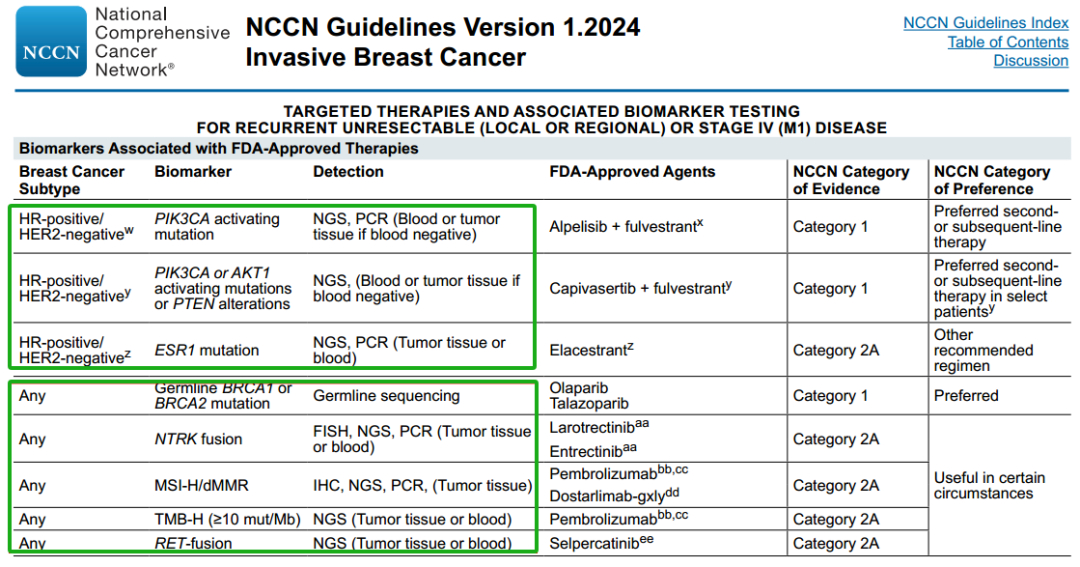

NCCN指南浸润性乳腺癌推荐检测,来源:参考资料[13]
规范的开展乳腺癌NGS基因检测对于乳腺癌的诊疗至关重要。
乳腺癌基因检测的样本选择:
《中国抗癌协会乳腺癌诊治指南与规范(2024版)》[14]指出,根据突变来源分为体系突变检测和胚系突变检测。体系突变检测应首选组织标本,对于无法获得组织标本的患者,可采血进行液体活检检测。胚系突变检测一般采用血液、白细胞检测,还可选择唾液、口腔拭子等样本。
乳腺癌NGS检测的panel选择:
指南提出:临床上可采用NGS对乳腺癌患者开展基因检测,基因检测应涵盖乳腺癌发生、发展过程中的重要基因、遗传易感性基因、高频突变基因、靶向用药相关基因和耐药相关基因等多类基因,并建议对肿瘤组织DNA和血液胚系DNA同时进行检测[13]。乳腺癌体细胞变异检测建议包含如下基因:TP53、ESR1、PIK3CA、AKT1、PIK3R1、HER2等;乳腺癌胚系变异检测建议包括常见的乳腺癌遗传易感基因和DNA损伤修复通路基因:BRCA1、BRCA2、PALB2、CHEK2、ATM、BARD1等;乳腺癌肿瘤组织CNV检测建议包含如下基因:HER2、MYC、CCND1、FGFR1、FGFR2、FGFR3等。此外还建议针对肿瘤组织的同源重组修复缺陷(HRD)以及肿瘤突变负荷(TMB)状态进行评估。
乳腺癌基因突变解读标准和规范:
可参照《美国医学遗传学与基因组学学会及美国分子病理学会序列突变解读标准和指南》、《美国分子病理学会、美国临床肿瘤学会及美国病理学协会癌症序列突变解读和报告的标准和指南(2017版)》和《BRCA数据解读中国专家共识(2021版)》,同时,需特别关注中西方不同人群间的基因背景差异。
结 语
随着对乳腺癌分子生物学特征研究的不断深入和检测技术的持续发展,乳腺癌靶向治疗药物的研发也在不断迎来新的突破。但目前获批上市的NGS乳腺癌诊断试剂盒仍非常少,NGS检测在乳腺癌诊疗中的普及与规范化依然任重道远。
基因检测是肿瘤治疗的“指南针”,乳腺癌基因检测的规范化发展离不开研究单位、临床、政府相关部门等多方位合作。研发单位需要严苛地开展乳腺癌基因检测研发及相关临床试验,建立严格的生产质量管理体系,提升基因检测的灵敏度、特异性、安全性和有效性;临床需要进一步提高医生和患者对乳腺癌基因检测的认知水平和送检观念,推动乳腺癌基因检测在临床上的更多应用;相关部门则需要加大对乳腺癌基因检测基础研究开展和产品资质的审批监管,推动乳腺癌基因检测的规范化管理。可以预见的是,通过多方合作整体提升我国乳腺癌基因检测水平,将为患者带来更多生存获益和生活质量的提升。
参考资料:
[1]Global cancer burden growing, amidst mounting need for services,IARC,2024.
[2]Cancer incidence and mortality in China, 2022,Journal of the National Cancer Center,2024.
[3]雷正武,不同分子分型乳腺癌的临床病理特征与预后的关系,重庆医科大学,2021.
[4]基于靶标指导乳腺癌精准治疗标志物临床应用专家共识(2022版)
[5] Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol. October 10, 2022. DOI:https://doi.org/10.1016/j.annonc.2022.09.159
[6]Kuchenbaecker,K ,Antoniou,A et.al.Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. JAMA. 2017;317(23):2402-2416.
[7] Management of Hereditary Breast Cancer:American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020
[8]PI3K/AKT/mTOR信号通路抑制剂治疗乳腺癌临床应用专家共识,中华肿瘤杂志,2022.
[9] Capivasertib in Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med. 2023. DOI: 10.1056/NEJMoa2214131. https://www.nejm.org/doi/10.1056/NEJMoa2214131
[10]乳腺癌NCCN指南(2024 V1).
[11]Testing for ESR1 Mutations to Guide Therapy for Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Metastatic Breast Cancer: ASCO Guideline Rapid Recommendation Update. Journal of Clinical Oncology,2023. https://doi.org/10.1200/JCO.23.00638
[12]Varol, U., Kucukzeybek, Y., Alacacioglu, A., Somali, I., Altun, Z., Aktas, S., & Oktay Tarhan, M. (2018). BRCA genes: BRCA 1 and BRCA 2. Journal of B.U.ON. : official journal of the Balkan Union of Oncology, 2018, 23(4), 862–866.
[13]乳腺癌NCCN指南(2024 V1).
[14] 中国抗癌协会乳腺癌诊治指南与规范(2024年版),中国抗癌协会乳腺癌专业委员会等,2024.